光扳机的工作原理及其应用
2014-02-23林秋宁杨云龙包春燕朱麟勇
林秋宁,杨云龙,方 倩,包春燕,朱麟勇
(华东理工大学 精细化学研究所 结构可控先进功能材料及其制备教育部重点实验室,上海200237)
“光扳机”分子也称作“光可去除的保护基团”(photoremovable protecting groups)或“光不稳定有机分子”(photolabile organic molecules)和“光笼分子”(photocage),是指一类重要的光响应分子,它们受光激发后能够发生分子内化学键剪切断裂(如图1),并有效释放被其保护的有机分子或基团[1,2]。由于该类分子最早只是偶尔用于有机合成中的官能团的保护/去保护,并未引起人们的广泛注意,因此在国际命名上也显得比较混乱和不统一。在这,我们统一称其为光扳机(phototrigger)。上世纪末,该类分子成功应用于生物信号分子的光活化,体现出非物理接触、时空二维可控的得天独厚的优势,引起了化学和生物学界的广泛关注,并发展成为光调控蛋白、基因、细胞甚至生物活体行为的一个必不可少的手段。当前,该类分子已经发展成为一类非常重要的光响应分子,并向生命及材料科学等其它应用领域快速渗透。
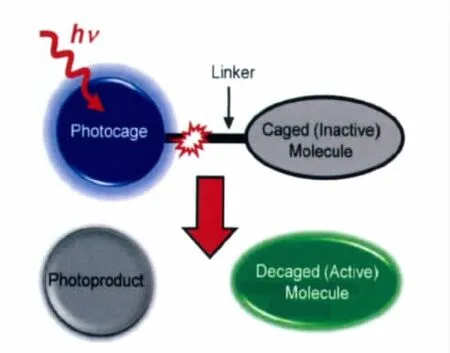
图1 光扳机的工作原理Work mechanism of phototriggers
1 光扳机的基本要求
能发生光剪切断裂的分子非常多,但一个具有生物应用潜质的光扳机分子应具备如下的基本条件:1)有效溶解在生理介质中,并保持优异的暗场和水解稳定性;2)激发波长应该大于300nm,以避免对生物活体的光损伤;3)大的摩尔消光系数,保证对光的充分吸收;4)足够的光解速度和量子效率;5)清晰、稳定的光解路径和足够高的光释放产率;6)光解副产物无明显的生物毒性,并且它的吸收不能与光扳机分子过于重叠,以保证不干扰光解反应。
2 光扳机的种类与基本工作原理
光扳机按照光解类型可以分成两类:直接光解型光扳机(direct photolysis phototrigger)和敏化光解型光扳机(photosensitized trigger)。直接光解型光扳机是指光扳机吸收特定波长后能够使其化学键断裂从而释放离去基团。敏化型光扳机是指光敏剂吸收光之后通过光诱导电子转移或其它机制将光剪切分子敏化并诱导发生化学键断裂从而释放离去基团。由于敏化型的应用非常有限,故不作进一步陈述,以下所指光扳机都是指直接型的。
常见的光扳机主要包括:邻硝基苄基类,芳香基甲酮类,芳香苄类和香豆素类等。
2.1 邻硝基苄基类光扳机
邻硝基苄基类(o-Nitrobenzyl,NB)光扳机是较早研究、也是目前应用最为广泛的光响应分子,尽管它仍然存在一些不足之处。早在1970年,诺贝尔奖获得者Woodward教授[3]就把它作为一个光可去除的保护基应用在有机合成上。它具有图2所示的基本结构特征。NB类光扳机具有广谱的基团保护/去保护特性,它可以通过硫醚/醚键或硫氰/碳酸酯键保护羟基或巯基;也可以通过磷酸或羧酸酯键保护磷酸或羧酸;或通过异氰酸酯键保护氨基。
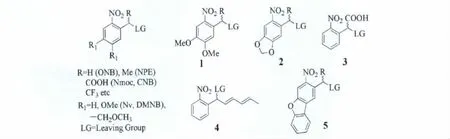
图2 邻硝基苄基类光扳机结构示意图The structures of ortho-nitrobenzyl phototriggers
NB类光扳机的光解机制研究的非常广泛,图3表示了目前普遍认可的机理[2]。光激发NB之后,首先发生的是一个硝基抽氢酸化,再环化重排发生羟基转移,形成不稳定的亚硝基的化合物,进一步经过分子内整合释放保护基团和邻-亚硝基芳香醛或酮的光解副产物。其中的硝基酸化和亚硝基的两个中间体已经得到了闪光光解或瞬态傅里叶红外光谱确认[4,5]。另外,硫氰/碳酸酯键或异氰酸酯键在释放—SH、—OH或—NH2的过程中,会伴随一分子二氧化碳产生。
只有NB基本母核结构的光扳机无法直接应用到生物体系中,因此大量的工作围绕NB结构做分子修饰以期:1)改善水溶性;2)长波长化,因为NB母核的吸收波长非常短(300nm以内);3)消除光解副产物的亚硝基,因为芳香亚硝基具有非常强的吸收,会和正常的光扳机竞争吸收并干扰光解,同时芳香亚硝基可能存在一定的生物毒性。
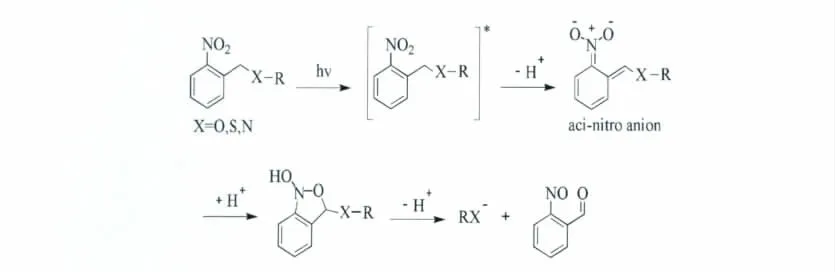
图3 邻硝基苄基类光扳机光解机理[2]The photolysis mechanism of ortho-nitrobenzyl alcohols
苯环显然是最方便的修饰位点。在苯环上引入两个相邻的甲氧基(图2结构1),就能使得NB类光扳机的吸收波长红移(大于350nm),甚至在420nm的光激发都能发生有效的光解。毫无疑问,该类二甲氧基化的NB光扳机,由于合成相对简单,同时具有优异的光解性能,已经成为当前应用最为频繁的光扳机之一。另外,为了限制两个甲氧基的构象自由,以减少激发后分子热弛豫对光能的损耗,研究者通过亚甲基将两个氧连接固定并形成苯并五元环(图2结构2),结果发现后者比前者的光解量子效率(Φchem)整整提高了6倍,并被成功用于DNA芯片的自动合成[6,7]。
苄基位点修饰也提供了不错的机会。为提高水溶性,Hess课题组[8]首先在NB母核的苄基位点引入一个COOH(图2结构3),结果发现其光解释放速度比原化合物高出许多倍。在这基础上,Bassani和 Schaper课 题 组[9,10]在 拓 展 NB 光扳机的吸收波长的同时都发现苄基位点引入一个COOH,不仅会增加水溶性,同时其光解速度会比母分子提高2-3个数量级。另外,为消除光解副产物的亚硝基,Pirrung课题组[11]提出了一个非常巧妙的设计,在苄基位点上引入了1,3-戊二烯基团,它能和光解产生的亚硝基迅速的发生Diels-Alder成环反应(图2结构4),在消除亚硝基的同时还能有效提高光解速率。总的来说,在苄基位点上修饰,大多情况下比母分子的光解速率有所提高。
另外,通过苯并增加共轭度的手段,也能有效的将NB光扳机的吸收红移。例如Singh和Khade[12]将NB分子的苯环核替代为萘环或7-甲氧基萘环,发现其吸收峰红移至380nm,同时保留了可以接受的光解量子效率,在乙腈水混合溶剂中其Φ=0.08~0.16。Ellis-Davies[13]等将二苯并呋喃替代苯环(图2结构5),结果发现不仅大幅度红移了光扳机的激发波长,保留了快的光解速度,并且大幅度提高了双光子的激发能力。
2.2 芳香基甲酮类光扳机
芳香基甲酮类(Arylcarbonylmethyl,ACM)光扳机具有如图4所示的基本结构。它们光扳机行为是基于经典的“三重态抽氢”光化学机制[2]。其中,羟基苯甲酮类(p-hydroxyphenacyl,pHP)是研究最为广泛的一种芳香基甲酮类光扳机。它有明显的优势和特点:1)合成相对简单;2)水溶性好,在生物缓冲溶液中稳定;3)光解的副产物明确,无明显生物毒性;4)光解速率快并且光解产率较高。图4是常见对羟基苯甲酮类光扳机的结构示意图。
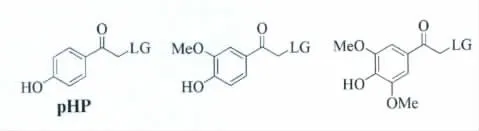
图4 对羟基苯甲酮类光扳机的结构The structures of p-hydroxyphenacyl(pHP)phototriggers
Givens课题组对羟基苯甲酮类光扳机做了相当多的工作,利用它来保护生物活性物质:ATP[14]、磷 酸[6]、谷 氨 酸[15]、γ-氨 基 丁 酸 (GABA)[15]、缩二肽(Ala-Ala)[16,17]等。对它们的光解情况进行了研究,发现光解产率从0.1到0.4不等;光解副产物与离去基团和光解实验所用溶剂有关,例如对羟基苯甲酰磷酸酯在Tris缓冲溶液中光解,得到的光解副产物为对羟基苯乙酸;然而,在甲醇或叔丁醇溶液中光解,得到的光解副产物为对羟基苯乙酮。另外,在光解实验中,当加入2-萘磺酸钠能有效猝灭光解,间接证实该光解反应是个典型的三线态过程。
对羟基苯甲酮类光扳机的缺点是吸收波长比较短,当波长大于300nm时,其摩尔消光系数非常低。为了使对羟基苯甲酮类光扳机的吸收波长红移,以适合广泛的生物应用,Conrad课题组在苯环的3位和5位引入甲氧基生成3,5-二甲氧基-对羟基苯甲酮类光扳机,新扳机的吸收波长能达到400nm,但是光解产生γ-氨基丁酸(GABA)产率低,只有0.03~0.04[18]。图5是对羟基苯甲酰类光扳机光解机理示意图。
2.3 芳香苄类光扳机
芳香苄类(Arylmethyl,AM)光扳机的机制与下一节的香豆素光扳机的工作原理非常相似,是一个单重态主导的光均裂或异裂的光化学过程。从某种层面来说,香豆素光扳机同样具有芳香苄的结构特征,只不过无论是香豆素光扳机的研究程度还是它的综合性能或应用都更为全面和系统,因此,香豆素光扳机通常都被单独列为一个体系。
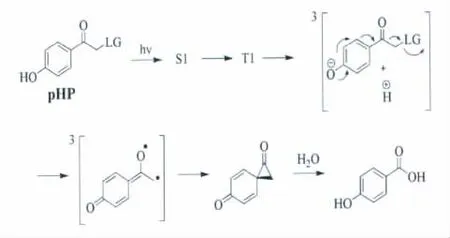
图5 对羟基苯甲酮类光扳机光解机理[2]The photolysis mechanism of p-hydroxyphenacyl(pHP)phototriggers[2]
芳香苄类光扳机的芳香基团结构包括:3,5-二甲氧基苯[19]、二苯并呋喃[20]、二苯并硫杂呋喃[21]、芘[22]、蒽醌[23]、邻羟基萘[24,25]和7-羟基喹啉[26-28]。以上光扳机大多在综合性能上或多或少都有某些缺陷,因此在往后的应用中有所限制。但是7-羟基喹啉有所不同,Dore课题组在7-羟基喹啉分子的8位引入溴原子生成8-溴-7-羟基喹啉(BHQ),并把它作为光扳机来保护羧酸类分子[26]。8-溴-7-羟基喹啉类光扳机的优点是:光解效率比一般光扳机高,吸收峰值能达到370nm,对双光子激发有一定的灵敏度,水溶性好。图6是常见的7-羟基喹啉类光扳机的结构示意图。

图6 8-溴-7-羟基喹啉类光扳机的结构The structures of 8-bromo-7-hydroxyquinoline(BHQ)phototriggers
2006 年 Dore 课 题 组 对 8-溴-7-羟 基 喹 啉(BHQ)的光解机理及可以保护的化合物类型进行了 研 究[27]。 通 过 研 究 表 明 8-溴-7-羟 基 喹 啉(BHQ)可以用来保护羧酸类、磷酸类、二醇类化合物,并且在模拟生理的条件下进行单光子光解或双光子光解。通过时间分辨红外、18O-标记测试证实了8-溴-7-羟基喹啉(BHQ)光扳机的光解是溶剂辅助的一个单线态主导机制。2009年该课题组进一步对8-溴-7-羟基喹啉(BHQ)光扳机进行了不同基团取代修饰,研究了不同取代基对光扳机的单光子光解和双光子光解的灵敏度的影响[28]。把溴原子替换为硝基、氰基或氯,另外把羟基更换为二乙氨基或巯基,发现不同的修饰对光扳机的光物理和光化学的性质有很大的影响。在单光子条件下,氰基的光解速率是溴原子的三倍,氨基取代和巯基取代的光扳机的光解产率比羟基取代的光扳机的低了一个数量级。图7是8-溴-7-羟基喹啉(BHQ)光扳机的光解机理。

图7 8-溴-7-羟基喹啉(BHQ)光扳机的光解机理[2]The photolysis mechanism of 8-bromo-7-hydroxyquinoline(BHQ)phototriggers[2]
2.4 香豆素类光扳机
香豆素类(coumarinyl-4-methyl,CM)光扳机是以C4位亚甲基化的香豆素分子为基础(图8),通过C4位亚甲基和其它分子基团形成光可剪切的化学键,实现光扳机的功能。Givens在上世纪八十年代首次用7-甲氧基香豆素-4-羟甲基衍生物实现了光剪切释放磷酸化合物[29]。相对于其它的同类分子,这种新近发展起来的光功能分子具有许多独到的优势:1)长波长激发,大的摩尔消光系数;2)具有强的荧光发射,可以有效示踪并监视整个的使用过程;3)非常快的光解速度;4)有效的双光子近红外光激发。近些年来,研究者意识到了这些优势,并不断地拓展香豆素光扳机的应用面,它将成为最具发展潜力的光扳机[30,31]。
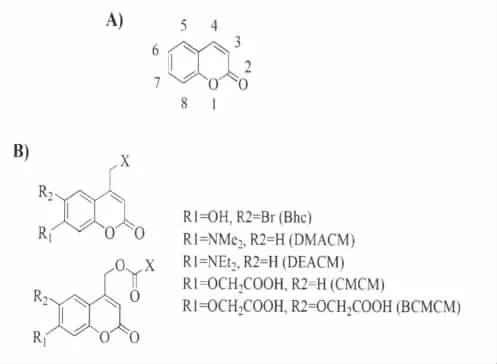
图8 香豆素类光扳机的结构The structures of coumarin phototriggers
与邻硝基苄基类光扳机的光解机理完全不同,香豆素光扳机的光剪切和其激发单重态(S1)直接相关,也称“单重态主导”的光剪切机制(图9)[32,33]。当香豆素光扳机吸收光能后被激发到单重态(S1),光能被分作三部分,其一通过热弛豫回到基态,其二通过发射荧光回到基态,其三发生光化学反应,C—X键异裂光剪切。异裂最初形成的是香豆素亚甲基阳离子和离去基团阴离子的紧密离子对中间体。香豆素亚甲基阳离子或者和周边的亲核试剂例如水或溶剂形成稳定的香豆素光解副产物,或者逃离溶剂笼和其它的亲核试剂反应,或者紧密离子对重新结合回到基态。虽然有证据表明香豆素的单重态存在系间窜越的可能[34],但是还没有任何迹象证实该光化学反应和三重态有任何关联。
瞬态吸收光谱进一步证实C—X键的异裂光剪切过程是所有光扳机里光释放速度最快的,其速率常数达到了2×1010s-1[35]。然而紧密离子对的重新结合却主导了下一步反应,它的速率是溶剂或其它亲核试剂捕获香豆素亚甲基阳离子的10倍。通过同位素标记的手段,证实该单重态主导的光剪切发生在C—X键,而不是酯键[36]。在香豆素上引入电子给体或者低pKa值的离去基团将有效阻止紧密离子对的重新结合并促进该光解反应的进行[33]。

图9 香豆素光扳机的光解机理[32,33]The photolysis mechanism of coumarin phototriggers[32,33]
和邻硝基苄基类光扳机不同的是,如果醇或酚羟基及巯基直接通过形成硫醚/醚键的方式和香豆素亚甲基相连,由于这些基团离去性差,会抑制光解的发生。然而它们通过硫氰/碳酸酯的连接方式,却有非常快的光解速度。光解首先释放一个硫氰/碳酸,进而脱去二氧化碳最终释放出羟基或巯基。研究表明,脱二氧化碳通常是个缓慢过程,在无酸或碱催化的情况下,其速率常数在10-3s-1左右[37-40]。同样,对氨基的保护通常是以异氰酸酯键的形式实现,然而,光释放出来的异氰酸酯阴离子的脱二氧化碳过程更为缓慢,成为该光解反应的最终决速步骤,因此香豆素光扳机释放氨基的反应往往和体系的pH值直接关联[38,40-42]。和邻硝基苄基类光扳机相同,对羧酸和磷酸的保护通常直接以羧酸酯及磷酸酯的方式实现。
香豆素光扳机与相应的被保护基团之间的连接,通常是通过以下几个中间体来完成的[43](图10)。最为通用的中间体是C4位为羟甲基香豆素,通过对应的酰氯,可以方便的获得磷酸酯、羧酸酯和硫酸酯以及碳酸酯、异氰酸酯和酸酐衍生物等。C4位为溴甲基时可以通过亲核取代反应和相应的氨基、巯基和羧酸反应。C4位为醛基时可以和二醇例如乙缩醛反应,也可以非常方便的转变为重氮盐,它被证实是保护复杂磷酸酯,特别是环状核苷酸最为有效的中间体[44,45]。
和其它光扳机一样,生物体系的应用希望光扳机激发波长长波长化并有适当的水溶解性。香豆素母核的C6和C7位提供了合适的修饰位点。第一代的香豆素光扳机,一般在C7位引入烷氧基团[44,46,47],使得光扳机的激发波长能有效延展到350nm以上,能满足一般的生物应用,若在C6位和C7位同时引入烷氧基,能比单独在C7位引入的香豆素的吸收波长再红移30nm[34,48,49]。C6位引入卤素例如溴,能有效降低C7羟基的pKa值,使得羟基在中性生理条件下完全电离,在提高水溶性的同时也使得光扳机的最大吸收波长红移了60nm。C7位氨基的取代物被称作第二代香豆素光扳机。它的吸收峰值在350~400nm之间,而且对体系的pH值没有那么敏感,部分光解量子效率达到了0.21~0.28。在氨基部位上可以非常方便的修饰极性基团例如羧基等,有效的改善光扳机的水溶性。苯并香豆素也被应用到光扳机当中,但光解和光学性质没有明显的优势[50-52]。表1统计了文献所报导的香豆素光扳机的化学结构和基本光化学性质。

图10 香豆素光扳机保护的化合物的合成方法[43]Synthetic approaches to coumarin-caged compounds[43]

以上工作都是对香豆素光扳机进行不同的化学修饰以改善其光学性质,为了拓展其在各种光控释放体系中的应用,便于活性分子与载体的连接,我们课题组基于7-氨基香豆素光扳机为主体结构,在不改变光扳机光化学及光物理性质的前提下,设计合成了一系列具有活性连接基团的、不对称取代7-氨基香豆素光扳机1~9(图11)[53],该系列香豆素光扳机包含了大部分常用的生物键连的官能团,能通过简单的酰胺键缩合、Michael加成和“click”反应等连接载体从而构筑稳定的光控释放体系,为构筑光控释放体系提供了良好的分子平台。
3 光扳机的双光子激发
到目前为止,几乎所有的光扳机都局限在紫外光,最长也不超过蓝光(<450nm)激发。虽然发展可见光激发的光扳机一直是业内的追求目标,但是随着激发波长的红移,急剧减小的光能不足以驱动一个光剪切反应的发生。然而,光控制技术在生物领域的应用对光扳机的长波长化的呼声越来越高。特别是在活体的应用上,富含血红素或黑色素的组织对波长低于650nm的光有强烈的吸收,而水对波长大于950nm的光强烈吸收并产生明显的热感(图12)[54]。因此光扳机最终要应用到活体上,实现深组织穿透并避免紫外光毒性,必须满足650~950nm近红外激发的所谓的“光疗窗口”[55-57]。

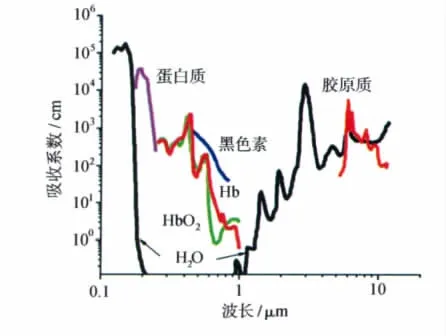
图12 生物组织中常见的生色团在0.1~12μm光谱区域中的光学吸收系数[54]Optical absorption coefficients of principal tissue chromophores in the 0.1—12μm spectral region[54]
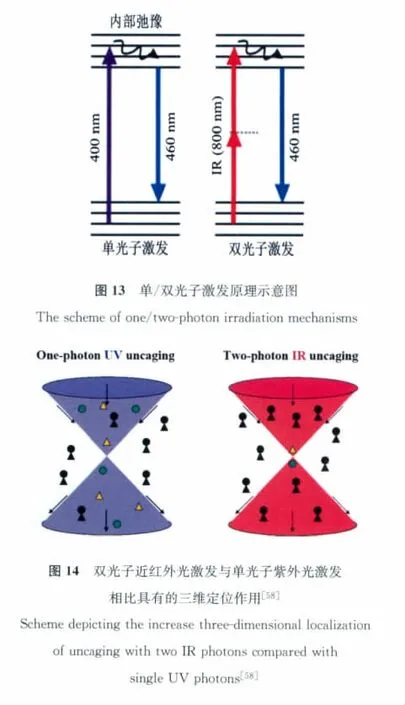
采用双光子技术是克服光扳机激发波长偏短的有效手段之一。双光子属于非线性光学的范畴,它是指在高能激光下,生色团同时吸收两个近红外光子,达到与短波长的光(单光子)直接激发相当的激发效果(图13)。为避免持续高能激发的危害,往往采用飞秒脉冲技术,将高能压缩在一个只能持续若干飞秒的一个脉冲当中,有效降低了激光的平均能量。双光子技术除了有效实施近红外激发之外,还能利用“能垒”的效应实现三维定点光激发[58](图14)。
衡量一个化合物的被双光子激发的能力,通常采用双光子截面来表示。用它乘以光扳机的光解量子效率就可以表征光扳机的双光子激发下的光解能力(δun)。一般认为双光子激发应用到生物体系当中,光扳机的双光子截面必须至少达到1 GM[59,60]。事实上传统光扳机的双光子截面都很小。表2统计了相关的文献对光扳机的双光子激发研究的一些参数[43]。可以看到邻硝基苄基类光扳机双光子激发能力较小。值得注意的是,双光子激发与波长也有直接关联,大多情况在740~750nm比800nm的δun大很多。提高常用染料的双光子吸收截面主要有以下手段:1)引入对称元素,可以使得邻硝基苄基类光扳机的截面提高5~12倍[61];2)引入 D-π-A 结构或加大共轭度,可以使得邻硝基苄基类光扳机的δun达到3~5 GM[62-64],但是这种方法会使得分子体积急剧增加,降低溶解性和分子修饰性。香豆素光扳机本身就已经具备一定的双光子吸收截面,通过在C6位引入溴原子可以有效增加双光子激发能力,在740nm激发下,双光子截面可以提高到0.35~2 GM[65],进一步增加溴原子数,δun还会进一步提高[58]。近期,我们课题组通过在香豆素的7位引入D-π-A结构,大幅度的提高了光扳机的双光子截面,虽然同时降低了光解量子效率,但是δun还是比传统7-氨基香豆素高出两倍多[66]。Dore教授开发的8-溴-7-羟基喹啉(BHQ)光扳机也具有一定的双光子激发能力,在740nm激发下,δun达到0.6~0.9GM,然而用氰基或氯和硝基替换溴会大幅度降低双光子激发敏感性[28]。Jullien开发的2-羟基肉桂酰基(2-hydroxycinnamyl)光扳机也能够有效被双光子激发,其δun最高能达到4.7 GM[67]。
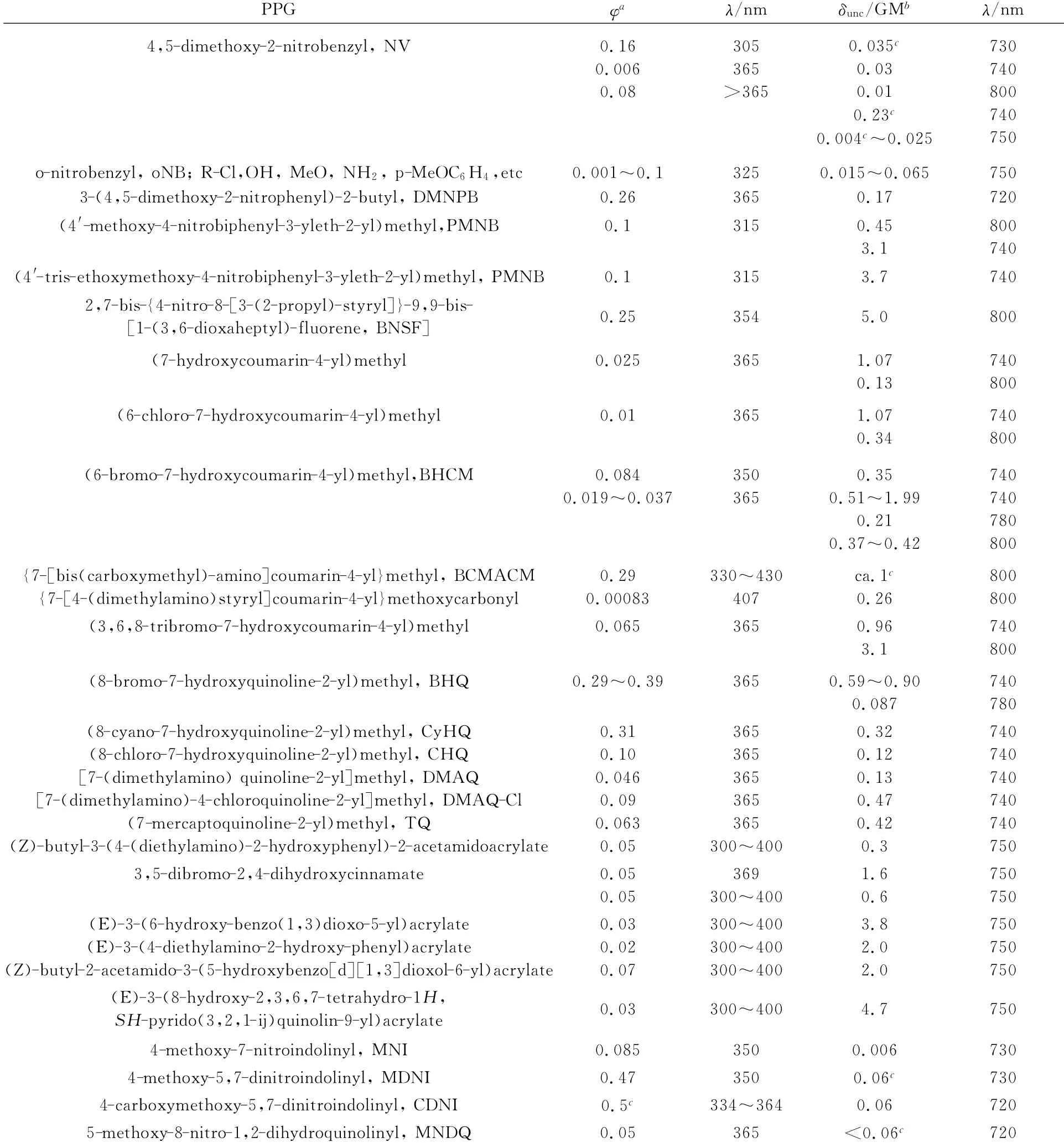
表2 各种光保护基团的单/双光子激发的光解量子产率[43]Single-photon and two-photon uncaging quantum efficiencies of photoremovable protecting groups(PPG)[43]
如图15所示,我们课题组利用双光子吸收的7-氨基香豆素光扳机作为连接抗癌药物苯丁酸氮芥和介孔硅载体的光敏桥接基团,构筑成了一个可以用400nm单光子可见光或800nm双光子近红外光(NIR)激发的光控纳米载药体系[68]。该体系首次实现双光子激光精确控制药物释放,有效避免了具光毒性、弱穿透力的紫外光的使用。
虽然光扳机的双光子激发已经取得了一定的进展,但是要满足更为广泛的生物应用,显然还是远远不够。发展具有大的双光子截面但又不影响光解量子效率的光扳机的任务依然任重道远。
4 光扳机的应用概览

图15 可单/双光子激发的载药体系光解释放药物的示意图Schematic representation of photolysis for drug release under one-or two-photon excitations
近些年来,光扳机的应用拓展异常的快,但所有应用都是基于光扳机的三个基本功能:1)光激活(photo-activation),2)光剪切(photo-cleavage)和3)光释放(photo-release)实现对目标体系光调控。确切的说,光激活是指在活性位点通过化学键连接光扳机的方式,对活性小分子或生物大分子的功能实现“屏蔽”,在需要的时候,通过光照解离光扳机,实现功能分子的活化。光剪切主要是针对生物大分子体系或高分子材料体系,通过光扳机的光解,控制大分子主链的剪切或降解,实现光控制的目的。光释放是指通过光扳机作为一种链接桥(linker)将预先被固定在界面或载体上的功能分子,通过光解的方式实现光可控释放;或者是将固定在界面或载体的某些被光扳机“屏蔽”的活性基团,通过光解的方式实施释放,实现空间精确可控的“后修饰”。
从应用领域来看,目前光扳机主要是应用在生物和材料领域,下面分五个方面对光扳机的应用作简要的概述。
4.1 光激活荧光
光激 活 荧 光(photoactivatable fluorescence)是指经过光激发后能产生一个荧光发射的分子或基团,出现由“无”到“有”的荧光变化。光激活荧光提供了一个非常有效的标记手段来跟踪流体移动的路径和动力学过程,同时也应了当前快速发展的超分辨荧光显微的技术要求,提供了有效的分子探针。
光扳机应用于光激活荧光探针的研究,主要是基于以下两个基本原理:1)通过光扳机对染料的活性(一般是给电子)位点进行封堵,破坏染料既有的分子内共轭或电子转移的ICT机制,使染料失去固有吸收和荧光发射。一旦激发光扳机发生光解,释放出原有的活性位点,染料的吸收和荧光得以恢复。典型的包括,光扳机封闭芳香羟基,例如蓝色荧光的羟基香豆素[69]、绿色荧光的荧光素[70]或东京绿[71]和红色的试卤灵[72];光扳机封闭芳香氨基,例如罗丹明染料[73]。2)光扳机作为一个“连接桥”将相邻的发光染料和猝灭因子相连,猝灭因子通过光诱导电子转移(PET)或能量共振转移(FRET)机制将染料荧光猝灭,一旦光扳机光解后,猝灭因子离去,荧光染料得以恢复[74-76](图16)。
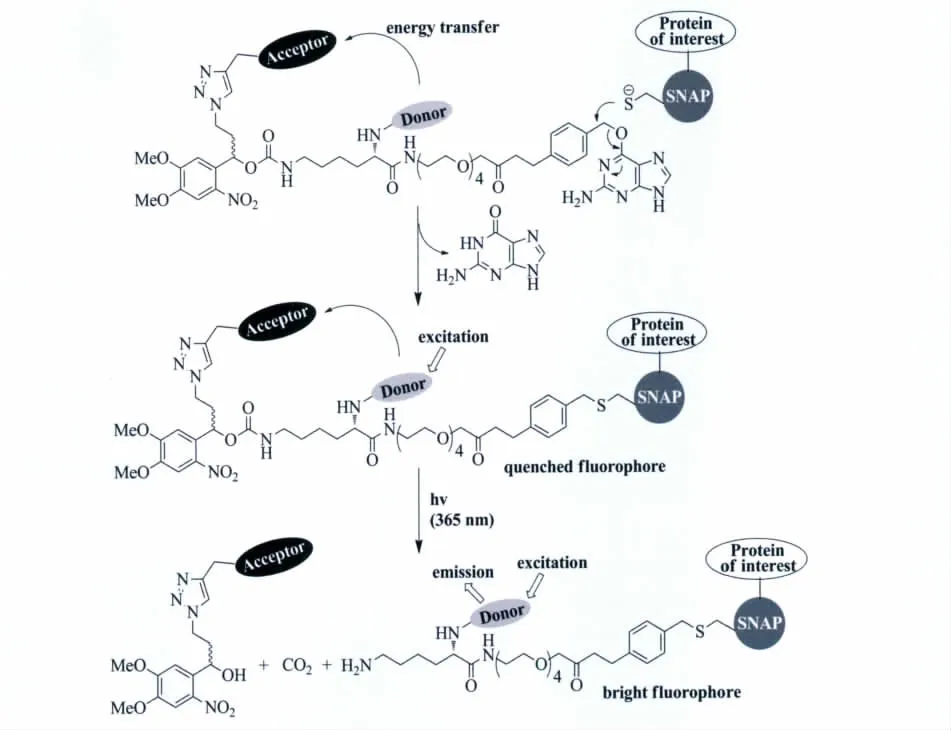
图16 基于FRET机制的光激活荧光探针的工作原理[76]The work principle of photoactivatable fluorescence probes based on FRET[76]
光激活荧光技术在细胞内流体的荧光标记及动力学跟踪有重要的应用。Li等[77,78]利用光激活荧光技术成功的测量了细胞间隙连接通道的分子转移的速度,并应用该技术,从时间空间分辨的角度上研究了分子内Ca2+对细胞间隙耦合的影响。另外,光激活荧光技术为传统的生物光学成像带来了新的突破。我们知道,常规的光学成像系统如共聚焦荧光显微镜由于光波的衍射作用,其最高分辨率只能达到微米尺度。为突破光学衍射极限,哈佛大学的X.W.Zhuang教授等,发展了超分辨荧光影像技术(super-resolution fluorescence imaging)[79,80],该项新技术在单分子荧光技术基础上,借助光活化或光学重建等手段,成功克服了常规光学影像不可逾越的光衍射壁垒,使得荧光影像从微米分辨率有效突破至纳米尺度。和具有同等分辨率的电子显微镜相比,荧光分子影像具有灵敏度高、选择性好、动态响应范围宽及测定条件更接近生命体的生理环境的优点,特别适合于活体及蛋白质分析中可靠的原位、实时、动态研究。目前超分辨荧光影像无论是PALM(photoactivatable localization microscopy)还是STORM(stochastic optical reconstruction microscopy)技术,其核心枢纽是具有光调控发光特征的荧光探针。光调控发光特征主要是指:光激活(photoactivatable)、光可逆转换(photoswitchable)或光不可逆切换(photoconvertible)。当前,适用于在超分辨荧光影像的探针主要是:1)具有光调控发光的荧光蛋白[81-83];2)在还原条件下能发生光调控发光的 Cy染料[84,85];3)具有光致变色的罗丹明染料[86]。虽然已经有不少关于光扳机类型的光激活发光的荧光探针报导,但是还没有一例成功应用于超分辨荧光显微技术,这可能跟探针能否有效进入细胞或标记在特定蛋白有关。
4.2 光激活生物活性小分子
光激活生物活性小分子是光扳机在生命科学的最早应用之一。一些光扳机保护的生物活性分子已经有成熟的商业销售。它们对帮助阐明某些重要的生命现象起到了决定性的作用。
光扳机保护的ATP是生物界经常用到的光可激活的生物活性分子[87],几乎所有的光扳机刚合成出来时,首先想到的就是用于光激活ATP。ATP的γ-位磷酸被光扳机酯化后,有效屏蔽了酶的催化水解,一旦光活化脱落光扳机后,ATP水解成ADP并释放能量。另一个通过磷酸酯键光扳机封闭的活性分子是环状核苷酸单磷酸酯(cGMP)。cGMP是参与了生命过程中多种信号传导的、非常重要的二级信号分子。它的光扳机化的化合物已商业化多年,最近,Kaupp等[88]基于7-氨基香豆素化的cGMP,利用光激活的手段,成功获得了海洋无脊椎动物的精子鞭毛cGMP通道的电压响应信号。这个工作拓展了光激活化学信号分子应用的新方向。
谷氨酸是哺乳动物神经元通讯的必不可少介质。它的光激活是神经生物学研究中非常重要的工具和手段,相关的分子同样已经商业化。最近的研究希望通过双光子激发,把该工具应用到体内并有效提高空间分辨精度。Ellis-Davies等应用了双光子技术在老鼠大脑内活化谷氨酸,获得了轴向空间分辨率在2μm的GABA-A和AMPA受体的分布图[90],同样,通过双光子激发技术,可以实现多模式光学控制单个神经元突触的膜电势[91]。钙离子同样是极其重要的化学信号载体。它管理很多的细胞功能,光激活释放钙离子同样是神经生物学的重要研究手段。诺贝尔奖获得者Roger Tsein对活化钙离子的研究有着重要的推动作用,最近Ellis-Davies对光激活释放钙离子的工作在Chem.Rev.做了全面的综述[89](图17)。
磷酸肌醇(IP3)是控制细胞内传导过程的重要成员之一。其中邻硝基苄基类光扳机封闭的1,4,5-IP3已经是商业化产品。这些光扳机封闭的IP3使得亲水的磷酸肌醇分子更容易穿透细胞膜进入细胞中。最近Ellis-Davies发展了两类新型的光可激活的1,4,5-IP3分子,被命名为 NV-IP3和 NDBF-IP3[92]。前者能够双光子激发,为研究星形胶质细胞-突触之间通讯提供了一个崭新的分子工具,后者光解量子效率是前者的5倍。Schultz合成了氨基香豆素光扳机化的磷脂酰肌醇磷酸酯PtdIns(3)P和PI(3,4,5)P3[93,94]。这些化合物具有非常好的膜穿透性,并能被细胞内酶水解有效去除磷脂保护基。利用PtdIns(3)P光激活的时间可控的特征,在HeLa细胞内,研究了磷脂酰磷酸单酯作为二级信号分子与磷脂酰肌醇-3-羟基激酶信号系统之间的关联。光可激活的信号分子还包括 NO[95]、辣椒素[96]及雷帕霉素[97]等。

图17 已被用于活细胞研究的光激活释放钙离子的光扳机以及相应离子螯合配体(EDTA,EGTA,BAPTA)的结构[89]Structures of all the Ca2+ cages that have been used in living cells,with their parent chelators(EDTA,EGTA,BAPTA)[89]
还有一大类生物活性分子包括激素或类激素类的光活化被应用到光调控基因表达。早在2000年,Koh教授首先采用光活化生物活性小分子雌激素的手段,实现光控基因表达[98],并系统研究了该体系包括多种雌激素的优缺点,并做了许多有效的改进[99,100]。之后,Lawrence教授通过光活化蜕皮激素也达到了同样的效果[101]。另外,Deiters教授建立了基于光活化异丙基-β-D-半乳糖苷(IPTG)的光控基因表达的体系[102]。2006年,Cambridge课题组成功开发了光活化四环素体系(Tet-ON)系统,首次实现了光控细胞基因表达的图案化(pattern)[103]。2009年,该课题组率先将Tet-ON系统应用到动物活体,以绿色荧光蛋白为模型,通过光活化小分子的手段,成功实现了老鼠胚胎内基因表达的时空可控[104]。
此外,化学药物同样作为一类具有生物活性的分子,不同程度地促进或者抑制着相应的生物行为从而起到治疗疾病的作用。近年,抗癌药物的光控制释放引起了广泛的研究兴趣,研究主要集中在抗癌药物的“适时”、“适地”、“适量”控制释放以达到对正常组织低毒副作用的有效治疗。目前,已有很多关于光控载药体系的报道,Rotello等通过硝基苯光扳机把五氟尿嘧啶抗癌药物连接到纳米金上,达到了五氟尿嘧啶的细胞外光控制释放杀死癌细胞的目的[105]。以Zink和Stoddart为代表的研究组,把小分子抗癌药物载入到生物相容性的介孔二氧化硅纳米载体,再以光敏感的分子封堵载体的孔,通过光照使封堵的分子离去,实现了介孔材料的“门控式”释药[106]。为了进一步提高光控抗癌药物释放体系的肿瘤组织选择性,我们课题组基于“激活型光扳机”的新概念[107],结合肿瘤组织的典型乏氧特征,提出了一个以肿瘤乏氧敏感的硝基咪唑“锁定”的香豆素光扳机,成功构造了一个新型肿瘤乏氧激活的光控纳米载药体系(图18)[108]。该体系基于药物释放的体内外双重控制的工作原理,在有氧的细胞条件下,香豆素的S1态通过光诱导电子转移(PET)机制被硝基咪唑猝灭,失去发荧光和光剪切的能力,不产生药物释放,对正常细胞“零”伤害;而在乏氧的细胞条件下,硝基特异性还原为氨基使得香豆素的PET机制受阻,香豆素光扳机被激活,“开启”了发荧光和光剪切的能力,释放出抗癌药物杀死癌细胞。该体系的成功构筑为今后病人一边光疗,一边享受日光浴提供了想象空间,也为今后实现无毒副作用的化学治疗提供了新思路。

图18 乏氧激活的光扳机在肿瘤细胞中的特异性光控药物释放The hypoxia-activated phototrigger specifically photo-releases drug to tumor cells
4.3 光调控多肽或蛋白的功能
功能性多肽在分子生物学中往往发挥激活或抑制蛋白功能的作用。通过多肽的活性位点的光扳机修饰,可以实现光激活多肽功能的效果。目前,光激活多肽功能的研究主要集中在诱导激酶磷酸化实现细胞周期的调控和调控RGD的细胞粘附。Lawrence等通过某种光扳机化的氨基酸并结合其它氨基酸获得光激活型多肽,光扳机化的多肽阻止了它和底物的作用,一旦光扳机光解后,该作用得以激活,成功实现了荧光指示的胞内蛋白激酶 C(PKC)磷酸化的时间空间可控[109,110](图19)。RGD多肽能通过整合素介导作用有效促进细胞的粘附。Stupp等[111]通过合成获得长链烷基疏水修饰并在肽链上光扳机化的RGD,该分子在水中能有效自组装形成纳米球,然而光激发后,却变成了纳米棒。和3T3细胞孵育,经光照后发现,RGD粘附部位的细胞骨架蛋白表达明显增加,表明光扳机的光解激活RGD的细胞粘附功能。另外,通过光扳机的光剪切作用也可以破坏多肽固有的功能,也能达到光调控的目的。Kron等[112]通过在酒酿酵母的信息素因子的肽链上引入具有光剪切功能的苯丙氨酸。该可光降解的肽链激活了交配通路(mating pathway)使细胞周期阻滞在G1期,光激发后,降解破坏肽链原有功能,使得阻滞的细胞周期得以恢复。
在蛋白上人为引入光激活因素,要比肽链复杂得多。最初,Lawrence等[113]采取将蛋白激酶Cys的残巯基直接烷化的手段,虽然取得了非常不错的结果,但是这种方法显然不具备广谱性,作用位点也不明确,重复性差。利用蛋白工程的氨酰-t-RNA合成酶/tRNA基因编码合成技术或已表达的蛋白生物连接(ligation)方法可以获得位点明确、可重复的光可激活的蛋白。Muir等[114]通过化学连接的方法,通过光激活有效控制目标蛋白的在细胞内分布及共振能量转移(FRET)过程。通过氨酰-t-RNA合成酶/tRNA基因编码合成技术,Schultz课题组实现光控来调节DNA聚合酶的功能[115],光控制细胞凋亡蛋白酶的活性[116]和光控来追踪蛋白转录因子PHO4在生物体内的空间分布[117]。Chen课题组也研究了通过光控来调节蛋白酶的活性[118]。

图19 通过邻位标记的具有荧光指示的蛋白激酶的光激活[110]Construction of a photoactivatable profluorescent enzyme via propinquity labeling[110]
4.4 光调控核酸的功能
通常在核酸例如DNA和RNA的分子骨架上修饰光扳机[1],就可以获得具有光调控功能的核酸分子。具体的说,在核酸的碱基上修饰光扳机就可以阻止所谓的Watson-Crick碱基配对。另外也可以在糖苷上的羟基或二酯磷酸上修饰,在二酯磷酸上修饰是最早采用的方法,通过光扳机的叠氮中间体和磷酸成酯反应,可以在DNA或RNA上获得随机的光扳机化核酸分子。当然也可以把光扳机作为连接桥,把糖苷的5位和另一个糖苷的3位连接起来,获得可光降解的核酸链。图20表示了这几种常用核酸修饰方法。光扳机化的核酸可以在DNA质粒上直接修饰,更多的研究工作是通过RNA的光扳机化修饰(位点更为精确,重复性好)来达到预期的光控目的。当前,光调控核酸的功能主要体现在光调控基因表达[119-121],另外 Heckel等通过光激活适配体 RNA实现了调控蛋白功能的目的[122]。
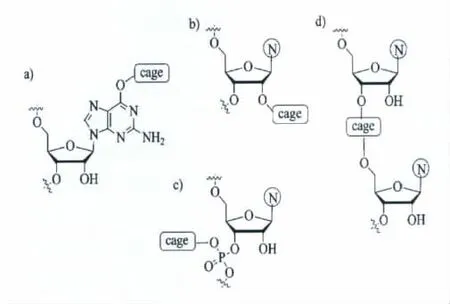
图20 不同封闭位置的光激活DNA/RNA结构概览[5]Overview of different caging group for photoactivatable DNA/RNA[5]
4.5 大分子、组装体及界面的光调控
近年来光扳机的应用从生物迅速渗透至材料领域,特别是在水凝胶、高分子自组装与解组装、界面微修饰等方面取得了许多重要的成果。与光扳机在生物应用多采用“光激活”有所不同的是,在材料上应用更多的体现光扳机的“光剪切”或“光释放”功能。虽然最终的应用都不尽相同,但是从基本原理出发,无外乎以下几个方面。
(一)通过光剪切高分子交联网络的方式,精确调控水凝胶、微凝胶的性能。2007年,Turro等[123]最早报导了利用光扳机制备可光降解的水凝胶。最近,Kros、Kasko和 Anseth等[124]发展了系列可光降解的水凝胶在生物上的应用(图21)。Anseth等通过邻硝基苄基类光扳机修饰到生物相容的PEG大分子,并通过聚合或其它化学交联的方式制备了能包裹活细胞的可光剪切的水凝胶。通过单光子或双光子过程在水凝胶上实施光剪切刻蚀获得局部降解的三维的通道,有效调控活细胞在水凝胶中的迁移。Kros等[125]通过邻硝基苄基类光扳机修饰葡聚糖,再利用巯基-丙烯酸酯的Michael加成的方法获得可光降解的水凝胶,并有效通过光降解过程控制GFP蛋白的有效释放。Landfester等[126]通过微乳聚合的方式制备了可光降解的交联PMMA微凝胶。
图21 光可降解水凝胶的合成和通过降解调节凝胶性质的过程[124]Photodegradable hydrogel synthesis and degradation for tuning gel properties[124]
(二)通过光剪切调控分子的亲/疏水性,实施组装体的光控智能化。这种方法可以采用光扳机作为连接桥,将一个亲水的高分子链段和另外的疏水高分子连接在一起,获得嵌段的两亲高分子,或者通过一种疏水化光扳机修饰的单体,和亲水单体共聚,或由亲水聚合物引发聚合获得两亲高分子。该类高分子通过疏水作用在水溶液中组装形成不同形貌的高分子胶束。光照之后,光扳机光解致使分子断裂,从而破坏了固有亲疏水平衡致使胶束破坏。Zhao等[127]在这个领域做了系统研究。这种智能的胶束被认为是一种非常有效的光控制释放体系,特别是针对某些难溶的疏水药物,这种体系集合了药物增溶和控制释放的两种功能。
(三)通过光剪切调控分子的亲/疏水(或溶解)性,实施界面或薄膜表面的亲疏水的微调控或图案化。这种可光剪切的两亲高分子特别是嵌段的两亲高分子的胶束具有自模版作用。2009年,Kang和Moon[128]通过邻硝基苄基类光扳机连接亲水的PEG和疏水的聚苯乙烯,制备了主链可光剪切的两嵌段的两亲聚合物。该两亲聚合物的胶束溶液在基材表面能成膜并自组装,通过紫外光照,高分子主链发生光剪切使得亲/疏水嵌段分离,用水和甲醇混合溶液洗去PEG嵌段,获得了表面非常规整的多孔薄膜。另外和传统的光刻蚀原理相同,光剪切也可以改变高分子的溶解性达到表面的刻蚀或图案化的效果。例如Doh和Irvine[129]设计合成了一种邻硝基苄基甲基丙烯酸酯/甲基丙烯酸甲酯/聚乙二醇甲基丙烯酸酯三元共聚物,它光解之后能产生甲基丙烯酸,变得具有水溶性。通过光掩模,利用光解前后的溶解性变化,该聚合物成功在基材表面图案化,进一步通过亲和素/生物素之间的高度结合性,成功将蛋白等生物分子图案化固定在基材表面。光扳机也可以直接通过基材表面的自组装单层膜(self-assembled monolayers,SAMs)的选择性光剪切,实现对基材的局部区域的亲/疏水、表面能或电性的微观调控[130]。
(四)通过在载体或界面上光剪切释放某种活性基团,实现载体内或界面“后修饰”的空间精确可控。这方面的研究在日前引起了相关领域的高度关注。例如巯基基团非常活泼,它能和许多基团在不需要任何催化剂、并在生理条件下快速发生反应,反应条件非常温和。Shiochet等[131]将巯基光扳机化并把它利用聚合固定在水凝胶体系当中,通过双光子在水凝胶内定点释放巯基,并通过生成巯基将某些活性蛋白精确固定在水凝胶内设定的某个部位。事实上,邻-硝基苄类光扳机在光解时候就能释放一个醛基或酮,其中醛基和氨基或联氨有非常好的反应活性,Zhao等[132]在金纳米粒子表面修饰相关的氨基和邻-硝基苄类光扳机,通过控制光照时间,逐步光解释放醛基,并和相邻金纳米粒子表面的氨基反应,获得规整排列的金纳米串珠。
5 总结与展望
如上所述,近年来光扳机分子引起了广泛的研究兴趣,大多的光扳机工作机理已经得到验证,且其结构也随着新应用的要求不断得到拓展。然而光扳机的研究主要还处于单纯的概念性材料构建,生物应用依然停留在细胞实验水平。只有不断拓展光扳机的应用方向、范围和深度才有可能带动光扳机的功能的不断完善和丰富。拓展必须建立在光扳机的“光剪切”、“光释放”和“光激活”三大基本功能上,并凸显其时空可控与便捷操作的特征。一方面随着材料化学、生物与医药领域不断交叉,光扳机分子在生物材料的制备、生物分子和界面修饰及微加工等方面具有广泛的应用前景。另一方面随着光扳机分子修饰技术,例如长波长化或双光子释放能力的进一步提高,或者新的上转换技术介入,使得光控技术有望从细胞层面进入活体。另外,光学技术的不断发展并与生物医药的交叉,例如微创光学介入、微纳(LED)光源体内植入等新技术为光扳机的应用带来了新的方向。可以预见,光扳机分子的开发与发展将是一个多学科交叉与协动的过程。
[1] Brieke C,Rohrbach F,Gottschalk A,Mayer G,Heckel A.Light-controlled tools[J].Angewandte Chemie International Edition,2012,51(34):8446-8476.
[2] Pelliccioli A P,Wirz J.Photoremovable protecting groups:reaction mechanisms and applications[J].Photochemical &Photobiological Sciences,2002,1(7):441-458.
[3] Patchornik A,Amit B,Woodward R B.Photosensitive protecting groups[J].Journal of the American Chemical Society,1970,92(21):63336335.
[4] Walker J W,Reid G P,Mccray J A,Trentham D R.Photolabile 1-(2-nitrophenyl)ethyl phosphate-esters of adeninenucleotide analogs-synthesis and mechanism of photolysis[J].Journal of the American Chemical Society,1988,110(21):7170-7177.
[5] Barth A,Corrie J E T,Gradwell M J,Maeda Y,Mäntele W,Meier T,Trentham D R.Time-resolved infrared spectroscopy of intermediates and products from photolysis of 1-(2-nitrophenyl)ethyl phosphates:reaction of the 2-nitrosoacetophenone byproduct with thiols[J].Journal of the American Chemical Society,1997,119(18):4149-4159.
[6] Holmes C P.Model studies for new o-nitrobenzyl photolabile linkers:substituent effects on the rates of photochemical cleavage[J].The Journal of Organic Chemistry,1997,62(8):2370-2380.
[7] Pease A C,Solas D,Sullivan E J,Cronin M T,Holmes C P,Fodor S P.Light-generated oligonucleotide arrays for rapid DNA sequence analysis[J].Proceedings of the National Academy of Sciences,1994,91(11):5022-5026.
[8] Wieboldt R,Ramesh D,Jabri E,Karplus P A,Carpenter B K,Hess G P.Synthesis and characterization of photolabile o-nitrobenzyl derivatives of urea[J].The Journal of Organic Chemistry,2002,67(25):8827-8831.
[9] Russell A G,Ragoussi M E,Ramalho R,Wharton C W,Carteau D,Bassani D M,Snaith J S.α-Carboxy-6-nitroveratryl:aphotolabile protecting group for carboxylic acids[J].The Journal of Organic Chemistry,2010,75(13):4648-4651.
[10] Schaper K,Mobarekeh S,Abdollah M,Grewer C.Synthesis and photophysical characterization of a new highly hydrophilic caging group[J].European Journal of Organic Chemistry,2002,2002(6):1037-1046.
[11] Pirrung M C,Lee Y R,Park K,Springer J B.Pentadienylnitrobenzyl and pentadienylnitropiperonyl photochemically removable protecting groups[J].The Journal of Organic Chemistry,1999,64(14):5042-5047.
[12] Singh A K,Khade P K.7-Methoxy-3-nitro-2-naphthalenemethanol:a new phototrigger for caging applications[J].Tetrahedron Letters,2011,52(38):4899-4902.
[13] Momotake A,Lindegger N,Niggli E,Barsotti R J,Ellis-Davies G C R.The nitrodibenzofuran chromophore:a new caging group for ultra-efficient photolysis in living cells[J].Nature Methods,2006,3(1):35-40.
[14] Givens R S,Park C H.p-Hydroxyphenacyl ATP1:a new phototrigger[J].Tetrahedron Letters,1996,37(35):6259-6262.
[15] Givens R S,Jung A,Park C H,Weber J,Bartlett W.New photoactivated protecting groups .7.p-Hydroxyphenacyl:aphototrigger for excitatory amino acids and peptides[J].Journal of the American Chemical Society,1997,119(35):8369-8370.
[16] Givens R S,Weber J F W,Conrad P G,Orosz G,Donahue S L,Thayer S A.New phototriggers 9:p-Hydroxyphenacyl as a C-terminal photoremovable protecting group for oligopeptides[J].Journal of the American Chemical Society,2000,122(12):2687-2697.
[17] Zhang K,Corrie J E T,Munasinghe V R N,Wan P.Mechanism of photosolvolytic rearrangement of p-hydroxyphenacyl esters:evidence for excited-state intramolecular proton transfer as the primary photochemical step[J].Journal of the American Chemical Society,1999,121(24):5625-5632.
[18] Conrad P G,Givens R S,Weber J F W,Kandler K.New phototriggers:1extending the p-hydroxyphenacylπ-π*absorption range[J].Organic Letters,2000,2(11):1545-1547.
[19] Barltrop J,Schofield P.Photosensitive protecting groups[J].Tetrahedron Letters,1962,3(16):697-699.
[20] Misetic A,Boyd M K.The pixyl(Px)group:a novel photocleavable protecting group for primary alcohols[J].Tetrahedron Letters,1998,39(13):1653-1656.
[21] Coleman M P,Boyd M K.S-pixyl analogues as photocleavable protecting groups for nucleosides[J].The Journal of Organic Chemistry,2002,67(22):7641-7648.
[22] Furuta T,Torigai H,Osawa T,Iwamura M.New photochemically labile protecting group for phosphates[J].Chemistry Letters,1993,22(7):1179-1182.
[23] Furuta T,Hirayama Y,Iwamura M.Anthraquinon-2-ylmethoxycarbonyl(aqmoc):a new photochemically removable protecting group for alcohols[J].Organic Letters,2001,3(12):1809-1812.
[24] Arumugam S,Popik V V.Photochemical generation and the reactivity of o-naphthoquinone methides in aqueous solutions[J].Journal of the American Chemical Society,2009,131(33):11892-11899.
[25] Arumugam S,Popik V V.Attach,remove,or replace:reversible surface functionalization using thiol-quinone me-thide photoclick chemistry[J].Journal of the American Chemical Society,2012,134(20):8408-8411.
[26] Fedoryak O D,Dore T M.Brominated hydroxyquinoline as aphotolabile protecting group with sensitivity to multiphoton excitation[J].Organic Letters,2002,4(20):3419-3422.
[27] Zhu Y,Pavlos C M,Toscano J P,Dore T M.8-Bromo-7-hydroxyquinoline as a photoremovable protecting group for physiological use:mechanism and scope[J].Journal of the American Chemical Society,2006,128(13):4267-4276.
[28] Davis M J,Kragor C H,Reddie K G,Wilson H C,Zhu Y,Dore T M.Substituent effects on the sensitivity of a quinoline photoremovable protecting group to one-and two-photon excitation[J].The Journal of Organic Chemistry,2009,74(4):1721-1729.
[29] Givens R S,Matuszewski B.Photochemistry of phosphate esters:an efficient method for the generation of electrophiles[J].Journal of the American Chemical Society,1984,106(22):6860-6861.
[30] Schultz C.Molecular tools for cell and systems biology[J].HFSP Journal,2007,1(4):230-248.
[31] Givens R S,Rubina M,Wirz J.Applications of p-hydroxyphenacyl(pHP)and coumarin-4-ylmethyl photoremovable protecting groups[J].Photochemical & Photobiological Sciences,2012,11(3):472-488.
[32] Schmidt R,Geissler D,Hagen V,Bendig J.Mechanism of photocleavage of(coumarin-4-yl)methyl esters[J].The Journal of Physical Chemistry A,2007,111(26):5768-5774.
[33] Schmidt R,Geissler D,Hagen V,Bendig J.Kinetics study of the photocleavage of(coumarin-4-yl)methyl esters[J].The Journal of Physical Chemistry A,2005,109(23):5000-5004.
[34] Senda N,Momotake A,Nishimura Y,Arai T.Synthesis and photochemical properties of a new water-soluble coumarin,designed as a chromophore for highly watersoluble and photolabile protecting group[J].Bulletin of the Chemical Society of Japan,2006,79(11):1753-1757.
[35] Schade B,Hagen V,Schmidt R,Herbrich R,Krause E,Eckardt T,Bendig J.Deactivation behavior and excitedstate properties of(coumarin-4-yl)methyl derivatives.1.Photocleavage of(7-methoxycoumarin-4-yl)methyl-caged acids with fluorescence enhancement[J].The Journal of Organic Chemistry,1999,64(25):9109-9117.
[36] Furuta T,Watanabe T,Tanabe S,Sakyo J,Matsuba C.Phototriggers for nucleobases with improved photochemical properties[J].Organic Letters,2007,9(23):4717-4720.
[37] Kotzur N,Briand B T,Beyermann M,Hagen V.Wavelength-selective photoactivatable protecting groups for thiols[J].Journal of the American Chemical Society,2009,131(46):16927-16931.
[38] Fonseca A S,Gonçalves M S T,Costa S P.Photocleavage studies of fluorescent amino acid conjugates bearing different types of linkages[J].Tetrahedron,2007,63(6):1353-1359.
[39] Suzuki A Z,Watanabe T,Kawamoto M,Nishiyama K,Yamashita H,Ishii M,Iwamura M,Furuta T.Coumarin-4-ylmethoxycarbonyls as phototriggers for alcohols and phenols[J].Organic Letters,2003,5(25):4867-4870.
[40] Hagen V,Kilic F,Schaal J,Dekowski B,Schmidt R,Kotzur N.[8-[Bis(carboxymethyl)aminomethyl]-6-bromo-7-hydroxycoumarin-4-yl]methyl moieties as photoremovable protecting groups for compounds with COOH,NH2,OH,and C=O functions[J].The Journal of Organic Chemistry,2010,75(9):2790-2797.
[41] Subramaniam R,Xiao Y,Li Y,Qian S Y,Sun W,Mallik S.Light-mediated and H-bond facilitated liposomal release:the role of lipid head groups in release efficiency[J].Tetrahedron Letters,2010,51(3):529-532.
[42] Wylie R G,Shoichet M S.Two-photon micropatterning of amines within an agarose hydrogel[J].Journal of Materials Chemistry,2008,18(23):2716-2721.
[43] Klaán P,Šolomek T S,Bochet C G,Blanc A L,Givens R,Rubina M,Popik V,Kostikov A,Wirz J.Photoremovable protecting groups in chemistry and biology:reaction mechanisms and efficacy[J].Chemical Reviews,2013,113(1):119-191.
[44] Eckardt T,Hagen V,Schade B,Schmidt R,Schweitzer C,Bendig J.Deactivation behavior and excited-state properties of (coumarin-4-yl)methyl derivatives.2.Photocleavage of selected (coumarin-4-yl)methyl-caged adenosine cyclic 3',5'-monophosphates with fluorescence enhancement[J].The Journal of Organic Chemistry,2002,67(3):703-710.
[45] Geißler D,Kresse W,Wiesner B,Bendig J,Kettenmann H,Hagen V.DMACM-caged adenosine nucleotides:ultrafast phototriggers for ATP,ADP,and AMP activated by long-wavelength irradiation[J].ChemBioChem,2003,4(2-3):162-170.
[46] Cürten B,Kullmann P H,Bier M E,Kandler K,Schmidt B F.Synthesis,photophysical,photochemical and biological properties of caged GABA,4-[[(2H-1-benzopyran-2-one-7-amino-4-methoxy)carbonyl]amino]butanoic acid[J].Photochemistry and Photobiology,2005,81(3):641-648.
[47] Fernandes M J,Gonçalves M S T,Costa S P.Comparative study of polyaromatic and polyheteroaromatic fluorescent photocleavable protecting groups[J].Tetrahedron,2008,64(13):3032-3038.
[48] Takaoka K,Tatsu Y,Yumoto N,Nakajima T,Shimamoto K.Synthesis of carbamate-type caged derivatives of a novel glutamate transporter blocker[J].Bioorganic& Medicinal Chemistry,2004,12(13):3687-3694.
[49] Hagen V,Frings S,Bendig J,Lorenz D,Wiesner B,Kaupp U B.Fluorescence spectroscopic quantification of the release of cyclic nucleotides from photocleavable [bis(carboxymethoxy)coumarin-4-yl] methyl esters inside cells[J].Angewandte Chemie International Edition,2002,41(19):3625-3628.
[50] Piloto A M,Rovira D,Costa S P,Gonçalves M S T.Oxobenzo[f]benzopyrans as new fluorescent photolabile protecting groups for the carboxylic function[J].Tetrahedron,2006,62(51):11955-11962.
[51] Fernandes M J,Gonçalves M S T,Costa S P.Neurotransmitter amino acid-oxobenzo [f]benzopyran conjugates:synthesis and photorelease studies[J].Tetrahedron,2008,64(49):11175-11179.
[52] Fernandes M J G,Costa S P,Gonçalves M S T.Phototriggering of neuroactive amino acids from 5,6-benzocoumarinyl conjugates[J].Tetrahedron,2011,67(13):2422-2426.
[53] Lin Q,Bao C,Fan G,Cheng S,Liu H,Liu Z and Zhu L.7-Amino coumarin based fluorescent phototriggers coupled with nano/bio-conjugated bonds:synthesis,labeling and photorelease[J].Journal of Material Chemistry,2012,22:6680-6688.
[54] Vogel A,Venugopalan V.Mechanisms of pulsed laser ablation of biological tissues[J].Chemical Reviews,2003,103(2):577-644.
[55] Dougherty T J.Photochemistry in the treatment of cancer[J].Advances in Photochemistry,1992,17:275-311.
[56] Weissleder R,Ntziachristos V.Shedding light onto live molecular targets[J].Nature Medicine,2003,9(1):123-128.
[57] Juzenas P,Juzeniene A,Kaalhus O,Iani V,Moan J.Noninvasive fluorescence excitation spectroscopy during application of 5-aminolevulinic acid in vivo[J].Photochemical & Photobiological Sciences,2002,1(10):745-748.
[58] Furuta T,Wang S S H,Dantzker J L,Dore T M,Bybee W J,Callaway E M,Denk W,Tsien R Y.Brominated 7-hydroxycoumarin-4-ylmethyls: photolabile protecting groups with biologically useful cross-sections for two photon photolysis[J].Proceedings of the National Academy of Sciences,1999,96(4):1193-1200.
[59] Denk W.Two-photon Molecular Excitation in Laser-scanning Microscopy[M].Handbook of Biological Confocal Microscopy.1995.445-458.
[60] LaFratta C N,Fourkas J T,Baldacchini T,Farrer R A.Multiphoton fabrication[J].Angewandte Chemie International Edition,2007,46(33):6238-6258.
[61] Specht A,Thomann J S,Alarcon K,Wittayanan W,Ogden D,Furuta T,Kurakawa Y,Goeldner M.New photoremovable protecting groups for carboxylic acids with high photolytic efficiencies at near-UV irradiation:application to the photocontrolled release of L-glutamate[J].ChemBioChem,2006,7(11):1690-1695.
[62] Gug S,Charon S,Specht A,Alarcon K,Ogden D,Zietz B,Léonard J,Haacke S,Bolze F,Nicoud J F.Photolabile glutamate protecting group with high one-and two-photon uncaging efficiencies[J].ChemBioChem,2008,9(8):1303-1307.
[63] Gug S,Bolze F,Specht A,Bourgogne C,Goeldner M,Nicoud J F.Molecular engineering of photoremovable protecting groups for two-photon uncaging[J].Angewandte Chemie,2008,120(49):9667-9671.
[64] Warther D,Bolze F D R,Leéonard J R M,Gug S,Specht A,Puliti D,Sun X H,Kessler P,Lutz Y,Vonesch J L.Live-cell one-and two-photon uncaging of a farred emitting acridinone fluorophore[J].Journal of the American Chemical Society,2010,132(8):2585-2590.
[65] Lu M,Fedoryak O D,Moister B R,Dore T M.Bhc-diol as aphotolabile protecting group for aldehydes and ketones[J].Organic Letters,2003,5(12):2119-2122.
[66] Bao C,Fan G,Lin Q,Li B,Cheng S,Huang Q,Zhu L.Styryl conjugated coumarin caged alcohol:efficient photorelease by either one-photon long wavelength or two-photon NIR excitation[J].Organic Letters,2011,14(2):572-575.
[67] Gagey N,Neveu P,Benbrahim C,Goetz B,Aujard I,Baudin J B,Jullien L.Two-photon uncaging with fluorescence reporting:evaluation of the o-hydroxycinnamic platform[J].Journal of the American Chemical Society,2007,129(32):9986-9998.
[68] Lin Q,Huang Q,Li C,Bao C,Liu Z,Li F and Zhu L.Anticancer drug release from a mesoporous silica based nanophotocage regulated by either a one-or two-photon process[J].Journal of the American Chemical Society,2010,132:10645-10647.
[69] Zhao Y,Zheng Q,Dakin K,Xu K,Martinez M L,Li W H.New caged coumarin fluorophores with extraordinary uncaging cross sections suitable for biological imaging applications[J].Journal of the American Chemical Society,2004,126(14):4653-4663.
[70] Zheng G,Guo Y M,Li W H.Photoactivatable and water soluble FRET dyes with high uncaging cross section[J].Journal of the American Chemical Society,2007,129(35):10616-10617.
[71] Kobayashi T,Urano Y,Kamiya M,Ueno T,Kojima H,Nagano T.Highly activatable and rapidly releasable caged fluorescein derivatives[J].Journal of the American Chemical Society,2007,129(21):6696-6697.
[72] Mitchison T,Sawin K,Theriot J,Gee K,Mallavarapu A.Caged fluorescent probes[J].Methods in Enzymology,1998,291:63-78.
[73] Ottl J,Gabriel D,Marriott G.Preparation and photoactivation of caged fluorophores and caged proteins using a new class of heterobifunctional,photocleavable cross-linking reagents[J].Bioconjugate Chemistry,1998,9(2):143-151.
[74] Tang X,Dmochowski I J.Phototriggering of caged fluorescent oligodeoxynucleotides[J].Organic Letters,2005,7(2):279-282.
[75] Pellois J-P,Hahn M E,Muir T W.Simultaneous triggering of protein activity and fluorescence[J].Journal of the American Chemical Society,2004,126(23):7170-7171.
[76] Maurel D,Banala S,Laroche T,Johnsson K.Photoactivatable and photoconvertible fluorescent probes for protein labeling[J].ACS Chemical Biology,2010,5(5):507-516.
[77] Dakin K,Zhao Y,Li W-H.LAMP,a new imaging assay of gap junctional communication unveils that Ca2+influx inhibits cell coupling[J].Nature Methods,2004,2(1):55-62.
[78] Guo Y M,Chen S,Shetty P,Zheng G,Lin R,Li W H.Imaging dynamic cell-cell junctional coupling in vivo using trojan-LAMP[J].Nature Methods,2008,5(9):835-841.
[79] Rust M J,Bates M,Zhuang X.Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy(STORM)[J].Nature Methods,2006,3(10):793-796.
[80] Zhang M,Chang H,Zhang Y,Yu J,Wu L,Ji W,Chen J,Liu B,Lu J,Liu Y.Rational design of true monomeric and bright photoactivatable fluorescent proteins[J].Nature Methods,2012,9(7):727-729.
[81] Subach F V,Patterson G H,Manley S,Gillette J M,Lippincott-Schwartz J,Verkhusha V V.Photoactivatable mCherry for high-resolution two-color fluorescence microscopy[J].Nature Methods,2009,6(2):153-159.
[82] Biteen J S,Thompson M A,Tselentis N K,Bowman G R,Shapiro L,Moerner W.Super-resolution imaging in live caulobacter crescentus cells using photoswitchable EYFP[J].Nature Methods,2008,5(11):947-949.
[83] Gurskaya N G, Verkhusha V V,Shcheglov A S,Staroverov D B,Chepurnykh T V,Fradkov A F,Lukyanov S,Lukyanov K A.Engineering of a monomeric green-to-red photoactivatable fluorescent protein induced by blue light[J].Nature Biotechnology,2006,24(4):461-465.
[84] Bates M,Huang B,Dempsey G T,Zhuang X.Multicolor super-resolution imaging with photo-switchable fluorescent probes[J].Science,2007,317(5845):1749-1753.
[85] Bates M,Blosser T R,Zhuang X.Short-range spectroscopic ruler based on a single-molecule optical switch[J].Physical Review Letters,2005,94(10):108101
[86] Fölling J,Belov V,Kunetsky R,Medda R,Schönle A,Egner A,Eggeling C,Bossi M,Hell S E W.Photochromic rhodamines provide nanoscopy with optical sectioning[J].Angewandte Chemie International Edition,2007,46(33):6266-6270.
[87] Kaplan J H,Forbush III B,Hoffman J F.Rapid photolytic release of adenosine 5′-triphosphate from a protected analog:utilization by the sodium:potassium pump of human red blood cell ghosts[J].Biochemistry,1978,17(10):1929-1935.
[88] Strünker T,Weyand I,Bönigk W,Van Q,Loogen A,Brown J E,Kashikar N,Hagen V,Krause E,Kaupp U B.A K+-selective cGMP-gated ion channel controls chemosensation of sperm[J].Nature Cell Biology,2006,8(10):1149-1154.
[89] Ellis-Davies G C R.Neurobiology with caged calcium[J].Chemical Reviews,2008,108(5):1603-1613.
[90] Matsuzaki M,Hayama T,Kasai H,Ellis-Davies G C.Two-photon uncaging ofγ-aminobutyric acid in intact brain tissue[J].Nature Chemical Biology,2010,6(4):255-257.
[91] Kantevari S,Matsuzaki M,Kanemoto Y,Kasai H,Ellis-Davies G C.Two-color,two-photon uncaging of glutamate and GABA[J].Nature Methods,2009,7(2):123-125.
[92] Kantevari S,Buskila Y,Ellis-Davies G C.Synthesis and characterization of cell-permeant 6-nitrodibenzofuranylcaged IP3[J].Photochemical & Photobiological Sciences,2012,11(3):508-513.
[93] Subramanian D,Laketa V,Müller R,Tischer C,Zarbakhsh S,Pepperkok R,Schultz C.Activation of membranepermeant caged PtdIns(3)P induces endosomal fusion in cells[J].Nature Chemical Biology,2010,6(5):324-326.
[94] Mentel M,Laketa V,Subramanian D,Gillandt H,Schultz C.Photoactivatable and cell-membrane-permeable phosphatidylinositol 3,4,5-trisphosphate[J].Angewandte Chemie International Edition,2011,50(16):3811-3814.
[95] Hishikawa K,Nakagawa H,Furuta T,Fukuhara K,Tsumoto H,Suzuki T,Miyata N.Photoinduced nitric oxide release from a hindered nitrobenzene derivative by twophoton excitation[J].Journal of the American Chemical Society,2009,131(22):7488-7489.
[96] Zhao J,Gover T D,Muralidharan S,Auston D A,Weinreich D,Kao J P.Caged vanilloid ligands for activation of TRPV1receptors by 1-and 2-photon excitation[J].Biochemistry,2006,45(15):4915-4926.
[97] Karginov A V,Zou Y,Shirvanyants D,Kota P,Dokholyan N V,Young D D,Hahn K M,Deiters A.Light regulation of protein dimerization and kinase activity in living cells using photocaged rapamycin and engineered FKBP[J].Journal of the American Chemical Society,2011,133(3):420-423.
[98] Cruz F G,Koh J T,Link K H.Light-activated gene expression[J].Journal of the American Chemical Society,2000,122(36):8777-8778.
[99] Kristian H,Shi Y,Koh J T.Light activated recombination[J].Journal of the American Chemical Society,2005,127(38):13088-13089.
[100] Sauers D J,Temburni M K,Biggins J B,Ceo L M,Galileo D S,Koh J T.Light-activated gene expression directs segregation of co-cultured cells in vitro[J].ACS Chemical Biology,2010,5(3):313-320.
[101] Lin W,Albanese C,Pestell R G,Lawrence D S.Spatially discrete,light-driven protein expression[J].Chemistry&Biology,2002,9(12):1347-1353.
[102] Young D D,Deiters A.Photochemical activation of protein expression in bacterial cells[J].Angewandte Chemie International Edition,2007,46(23):4290-4292.
[103] Cambridge S B,Geissler D,Keller S,Cürten B.A cageddoxycycline analogue for photoactivated gene expression[J].Angewandte Chemie International Edition,2006,45(14):2229-2231.
[104] Cambridge S B,Geissler D,Calegari F,Anastassiadis K,Hasan M T,Stewart A F,Huttner W B,Hagen V,Bonhoeffer T.Doxycycline-dependent photoactivated gene expression in eukaryotic systems[J].Nature methods,2009,6(7):527-531.
[105] Agasti S S,Chompoosor A,You C-C,Ghosh P,Kim C K,Rotello V M.Photoregulated release of caged anticancer drugs from gold nanoparticles[J].Journal of the American Chemical Society,2009,131(16):5728-5729.
[106] Angelos S,Yang Y-W,Khashab N M,Stoddart J F,Zink J I.Dual-controlled nanoparticles exhibiting AND logic[J].Journal of the American Chemical Society,2009,131(32):11344-11346.
[107] Lin Q,Bao C,Cheng S,Yang Y,Ji W and Zhu L.Target-activated coumarin phototriggers specifically switch on fluorescence and photocleavage upon bonding to thiolbearing protein[J].Journal of the American Chemical Society,2012,134:5052-5055.
[108] Lin Q,Bao C,Yang Y,Liang Q,Zhang D,Cheng S and Zhu L.Highly discriminating photorelease of anticancer drugs based on hypoxia activatable phototrigger conjugated chitosan nanoparticles[J].Advanced Materials,2013,25:1981-1986.
[109] Dai Z,Dulyaninova N G,Kumar S,Bresnick A R,Lawrence D S.Visual snapshots of intracellular kinase activity at the onset of mitosis[J].Chemistry & Biology,2007,14(11):1254-1260.
[110] Lee H-M,Xu W,Lawrence D S.Construction of a photoactivatable profluorescent enzyme via propinquity labeling[J].Journal of the American Chemical Society,2011,133(8):2331.
[111] Muraoka T,Koh C-Y,Cui H,Stupp S I.Light-triggered bioactivity in three dimensions[J].Angewandte Chemie International Edition,2009,48(32):5946-5949.
[112] Parker L L,Kurutz J W,Kent S B H,Kron S J.Control of the yeast cell cycle with a photocleavableα-factor analogue[J].Angewandte Chemie International Edition,2006,45(38):6322-6325.
[113] Chang C-Y,Fernandez T,Panchal R,Bayley H.Caged catalytic subunit of cAMP-dependent protein kinase[J].Journal of the American Chemical Society,1998,120(30):7661-7662.
[114] Pellois J-P,Muir T W.A ligation and photorelease strategy for the temporal and spatial control of protein function in living cells[J].Angewandte Chemie International Edition,2005,44(35):5713-5717.
[115] Deiters A,Groff D,Ryu Y,Xie J,Schultz P G.A genetically encoded photocaged tyrosine[J].Angewandte Chemie,2006,118(17):2794-2797.
[116] Wu N,Deiters A,Cropp T A,King D,Schultz P G.A genetically encoded photocaged amino acid[J].Journal of the American Chemical Society,2004,126(44):14306-14307.
[117] Lemke E A,Summerer D,Geierstanger B H,Brittain S M,Schultz P G.Control of protein phosphorylation with agenetically encoded photocaged amino acid[J].Nature Chemical Biology,2007,3(12):769-772.
[118] Chen P R,Groff D,Guo J,Ou W,Cellitti S,Geierstanger B H,Schultz P G.A facile system for encoding unnatural amino acids in mammalian cells[J].Angewandte Chemie International Edition,2009,48(22):4052-4055.
[119] Young D D,Lusic H,Lively M O,Yoder J A,Deiters A.Gene silencing in mammalian cells with light-activated antisense agents[J].ChemBioChem,2008,9(18):2937-2940.
[120] Shestopalov I A,Sinha S,Chen J K.Light-controlled gene silencing in zebrafish embryos[J].Nature Chemical Biology,2007,3(10):650-651.
[121] Tang X,Maegawa S,Weinberg E S,Dmochowski I J.Regulating gene expression in zebrafish embryos using light-activated,negatively charged peptide nucleic acids[J].Journal of the American Chemical Society,2007,129(36):11000-11001.
[122] Heckel A,Mayer G.Light regulation of aptamer activity:an anti-thrombin aptamer with caged thymidine nucleobases[J].Journal of the American Chemical Society,2005,127(3):822-823.
[123] Johnson J A,Finn M,Koberstein J T,Turro N J.Synthesis of photocleavable linear macromonomers by ATRP and star macromonomers by a tandem ATRP-click reaction:precursors to photodegradable model networks[J].Macromolecules,2007,40(10):3589-3598.
[124] Kloxin A M,Kasko A M,Salinas C N,Anseth K S.Photodegradable hydrogels for dynamic tuning of physical and chemical properties[J].Science,2009,324(5923):59-63.
[125] Peng K,Tomatsu I,van den Broek B,Cui C,Korobko A V,van Noort J,Meijer A H,Spaink H P,Kros A.Dextran based photodegradable hydrogels formed via a Michael addition[J].Soft Matter,2011,7(10):4881-4887.
[126] Klinger D,Landfester K.Photo-sensitive PMMA microgels:light-triggered swelling and degradation[J].Soft Matter,2010,7(4):1426-1440.
[127] Zhao Y.Photocontrollable block copolymer micelles:what can we control[J].Journal of Materials Chemistry,2009,19(28):4887-4895.
[128] Kang M,Moon B.Synthesis of photocleavable poly(styrene-block-ethylene oxide)and its self-assembly into nanoporous thin films[J].Macromolecules,2008,42(1):455-458.
[129] Doh J,Irvine D J.Photogenerated polyelectrolyte bilayers from an aqueous-processible photoresist for multicomponent protein patterning[J].Journal of the American Chemical Society,2004,126(30):9170-9171.
[130] Zhao B,Moore J S,Beebe D J.Surface-directed liquid flow inside microchannels[J].Science,2001,291(5506):1023-1026.
[131] Wylie R G,Ahsan S,Aizawa Y,Maxwell K L,Morshead C M,Shoichet M S.Spatially controlled simultaneous patterning of multiple growth factors in three-dimen-sional hydrogels[J].Nature Materials,2011,10(10):799-806.
[132] Lai J,Xu Y,Mu X,Wu X,Li C,Zheng J,Wu C,Chen J,Zhao Y.Light-triggered covalent assembly of gold nanoparticles in aqueous solution[J].Chemical Communications,2011,47(13):3822-3824.
