c-Jun氨基末端激酶活化在三丁基锡诱导凋亡中的作用及机制*
2014-02-22张亚莉孙利军
张亚莉,孙利军
(南通大学1医学院生物化学与分子生物学教研室;2公共卫生学院,江苏226001)
c-Jun氨基末端激酶活化在三丁基锡诱导凋亡中的作用及机制*
张亚莉1**,孙利军2
(南通大学1医学院生物化学与分子生物学教研室;2公共卫生学院,江苏226001)
目的:研究c-jun氨基末端激酶(JNK)参与三丁基锡(Tributyltin,TBT)诱导正常人羊膜细胞FL凋亡的分子机制。方法:FL细胞经不同浓度TBT染毒1h后,PI/Annexin V双染色法检测FL细胞凋亡率。Western blot检测FL细胞JNK的磷酸化水平,Bax定位、Bcl-2的磷酸化水平及总Bax和Bcl-2表达水平。结果:与对照组相比,4μmol/L和6 μmol/L的TBT染毒剂量组细胞凋亡率明显升高,2μmol/L~6μmol/L剂量组JNK磷酸化水平升高,差异有统计学意义(P<0.01)。JNK特异抑制剂SP600125明显降低TBT诱导的FL细胞凋亡率,而JNK特异抑制剂SP600125对Bax定位、Bcl-2的磷酸化水平及总的Bax和Bcl-2表达量无影响。结论:JNK的活化是TBT诱导FL细胞凋亡的重要因素,但JNK介导凋亡的途径并非通过调控凋亡相关因子Bax和Bcl-2。
三丁基锡;凋亡;c-jun氨基末端激酶;Bax;Bcl-2;流式细胞技术;Western blot检测
1 材料和方法
1.1 材料 电泳及转膜装置(BIO-RAD公司,美国),Microfuge.R低温高速离心机(Beckman公司,美国),Thermomixer舒适型恒温混匀器(Eppendorf公司,德国),Kadok凝胶图象分析系统(Life Technologies公司,美国),流式细胞分析仪(Beckman公司,美国)。TBT(无色液体,纯度90%,Acros公司,美国);phospho-JNK(Thr183/Tyr185),JNK,Bax,phospho-Bcl-2(Ser70),Bcl-2(Cell Signaling Technology公司,美国);PI/Annexin V双染凋亡检测试剂盒(联科生物公司,中国)
1.2 方法 (1)细胞培养及处理:FL细胞培养于含10%新生牛血清的MEM培养基中,在37℃及5% CO2的培养箱中贴壁培养,隔天传代1次。实验用细胞均处于对数生长期。TBT溶于无水乙醇,至浓度为5mmol/L,储存于4℃。细胞生长24小时后,向培养体系中加入TBT至终浓度0,1,2,3,4和6 μmol/L,作用时间1h后进行各指标的测定。(2)PI/Annexin V双染色法检测FL细胞凋亡率:离心收集细胞,预冷PBS漂洗。然后用500μL结合缓冲液重悬细胞,加入5μL Annexin V-FITC和10μL PI,室温避光温育5 min。流式细胞仪对样品进行检测。(3)FL细胞全蛋白的提取:离心收集细胞,预冷PBS漂洗,细胞重悬于裂解液中,50 mmol/L Tris-Cl,150 mmol/L NaCl,10 mmol/L EDTA,0.5%Triton X-100,1 mmol/L PMSF,1 mmol/L NaF,1 mmol/L Na3VO4,pH 7.6。冰上静置30 min,20 000 g,30 min,4℃离心,收集上清。采用Bradford法测定蛋白浓度。(4)FL细胞线粒体/胞浆蛋白提取:离心收集细胞,预冷PBS漂洗,细胞重悬于裂解液中,250 mmol/L sucrose,20 mmol/L HEPES,10 mmol/L KCl,1.5 mmol/L MgCl2·6H2O,1 mmol/L EDTA,1mmol/L EGTA,1 mmol/L DTT,1mmol/L PMSF。冰上静置40 min,1mL注射器吹打约50次,800g,10 min,4℃离心后取上清,20 000 g,30 min,4℃离心,收集上清液即为胞浆蛋白;沉淀加裂解液吹打重悬此为线粒体蛋白,Bradford法测蛋白浓度。(5)Western blot检测FL细胞JNK、Bax和Bcl-2表达:将提取的蛋白与4×上样缓冲液以1∶1体积比混合,沸水浴5 min使蛋白变性。蛋白上样于浓度为5%积层胶和12%的分离胶,积层胶电压50 V,分离胶电压90 V,进行电泳;之后于恒压100 V转膜90 min。将转有蛋白的硝酸纤维素膜浸于含5%脱脂牛奶的TBS-T(0.1%的Tween-20)中,在室温下振荡3 h阻断非特异性结合。取出已封闭的硝酸纤维素膜,浸于按抗体说明书推荐比例稀释后的一抗稀释液中,4℃温和振荡过夜,TBST漂洗10min×3次。再浸于按抗体说明书要求稀释的二抗中室温温和振荡2 h,再次TBST漂洗10min×3次。在暗室中将NC膜置于ECL液中1~2min,吸去多余的ECL液后用保鲜膜包好,放入暗盒内。用X线胶片进行曝光、显影及定影,待胶片晾干后在成像仪中拍照。使用Quantity ONE软件对目的蛋白进行积分吸光度(integrated absorbance,IA)光密度分析。目的蛋白相对表达水平=IA目的蛋白/IAGAPDH。目的蛋白磷酸化水平=IA磷酸化蛋白/IA总蛋白,实验重复3次。
1.3 统计学处理 采用SPSS 17.0软件进行统计学分析。计量数据以±s进行表示。多组间比较采用方差齐性检验和单因素方差分析。组间两两比较时,若方差齐时,采用SNK检验;若方差不齐时,采用Games-Howell检验。率的比较采用χ2检验。以P< 0.05为差异有统计学意义。
2 结 果
2.1 TBT对FL细胞凋亡率和JNK磷酸化水平的影响 与对照组相比,4μmol/L和6μmol/LTBT染毒组FL细胞凋亡率增高,差异具有统计学意义(P<0.01)(表1)。与对照组相比,JNK磷酸化水平从2μmol/L剂量组开始升高,差异具有统计学意义(P<0.01);且随着TBT染毒剂量的增加,JNK的磷酸化水平呈上升趋势(表1,图1)。
表1 TBT对FL细胞凋亡率及JNK磷酸化水平的影响(n=3,±s)
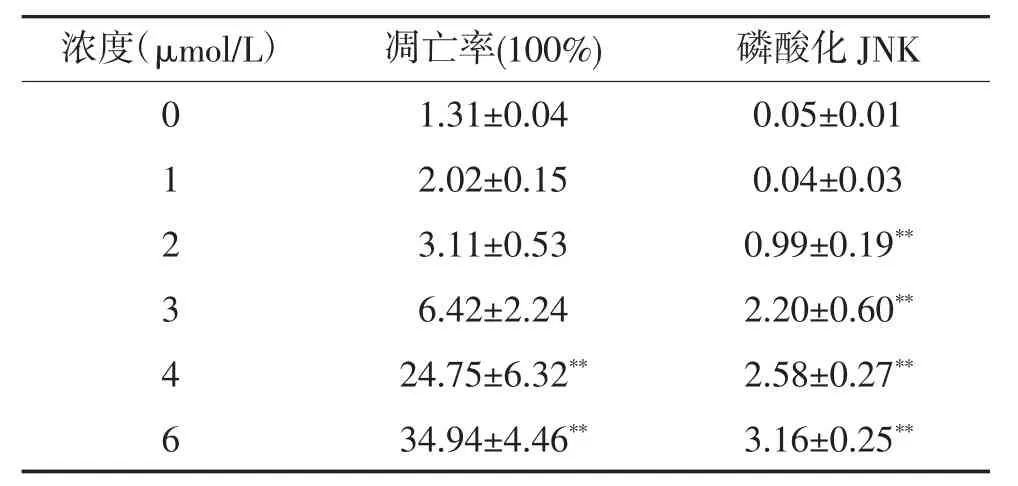
表1 TBT对FL细胞凋亡率及JNK磷酸化水平的影响(n=3,±s)
与对照组(0 μmol/L)比较,**P<001
?
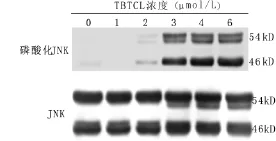
图1 TBT对FL细胞JNK磷酸化水平的影响
2.2 JNK抑制剂SP600125对FL细胞凋亡率的影响 SP600125预处理细胞后,通过比较单染TBT组和TBT及抑制剂复染组凋亡率的差别,确定JNK的活化是否参与TBT诱导FL细胞凋亡。结果如图2和表2所示,与4μmol/L和6μmol/L TBT单染组比较,SP600125和TBT复染组细胞凋亡率明显降低,差异具有统计学意义(P<0.05,P<001)。

图2 JNK抑制剂SP600125(SP)对TBT诱导凋亡率影响的流式散点图
表2 JNK抑制剂SP600125对FL细胞凋亡率的影响(n=3,±s)

表2 JNK抑制剂SP600125对FL细胞凋亡率的影响(n=3,±s)
组别 凋亡率(100%) 0μmol/L 0.87±0.05 20μmol/L SP600125 0.66±0.22 4μmol/L TBT 24.30±3.79 4μmol/L TBT+20μmol/L SP600125 13.70±4.39**6μmol/L TBT 31.47±3.47 6μmol/L TBT+20μmol/L SP600125 24.08±3.43*
2.3 JNK抑制剂SP600125对FL细胞Bax和Bcl-2的影响 结果如图3所示,加入SP600125预染FL细胞后,Bax定位、Bcl-2的磷酸化水平及总的Bax和Bcl-2表达量在4μmol/L或6μmol/L TBT单染组较加入抑制剂复染组间无差别。

图3 JNK抑制剂SP600125(SP)对Bax定位、Bcl-2的磷酸化水平以及总的Bax和Bcl-2表达量影响
3 讨 论
本研究结果表明,TBT在诱导FL细胞调亡时,在相同的剂量组均发现JNK磷酸化水平升高,即被活化,提示JNK的活化可能参与TBT诱导的凋亡。为了更进一步确定JNK的活化参与TBT诱导的凋亡,本实验在TBT染毒前先加入JNK的特异性抑制剂SP600125预处理FL细胞。通过比较单染TBT组和TBT及抑制剂复染组凋亡率的差别,确定JNK的活化是否参与细胞凋亡。结果显示,SP600125(JNK特异抑制剂)预处理细胞后,TBT和SP600125复染组细胞凋亡率明显较4,6μmol/L TBT单染组降低,证实JNK的活化参与TBT诱导的FL细胞凋亡。
Bax和Bcl-2是调控线粒体凋亡途径中最为关键的蛋白。Bax从胞质向线粒体的转位致使线粒体渗透转移孔(permeability transition pore,PTP)开放,诱发线粒体跨膜电位(mitochontrial membrane potential,ΔΨm)下降和细胞色素C释放,最终激活casapse-3,诱导细胞凋亡。抗凋亡类蛋白Bc1-2则可通过与Bax竞争或者直接阻止Bax与PT孔组成蛋白结合,发挥其抗凋亡效应。Bcl-2的稳定性受其本身ser70位点磷酸化的调控,Bcl-2在ser70磷酸化后被降解。减少和Bax异二聚体的形成,利于更多的Bax之间形成同二聚体,开放PTP促进凋亡发生。因此Bax的定位、Bcl-2的磷酸化水平及它们表达量均是调控线粒体凋亡的重要因素。JNK诱导细胞凋亡的分子机制十分复杂,有研究表明JNK可通过调控
Bax和Bcl-2促进线粒体凋亡途径[11]。也有研究显示活化的JNK可转位至线粒体,引起细胞色素c释放,导致线粒体凋亡[12-13]。本研究在确定JNK的活化参与TBT诱导FL细胞凋亡后,通过比较单染TBT组和SP600125及TBT复染组对Bax定位、Bcl-2的磷酸化水平(ser70)以及总的Bax和Bcl-2表达量,探讨JNK引起凋亡的分子机制。结果表明JNK参与细胞凋亡的分子机制,并不是通过调控Bax和Bcl-2蛋白的改变。因此在本实验条件下,JNK参与TBT诱导FL细胞凋亡可能和其转位至线粒体,改变线粒体膜通透性,促进细胞色素c释放有关,具体机制有待进一步研究。
综上所述,JNK的活化是TBT诱导FL细胞凋亡的重要因素,但JNK介导凋亡的途径并非通过调控凋亡相关因子Bax和Bcl-2。
[1]Graceli JB,Sena GC,Lopes PF,et al.Organotins:a review of their reproductive toxicity,biochemistry,and environmental fate[J].Reprod Toxicol,2013,36:40-52.
[2]Tian F,Sui MH,Zhang KJ,et al.Tributyltin pollution in China's water environment and its threat to drinking water safety[J].Modern Chemical Industry,2010,30:7-11.
[3]Kotake Y.Molecular mechanisms of environmental organotin toxicity in mammals[J].Biol Pharm Bull,2012,35(11): 1876-1880.
[4]Gupta M,Dwivedi UN,Khandelwal S.C-Phycocyanin:an effective protective agent against thymic atrophy by tributyltin[J].Toxicol Lett,2011,204(1):2-11.
[5]Bissonnette SL,Haas A,Mann KK,et al.The role of CaMKII in calcium-activated death pathways in bone marrow B cells[J].Toxicol Sci,2010,118(1):108-118.
[6]Nakatsu Y,Kotake Y,Ohta S.Concentration dependence of the mechanisms of tributyltin-induced apoptosis[J].Toxicol Sci,2007,97(2):438-447.
[7]Kim SK,Kim JH,Han JH,et al.Inhibitory effect of tributyltin on expression of steroidogenic enzymes in mouse testis[J].Int J Toxicol,2008,27(2):175-182.
[8]Grondin M,Marion M,Denizeau F,et al.Tributyltin induces apoptotic signaling in hepatocytes through pathways involving the endoplasmic reticulum and mitochondria[J].Toxicol Appl Pharmacol,2007,222(1):57-68.
[9]Dhanasekaran DN,Reddy EP.JNK signaling in apoptosis[J].Oncogene,2008,27(48):6245-6251.
[10]朱欣,应李强,徐进,等.三丁基锡对正常人胚胎羊膜细胞凋亡的诱导作用[J].环境科学学报,2005,25(9):1250-1252.
[11]Li G,Wang M,Hao L,et al.Angiotensin II induces mitochondrial dysfunction and promotes apoptosis via JNK signalling pathway in primary mouse calvaria osteoblast[J]. Arch Oral Biol,2014,59(5):513-523.
[12]Chauhan D,Li G,Hideshima T,et al.JNK-dependent release of mitochondrial protein,Smac,during apoptosis in multiple myeloma(MM)cells[J].J Biol Chem,2003,278 (20):17593-17596.
[13]Tournier C,Hess P,Yang DD,et al.Requirement of JNK for stress-induced activation of the cytochrome c-mediated death pathway[J].Science,2000,288(5467):870-874.
The effect of JNK activation on TBT-induced apoptosis and its possible mechanism
ZHANG Yali1,SUN LiJun2
(1Department of Biochemistry and Molecular Biology,School of Medicine,Nantong University,Jiangsu 226001;2School of Public Health,Nantong University)
Objective:To study the effects of JNK activation on TBT-induced apoptosis and investigate the underlying mechanism in human amnionic cells.Methods:In the study,PI/Annexin V staining assay was applied to detect apoptosis induced by TBT in FL cells.The phosphorylation of JNK,expression and localization of Bax,and the expression and phosphorylation of the Bcl-2,respectively,were measured by Western blot.Results:Compared with the control group,the proportion of apoptotic FL cells were increased in the 4 and 6 μmol/L TBT-treated groups,and the phosphorylation of JNK was markedly increased in the 2,3,4 and 6 μmol/L TBT-treated groups(P<0.01).JNK-specific inhibitor attenuated the TBT-mediated elevation of apoptotic rates.However,JNK-specific inhibitor had no effect on the expression and localization of Bax,as well as the expression and phosphorylation of the Bcl-2.Conclusion:JNK activation in apoptotic human amnion cells is not involved in the upstream signaling of the Bax/Bcl-2-evoked mitochondrial apoptosis pathway.
tributyltin;apoptosis;c-Jun N-terminal kinases;Bax;Bcl-2;flow cytomertry(FCM);Western blot
Q555+.7
A
江苏省自然科学青年基金(BK20130397;BK20130389);南通大学博士引进人才启动基金(13R26)。
2014-05-31
1006-2440(2014)04-0327-04
**[作者简介]张亚莉,女,汉族,江苏南通人,生于1978年3月,讲师,博士,研究方向:生化毒理学。 通信作者:孙利军,E-mail:slj. 1226@163.com
三丁基锡(Tributyltin,TBT)是具有极强毒性的环境污染物。其主要的用途是作为杀虫剂添加到涂料中涂于船体及海洋建筑的表面,以防止软体海洋生物的附着。TBT具有高度的脂溶性和低的生物降解性,极易在水生生物体内富集,并经食物链传递给高营养等级动物,进而可能影响到人类健康[1-3]。已有大量报道显示TBT能引起哺乳类动物免疫、神经、生殖以及肝毒性,而凋亡诱导一直被认为是TBT产生毒性最主要的机制[4-8]。丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)属于细胞内一类较为保守的丝氨酸/苏氨酸蛋白激酶,其家族成员c-Jun氨基末端激酶(c-Jun N-terminal kinases,JNK)通过和凋亡关键分子相互作用参与凋亡的调控[9]。本实验室前期研究发现TBT能够诱导FL细胞凋亡[10]。在此基础上,本研究进一步探讨JNK活化在TBT诱导细胞凋亡中的作用及其分子机制。
