PI3K/Akt信号传导通路蛋白在晚期非小细胞肺癌中的表达及临床意义
2014-02-22高小燕江爱桂卢慧宇
高小燕,江爱桂,卢慧宇
(泰州市人民医院呼吸内科,江苏225300)
PI3K/Akt信号传导通路蛋白在晚期非小细胞肺癌中的表达及临床意义
高小燕*,江爱桂,卢慧宇
(泰州市人民医院呼吸内科,江苏225300)
目的:探讨磷脂酰肌醇3-激酶(phosphatidyl inositol 3-kinase,PI3K),磷酸化蛋白激酶B(phosphorylated Akt B,p-AKT)在晚期非小细胞肺癌(non-small-cell lung carcinoma,NSCLC)组织中的表达及其与预后的关系。方法:回顾性分析87例晚期NSCLC患者的临床资料,其中鳞癌组37例,腺癌组50例,并收集16例肺癌癌旁正常肺组织标本作为对照组。应用免疫组织化学方法检测PI3K和p-AKT蛋白在癌组织和正常组织中的表达,分析其与患者临床资料变量的关系及其对预后的影响。结果:PI3K和p-AKT在晚期NSCLC中的表达明显高于正常肺组织 (P= 0.001,0.005)。p-AKT表达与肿瘤的TNM分期呈正相关(P=0.016),而与肿瘤的性别、年龄、病理类型、分化程度、体力状态(PS)评分无关。PI3K表达与上述临床特征无关。PI3K阴性表达组的中位数生存时间明显优于阳性表达组[17.699月(95%CI 15.114-20.283)/13.426月(95%CI 11.832-15.021),P=0.004],p-AKT阴性表达组的中位数生存时间明显亦优于阳性表达组[17.134月(95%CI 14.927-19.341)/13.067月(95%CI 11.316-14.817),P=0.007]。多变量Cox回归分析显示PI3K(HR=2.128,P=0.009),p-AKT(HR=0.501,P=0.045),TNM分期(HR=4.808,P<0.001),PS评分(HR=3.277,P< 0.001)是晚期NSCLC的独立预后因素。结论:PI3K、p-AKT与晚期NSCLC不良预后因素密切相关,PI3K、p-AKT是晚期NSCLC预后的独立不利因素。
非小细胞肺癌;磷脂酰肌醇3-激酶;磷酸化蛋白激酶B;预后;生存率
近年来抗肿瘤治疗,如化学治疗,放射治疗及生物靶向治疗取得显著的进展,但晚期非小细胞肺癌(nonsmall-cell lung cancer,NSCLC)由于丧失手术机会,死亡率仍较高[1]。由于缺乏单一绝对的晚期NSCLC预后的生物标志物,故肺癌预后新的标志物及其靶点干预治疗的研究目前仍倍受关注。磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)信号转导通路(PI3K/Akt/mTOR信号通路)参与细胞增殖和凋亡等多种功能的调节,是细胞生长的调控网络[2]。细胞内的PI3K可促进Akt的激活,Akt又直接或间接地激活mTOR,从而调控细胞生长增殖和细胞周期,在肿瘤发生、发展的信号传导事件中发挥重要作用。PI3K/Akt/mTOR信号传导通路的活化在脑胶质瘤、脑垂体瘤、乳腺癌、胰腺癌、骨肉瘤等多种肿瘤中均有报道[3-5],其过度表达与不良预后密切相关。
本文回顾性分析我院2008年6月—2011年6月87例晚期非小细胞肺癌患者的临床资料,并收集16例肺癌癌旁正常肺组织标本作为对照组,检测PI3K与p-AKT在晚期非小细胞肺癌组织和正常组织中的表达,并分析其与患者临床资料变量的关系及其对预后的影响,现报告如下。
1 材料与方法
1.1 一般资料 不能手术的晚期NSCLC患者87例,男61例,女26例,平均年龄58.6±9.8岁。鳞癌37例,腺癌50例。根据TNM系统分期,Ⅲb期49例,Ⅳ期38例。所有病例均经CT引导下经皮肺穿刺或支气管镜下粘膜活检病理证实。入选标准:患者体力状况评分0~2分,无严重的心肾功能不全,且在我院连续两次或两次以上采用含铂类制剂的化疗方案并接受总剂量56~60Gy放疗的患者,Ⅳ期入选患者排除脑部转移。并以16例手术切除的肺癌癌旁正常肺组织为对照组。实验经本院伦理委员会认可。
1.2 方法 鼠抗人PI3K单克隆抗体、鼠抗人p-AKT单克隆抗体、免疫组织化学染色试剂盒(上海生工生物技术有限公司)。IgG/HRP第二抗体(武汉博士德生物工程有限公司),EnVison第二抗体反应液(上海基因公司)。免疫组化(EnVision)检测PI3K蛋白、p-AKT蛋白表达:采用Envision法,抗PI3K蛋白、p-AKT蛋白为一抗,工作浓度1:1 000,用自身对照作阳性对照,用PBS代替一抗作阴性对照。免疫组化结果判定[6]:由两位病理医生采用双盲法观察判断。PI3K与p-AKT蛋白阳性为胞浆或细胞膜呈现棕黄色颗粒,细胞核少见染色。每张切片均在400倍显微镜下观察2个视野,每个视野100个细胞,根据染色阳性肿瘤细胞数目所占百分比计分,阴性计0分,<10%计1分,10%~49%计2分,50%~79%计3分,≥80%计4分;染色强度按肿瘤细胞着色深浅计分:无着色为0分,黄色为弱阳性计1分,浅棕色为中等阳性计2分,棕褐色为强阳性计3分;总分为两项评分之积(0~12分),总分≥4分为阳性表达。所有标本通过HE染色确定病理类型及分化程度,根据病理类型分为鳞癌组及腺癌组;根据分化程度分为低-中分化组和高分化组。用免疫组化法检测各组PI3K与p-AKT蛋白表达水平,对PI3K与p-AKT蛋白表达与性别、年龄、分化程度、TNM分期、体力状态(PS)评分的相关性进行研究分析。所有患者以病例跟踪,电话随访为主。生存时间为病理确诊到患者死亡或最后一次随访,以月为计算单位,终点事件为死亡。至最后随访时80例死亡,7例失访或死于其他原因。
1.3 统计学处理 所有数据均采用SPSS 13.0软件进行分析。PI3K与p-AKT表达与临床资料的相关性采用卡方检验或Fisher精确概率法统计。PI3K与p-AKT表达与晚期NSCLC预后的关系采用Kaplan-Meier法进行生存分析,Log-rank检验比较生存期的差异,多因素COX比例风险模型进行预后影响因素分析。P<0.05为差异有统计学意义。
2 结 果
2.1 PI3K与p-AKT在癌旁正常肺组织中的表达PI3K在对照组癌旁肺组织未见或少见表达,其表达的部位主要位于支气管粘膜,肺泡壁均未见阳性表达。对照组PI3K阳性表达率为18.7%。p-AKT表达部分同PI3K,其阳性表达率为12.5%。如图1。
图1 PI3K与p-AKT在癌旁正常肺组织中的阴性表达(400×)
2.2 PI3K与p-AKT在晚期NSCLC组织中的表达免疫组化结果提示,PI3K与p-AKT表达均位于肺肿瘤细胞的细胞浆和细胞膜,为粗细不一的棕黄色颗粒,细胞核不染色;87例肺癌组织中PI3K及p-AKT阳性表达率分别为58.6%,45.9%,明显高于对照组(χ2=12.2666,P=0.001;χ2=8.3239,P=0.005)。如图2,3。

图2 PI3K与p-AKT在鳞癌组织中的表达(400×)

图3 PI3K与p-AKT在腺癌组织中的表达(400×)
2.3 PI3K、p-AKT与晚期NSCLC临床病理特征的关系 p-AKT表达与肿瘤的TNM分期呈正相关(χ2=5.7501,P=0.016),而与肿瘤的性别、年龄、病理类型、分化程度、体力状态(PS)评分无关。PI3K表达与上述临床特征无关。见表1。

表1 PI3K、p-AKT与晚期NSCLC临床病理特征的关系
2.4 PI3K与p-AKT表达与晚期非小细胞肺癌预后的关系 87例患者总的中位数生存时间15.33月(95%CI 13.806-16.854),,PI3K阴性表达组中位数生存时间17.699月(95%CI 15.114-20.283),优于PI3K阳性表达组13.426月(95%CI 11.832-15.021),两组比较差异有统计学意义(P=0.004);p-AKT阴性表达组中位数生存时间17.134月 (95%CI 14.927-19.341),优于p-AKT阳性表达组13.067月(95%CI 11.316-14.817),两组比较差异有统计学意义(P= 0.007)。如图4,5。
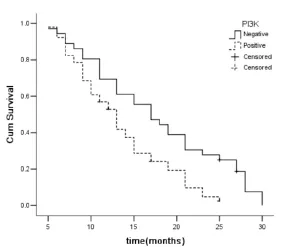
图4 晚期非小细胞肺癌PI3K(+)组与PI3K(-)组总生存曲线(Log Rank法)

图5 晚期非小细胞肺癌p-AKT(+)组与p-AKT(-)组总生存曲线(Log Rank法)
2.5 晚期非小细胞肺癌预后的单因素及多因素分析结果 单因素生存分析结果显示,PI3K (HR= 1.948,P=0.007),p-AKT (HR=1.818,P=0.012),TNM分期 (HR=3.612,P<0.001),ECOG PS评分 (HR= 2.720,P<0.001)是晚期NSCLC预后不利因素。COX比例风险模型多因素生存分析结果显示,PI3K(HR= 2.128,P=0.009),p-AKT(HR=0.501,P=0.045),TNM分期 (HR=4.808,P<0.001),PS评分 (HR=3.277,P< 0.001)是晚期NSCLC的独立预后因素。见表2。
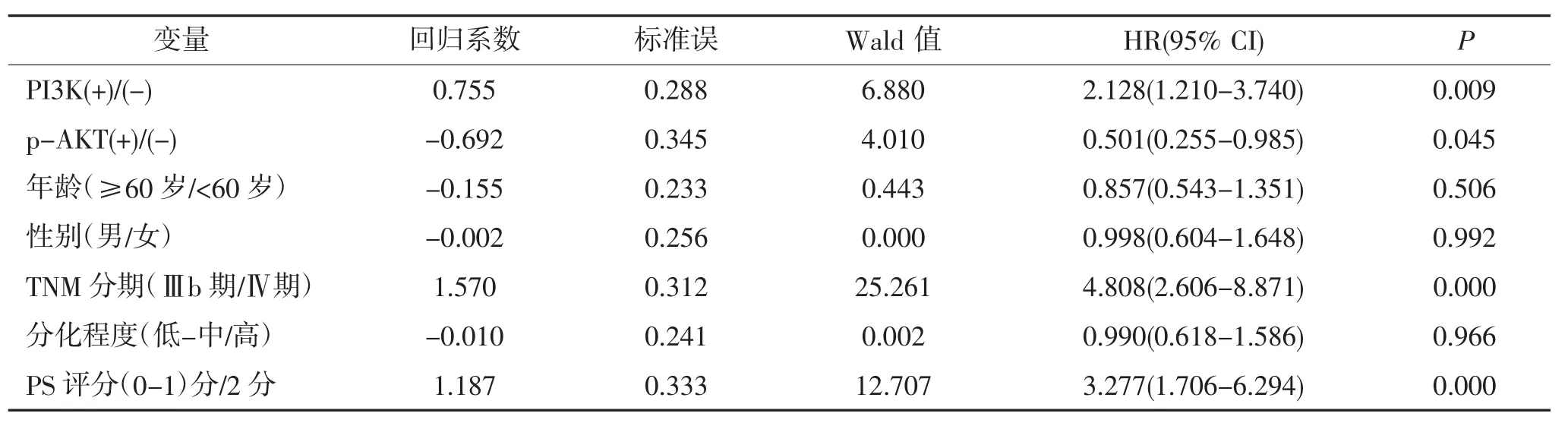
表2 晚期非小细胞肺癌预后的多因素分析结果
3 讨 论
磷脂酰肌醇3-激酶/蛋白激酶B(PI3K/Akt)信号转导通路作为细胞生存重要通路之一,在促进细胞生长、增殖,促进细胞运动、侵袭,抑制细胞凋亡,促进血管生成,抵抗化疗和放疗等方面起重要作用[7]。PI3K激活后的产物与Akt的PH区结合,不仅导致Akt发生从细胞质到细胞膜的转位,还可促使其构象发生改变,从而成为Akt激活的必要条件,活化的PI3K/Akt信号通路通过Bcl-2家族、Forkhead转录因子、细胞凋亡抑制蛋白[8]和抑制天冬氨酸特异性半胱氨酸蛋白酶家族成员的活化抑制细胞凋亡,亦可通过抑制肿瘤细胞膜上的TRAIL受体活性从而抑制凋亡受体家族介导的细胞凋亡。通过激活PI3K/ Akt/mTOR途径、GSK-3、P21cipl、CREB和TSC2等促进细胞增殖。通过激活Akt/mTOR/p70S6K途径促进细胞的运动、侵袭、转移[9]。
PI3K/Akt/mTOR信号传导通路的活化在脑胶质瘤、脑垂体瘤、乳腺癌、胰腺癌、骨肉瘤等多种肿瘤中均有报道[3-5],其过度表达与不良预后密切相关。PI3K/Akt/mTOR信号传导通路在早中期非小细胞肺癌组织有亦有表达[5,10-14],但其在能够手术的非小细胞肺癌中的临床意义目前仍存在争议[5,10,14]。研究发现,PI3K及p-Akt在原发的NSCLC组织中高度表达,亦见于恶变前和恶变的人类支气管上皮细胞,而在正常细胞中基本不表达,研究结果提示该通路的活化在从癌前病变向恶性肿瘤的转变中起着重要作用[13]。
Balsara BR等[15]研究发现,PI3K/Akt信号传导通路下游靶点mTOR在NSCLC组织中表达明显高
于正常肺组织,且其表达与肿瘤的TNM密切相关,提示该通路的激活与肿瘤进展有关。David等运用免疫组织化学方法分析61例早中期NSCLC,研究发现 p-Akt阳性表达率为 23%(14/61),p-Akt是NSCLC独立的不良预后因素之一[10]。其研究结果同样被Al-Saad等研究证实,研究同时发现肿瘤间质细胞中高表达PI3K是NSCLC独立的有利预后因素之一,其原因可能是该通路的活化导致肿瘤间质细胞过度增殖,这种增殖反而能抑制肿瘤细胞的过度增殖及侵袭能力[5]。Shah等研究分析了82例I-ⅢA期NSCLC的p-Akt表达,研究结果提示p-Akt是NSCLC独立的有利预后因素之一[14]。Al-Saad S等认为这些不一致的研究结果可能与入选样本数量、特性、肿瘤分期、实验方法及实验试剂的不同有关。
目前对PI3K/Akt/mTOR信号传导通路在晚期非小细胞肺癌中表达及其对预后的影响的仍需进一步研究。本研究回顾性分析87例晚期NSCLC及16例手术切除的肺癌癌旁组织的临床资料,发现PI3K及p-Akt在晚期NSCLC肿瘤组织中均可见表达,其表达部位以细胞浆和细胞膜为主,而在细胞核少见或未见表达,研究发现细胞核表达与细胞浆表达的强度相关,而在手术切除的肺癌旁正常肺组织少见表达,研究结果与Tsurutani J及David等报道一致[10,13],提示PI3K及p-Akt与晚期肺肿瘤发生、发展密切相关。研究结果亦显示,p-Akt的表达与晚期NSCLC的TNM分期呈正相关,提示Akt激活增强肺肿瘤的增殖和侵袭能力。
本文多因素生存分析结果显示,p-AKT,TNM分期及ECOG PS评分是晚期NSCLC预后不利因素,此结果与David及Al-Saad等报道一致[5,10],而与Shah等报道相反[14],可能与入选样本的数量及肿瘤的TNM分期有关。本文结果显示,PI3K在主要表达于肺癌细胞浆中,间质中少见表达,PI3K亦是晚期NSCLC预后不利因素,与Al-Saad等[5]研究相反。Al-Saad等研究结果提示肺肿瘤间质细胞中高表达PI3K是肺癌预后的有利因素,而肺肿瘤细胞中高表达PI3K与预后无关,其原因可能是该通路的活化导致肿瘤间质细胞过度增殖,这种增殖反而能抑制肿瘤细胞的过度增殖及侵袭能力。我们认为这种表达的差异可能与入选样本的肿瘤TNM分期不同有关,NSCLC的TNM分期越高,该通路的活化激活的程度越高。本研究结果显示,PI3K与晚期NSCLC的相关病理特征无相关性,与国外的相关报道一致,其机制目前尚不明确,可能与该信号传导通路的特征有关,胞内信号传导分子经磷酸化的瀑布反应,将信号逐级放大,最终将其传到核内的转录机构,其上游的相关靶点的表达可能与临床特征无关,但随着级联反应呈瀑布式发展,导致下游通路的相关的表达增强,从而与肿瘤发展、预后有关。
总之,在晚期NSCLC中,p-AKT及PI3K过度表达导致增强肿瘤细胞增值和侵袭能力,并显著的影响晚期NSCLC的预后,p-AKT及PI3K基因很可能会成为晚期肺癌分子靶向治疗的的重要靶点。
[1]Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61(2):69-90.
[2]Roccaro AM,Sacco A,Husu EN,et al.Dual targeting of the PI3K/Akt/mTOR pathway as an antitumorstrategy in Waldenstrom macroglobulinemia[J].Blood,2010,115(3): 559-569.
[3]Missiaglia E,Dalai I,Barbi S,et al.Pancreatic endocrine tumors:expression profiling evidences a role for AKT-mTOR pathway[J].J Clin Oncol,2010,28(2):245-255.
[4]宫晨,郭风劲,秦亮,等.LY294002抑制PI3K/Akt通路对人骨肉瘤类肿瘤干细胞增殖的影响[J].中华实验外科杂志,2011,28(12):2215-2217.
[5]Al-Saad S,Donnem T,Al-Shibli K,et al.Diverse prognostic roles of Akt isoforms,PTEN and PI3K in tumor epithelial cells and stromal compartment in non-small cell lung cancer[J].Anticancer Res,2009,29(10):4175-4183.
[6]Jiang A,Gao X,Zhang D,et al.Expression and clinical significance of the Trop-2 gene in advanced non-small cell lung carcinoma[J].Oncol Lett,2013,6(2):375-380.
[7]Shaw RJ,Cantley LC.Ras,PI(3)K and mTOR signalling controls tumour cell growth[J].Nature,2006,441(792):424-430.
[8]Zhao P,Meng Q,Liu LZ,et al.Regulation of survivin by PI3K/Akt/p70S6K1 pathway[J].Biochem Biophys Res Commun,2010,395(2):219-224.
[9]Babchia N,Calipel A,Mouriaux F,et al.The PI3K/Akt and mTOR/P70S6K signaling pathways in human uveal melanoma cells:interaction with B-Raf/ERK[J].Invest Ophthalmol Vis Sci,2010,51(1):421-429.[10]David O,Lebeau H,Brody AR,et al.Phospho-Akt overexpression in non-small cell lung cancer confers significant stage-independent survival disadvantage[J].Chest,2004, 125(5 Suppl):152S.
[11]Tang JM,He QY,Guo RX,et al.Phosphorylated Akt overexpression and loss of PTEN expression in non-small cell lung cancer confers poor prognosis[J].Lung Cancer,2006, 51(2):181-191.
[12]Tsao AS,Mcdonnell T,Lam S,et al.Increased phospho-AKT(Ser(473))expression in bronchial dysplasia:implications for lung cancer prevention studies[J].Cancer Epidemiol Biomarkers Prev,2003,12(7):660-664.
[13]Tsurutani J,Fukuoka J,Tsurutani H,et al.Evaluation of two phosphorylation sites improves the prognostic significance of Akt activation in non-small-cell lung cancer tumors[J].J Clin Oncol,2006,24(2):306-314.
[14]Shah A,Swain WA,Richardson D,et al.Phospho-akt expression is associated with a favorable outcome in nonsmall cell lung cancer[J].Clin Cancer Res,2005,11(8): 2930-2936.
[15]Balsara BR,Pei J,Mitsuuchi Y,et al.Frequent activation of AKT in non-small cell lung carcinomas and preneoplastic bronchial lesions[J].Carcinogenesis,2004,25(11): 2053-2059.
Expression and clinical significance of the PI3K/Akt signal transduction pathway in advanced non-small cell lung carcinoma
GAO Xiaoyan,JIANG Aigui,LU Huiyu
(Department of Respiratory Medicine,Taizhou People's Hospital,Taizhou,Jiangsu 225300)
Objective:To investigate the expression of phosphatidylinositol 3-kinase(PI3K)and phosphorylated Akt B (p-Akt)protein and its relationship to prognosis in advanced non-small-cell lung carcinoma(NSCLC).Methods:The clinical records of 87 patients with advanced NSCLC,consisting of 37 cases with squamous cell carcinoma (SCC)and 50 cases with adenocarcinoma (AdC),together with 16 tumor-adjacent normal tissues,were retrospectively evaluated.PI3K and p-Akt expression were measured by using an immunohistochemical method and its association with clinicopathological data and prognosis were also evaluated.Results:PI3K and p-Akt expression was significantly higher in cancer tissues than that in tumor-adjacent normal tissues(P=0.001,0.005;respectively).The overexpression of p-Akt was only related to TNM stage (P=0.016)and no correlation was observed with gender,age,histological categories,histological grade,and ECOG performance status.The overexpression of PI3K was not related to the above clinicopathological variables.The survival was significantly better in patients with PI3K and p-Akt negative expression than with positive expression[17.699 months(95%CI 15.114-20.283)/13.426 months (95%CI 11.832-15.021),P=0.004 and 17.134 months (95%CI 14.927-19.341)/13.067 months(95%CI 11.316-14.817),P=0.007].Multivariate analysis showed that PI3K (HR=2.128,P=0.009),p-Akt(HR= 0.501,P=0.045),TNM stage (HR=4.808,P<0.001)and ECOG performance status(HR=3.277,P<0.001)were independent predictors for survival in advanced NSCLC.Conclusion:PI3K and p-Akt overexpression are independent prognostic markers and potential new therapeutic targets in advanced NSCLC.
non-small-cell lung carcinoma;phosphatidyl inositol 3-kinase;phosphorylated Akt;prognosis;survival
R734.2
A
高小燕,女,汉族,江苏泰州人,生于1981年5月,硕士,主治医师。研究方向:肺癌的诊断与治疗。
2014-05-20
1006-2440(2014)04-0322-06
