星形细胞肿瘤组织中VEGF-A、VEGF-C的表达变化及其与肿瘤血管生成的关系
2014-02-22秦跃红王功朝许尚臣栾立明
秦跃红,王功朝,刘 滨,许尚臣,栾立明,庞 琦
(山东大学附属山东省立医院,济南250021)
新生血管的生成在肿瘤发生和发展过程中起至关重要的作用,而多种血管生成因子在肿瘤新生血管生成中起重要作用。血管内皮生长因子(VEGF)家族是目前研究最多,被认为是起主要作用且作用最强的一种血管生长因子[1,2],VEGF-A和VEGF-C是该家族中的重要成员。本研究在基因转录和翻译水平检测了不同WHO分级星形细胞肿瘤组织中VEGF-A和VEGF-C的蛋白、mRNA表达,同时通过免疫组织化学方法检测了肿瘤组织中微血管密度(MVD),旨在为星形细胞肿瘤的靶向治疗及预后判定提供依据。
1 资料与方法
1.1 临床资料 2007年12月~2010年6月在山东省立医院神经外科行首次手术切除的星形细胞肿瘤患者92例,男52例,女40例;年龄(38.33± 13.06)岁。手术留取星形细胞肿瘤组织标本,均经病理检查证实诊断,按WHO2000中枢神经系统肿瘤分类标准Ⅱ级27例、Ⅲ级30例、Ⅳ级35例。另取9例接受高血压脑出血开颅手术患者的正常脑组织(均经知情同意)作为对照。
1.2 主要试剂 兔抗人VEGF-C单克隆抗体、兔抗人VEGF-A单克隆抗体和兔抗人CD34单克隆抗体为美国Santa Cruz公司产品,免疫组织化学(SP法)山羊抗兔二抗试剂盒购于北京中杉金桥公司。TRIzol试剂盒、RT-PCR试剂盒均为大连宝生物公司产品。VEGF-A和VEGF-C引物根据GenBank中的相应序列,均由大连宝生物公司设计并合成,VEGF-A引物: 5'-GAGCCTTGCCTTGCTGCTCTAC-3',下游为:5'-TGGCACCCAGCACAATGAA-3',扩增片段为148 bp; VEGF-C引物:上游为5'-AGCTACCTCAGCAAGACGTTA-3',下游为5'-GCAGGAAGTGTGATTGGCAAA-3',扩增片断长度为93 bp;β-actin引物:上游为5'-TGGCACCCAGCACAATGAA-3',下游为5'-CTAAGTCATAGTCCGCCTAGAAGCA-3',扩增片段为186 bp。
1.2 VEGF-A、VEGF-C蛋白和CD34(MVD)检测 分别取两种脑组织标本,采用免疫组织化学(SP)法检测,具体实验步骤按照说明书进行。用PBS代替一抗作为阴性对照,用已知甲状腺癌标本作为阳性对照。高倍镜下随机取5个视野内细胞计数,VEGF-A、VEGF-C蛋白阳性信号为胞质内有棕黄色或棕褐色颗粒、无背景着色。CD34抗体可将血管内皮细胞染成棕黄色,高倍镜下(×400倍)计数5个视野内微血管数量,其平均值即为MVD。
1.3 VEGF-A、VEGF-CmRNA检测 ①总RNA抽提和cDNA合成:分别取星形细胞肿瘤和正常脑组织标本各100 mg,参照TRIzol试剂产品说明书提取总RNA。紫外分光光度计下测得260、280 nm处的吸光度(其比值均在1.8~2.0)。参照TaKaRa公司反转录试剂盒说明书用oligo DT逆转录合成cDNA。②RT-PCR扩增:根据RT-PCR试剂盒说明书进行PCR反应,内参为β-actin。针对各靶基因的引物根据GenBank中的相应序列,由大连宝生物公司设计并合成。目的基因数量用相对定量表示,内参基因β-actin的数量进行标准化。先分别获得各组织目的基因、内参基因的CT值,ΔCT=目的基因CT值-内参基因CT值,ΔΔCT=肿瘤组织ΔCT-正常脑组织ΔCT。肿瘤组织目的基因相对应于正常脑组织目的基因的量用2-ΔΔCT计算。实验重复3次,取平均值。
1.4 统计学方法 采用SPSS17.0软件进行统计学分析。VEGF-A、VEGF-C蛋白表达与MVD的关系进行非参数检验,在正常脑组织和不同WHO分级星形细胞肿瘤中的表达差异进行χ2检验;VEGF-A、VEGF-CmRNA在不同WHO分级星形细胞肿瘤间及正常脑组织中的表达差异进行单因素方差分析; VEGF-A和VEGF-C表达的关系进行直线相关分析。P≤0.05为差异有统计学意义。
2 结果
2.1 VEGF-A、VEGF-C蛋白表达和MVD 星形细胞肿瘤组织中VEGF-A、VEGF-C蛋白阳性表达率及MVD均显著高于正常脑组织,且均随肿瘤恶性程度增高而增大(P均<0.01);肿瘤组织中VEGF-A、VEGF-C蛋白表达及两者与MVD均呈显著相关(P均<0.01)。详见表1。
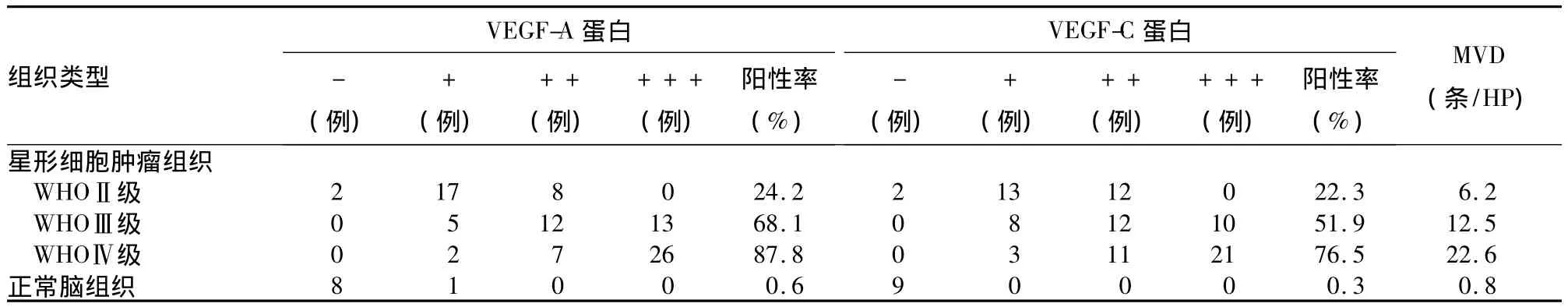
表1 不同脑组织VEGF-A蛋白、VEGF-C蛋白、MVD比较
2.2 星形细胞肿瘤组织中VEGF-A、VEGF-C mRNA的表达 星形细胞肿瘤组织中 VEGF-A和 VEGF-CmRNA表达均显著高于正常脑组织,且均随肿瘤恶性程度增高而增强(P均<0.05);肿瘤组织中VEGF-A和VEGF-CmRNA相对表达呈显著相关(P均<0.05)。详见表2。
表2 星形细胞肿瘤组织中VEGF-A、VEGF-C m RNA的表达比较(±s)

表2 星形细胞肿瘤组织中VEGF-A、VEGF-C m RNA的表达比较(±s)
星形细胞肿瘤组织VEGF-A mRNA VEGF-CmRNA WHOⅡ级 1.82±0.59 1.71±0.53 WHOⅢ级 2.94±0.82 3.05±0.78 WHOⅣ级3.37±0.96 3.35±0.94
3 讨论
星形细胞肿瘤是中枢神经系统中最常见和难治愈的原发性上皮肿瘤[3],WHO2000分类标准根据肿瘤恶性程度将其分为4级,其中Ⅱ级为低度恶性肿瘤(星形细胞瘤)、Ⅲ级(间变性星形细胞瘤)及Ⅳ级(多形性胶质母细胞瘤)为高度恶性肿瘤[4]。星形细胞瘤虽为低级别胶质瘤,但因为肿瘤有浸润性生长特性,难以做到全切除,术后复发率高。间变性星形细胞瘤和多形性胶质母细胞瘤恶性程度极高,约占所有脑原发肿瘤的30%及胶质瘤的50%,肿瘤细胞常与周边正常脑组织混杂生长,采取术后放化疗者生存时间一般仅为3个月~2 a[5]。因此,明确星形细胞肿瘤的发病机制,并针对性地采取新型生物性治疗,有可能延长患者的生存时间、降低复发率。
血管生成与多种肿瘤如乳腺组织、脑组织和胃组织等恶性肿瘤的预后、复发显著相关[6,7]。血管生成因子在新生血管生成过程中起核心作用,已知的重要成员包括VEGF家族、肝细胞生长因子家族和纤维生成因子家族等,其中VEGF家族是研究最为广泛和深入的一支,包括 VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E及胎盘生长因子等。VEGF-A是已知VEGF家族中作用最强的成员[8],可刺激血管内皮细胞增殖、诱导新生血管的生成[9]。VEGF-A受体抑制剂目前已应用于临床,并被证实可延长胶质母细胞瘤和其他实质性肿瘤患者的生存时间,改善患者的生存质量[10]。但是,VEGF-A靶向治疗仍无法完全抑制胶质瘤的血管生成,阻止胶质瘤的复发。VEGF-C以往被认为仅与肿瘤区域淋巴结转移密切相关,但新近研究[11]显示其还可促进微血管形成、间接促进肿瘤血行转移,缩短患者生存时间和降低生存率。多项研究证实,VEGF-A和VEGF-C在多种癌组织中存在共表达。Aliparasti等[12]发现急性淋巴性白血病细胞中VEGF-A和VEGF-C表达存在显著相关,Salajegheh等[13]通过免疫组织化学技术和RT-PCR技术在甲状腺癌组织中得出相似结论。本研究显示,星形细胞肿瘤组织及正常脑组织中VEGF-A、VEGF-C表达有显著差异,且两者间的表达及与肿瘤WHO分级、MVD之间均呈显著正相关。提示随星形细胞肿瘤恶性程度增高,肿瘤细胞病理性分裂增殖活动及代谢加快,原有血管已不能满足肿瘤组织对营养物质的需求;VEGF-A、VEGF-C可能通过共同促进病理性新生血管生成参与星形细胞肿瘤的发生、发展,但具体机制尚待深入研究。
综上所述,VEGF-A、VEGF-C在星形细胞肿瘤组织中的表达上调并与肿瘤恶性程度有关,两者间及与肿瘤血管生成均呈显著相关,此为星形细胞肿瘤的靶向治疗及预后判定提供了新思路。
[1]Ferrara N,Davis-Smyth T.The biology of vascular endothelial growth factor[J].Endocr Rev,1997,18(1):4-25.
[2]Neufeld G,Cohen T,Gengrinovitch S,et al.Vascular endothelial growth factor(VEGF)and its receptors[J].FASEB J,1999,13 (1):9-22.
[3]Legler JM,Ries LA,Smith MA,et al.Brain and other central nervous system cancers:recent trends in incidence and mortality[J].JNatl Cancer Inst,1999,91(23):2005-2205.
[4]Kleihues P,Burger PC,Scheithauer BW.The new WHO classification of brain tumors[J].Brain Patho,1993,3(3):255-268.
[5]赵继宗,周良辅,周定标,等.神经外科学[M].北京:人民卫生出版社,2007:379-383.
[6]Rijken PF,Bernsen HJ,Peters JP,et al.Spatial relationship between hypoxia and the(perfused)vascular network in a human glioma xenograft:a quantitativemulti-parameter analysis[J].Int J Radiat Oncol Biol Phys,2000,48(2):571-582.
[7]Hanahan D,Folkman J.Patterns and emergingmechanisms of the angiogenic switch during tumorigenesis[J].Cell,1996,86(3): 353-364.
[8]Chamberlain MC.Bevacizumab for the treatment of recurrent glioblastoma[J].Clin Med Insights Oncol,2011,5:117-129.
[9]张梅,左颖,许轶曼.MMP-2和VEGF在子宫肌腺症中的表达[J].山东医药,2008,48(14):115-116.
[10]Lazǎr D,Raica M,Sporea I,et al.Tumor angiogenesis in gastric cancer[J].Rom JMorphol Embryol,2006,47(1):5-13.
[11]杨惠,许林平,庞雅青,等.食管癌血管形成相关因子的表达及意义[J].河南医学研究,2010,19(2):249-253.
[12]Aliparasti MR,Almasi S,Sanaat Z,et al.Gene expression of VEGF-A and VEGF-C in peripheral blood mononuclear cells of iranian patients with acute myeloid leukemia[J].Turk JHaematol,2013,30(2):134-143.
[13]Salajegheh A,Pakneshan S,Rahman A,et al.Co-regulatory potential of vascular endothelial growth factor-A and vascular endothelial growth factor-C in thyroid carcinoma[J].Hum Pathol,2013,44(3):2204-2212.
