橘皮残渣中水不溶性膳食纤维提取工艺研究
2014-02-22蔡卫超周炳贤江春立丁文彪卿万梅谭世语
蔡卫超,周炳贤,江春立,丁文彪,卿万梅,谭世语
(重庆大学化学化工学院,重庆400044)
膳食纤维(dietary fiber,DF)是指不能被人体内源酶消化吸收的可食性植物细胞、多糖、木质素以及相关物质的总和。按其水溶性的不同又可将其分为水溶性膳食纤维(soluble dietary fiber,SDF)和水不溶性膳食纤维(insoluble dietary fiber,IDF)两类。膳食纤维被称为除水、蛋白质和脂肪、碳水化合物以及矿物质、维生素之外的“第七大营养素”,能有效减少和预防结肠炎、糖尿病、便秘、高血压以及肥胖症等疾病的发生,具有平衡人体营养、调节机体功能的突出保健功能而被人们所认识[1]。
众所周知,柑橘是世界第一大水果。柑橘皮内含有丰富的纤维素成分,是膳食纤维的良好来源。目前,国内柑橘被加工后的皮渣一般作为饲料、肥料或废弃物处理,经济效益极低,而且不仅造成了极大的资源浪费,还会对人类赖以生存的环境造成严重的污染,因此对柑橘皮的开发利用具有广阔的前景。近年来,对柑橘皮中水不溶性膳食纤维提取的相关报导越来越多,其中提取方法主要有化学法、酶法、酶-化学法、微波-化学法等[2-6]。但之前报道的研究几乎都是直接以柑橘皮为原料,而本研究以提取橙皮苷和果胶后的橘皮残渣为原料。由于果胶的提取采用酸提取方法,柑橘皮中的水溶性膳食纤维绝大部分都在此过程中被提取出来,剩余的橘皮残渣中主要是水不溶性膳食纤维。据此,本研究探讨了采用化学方法提取膳食纤维的制备工艺条件,对实现柑橘皮渣的连续、综合利用提供技术参考与支持。
1 材料与方法
1.1 材料与仪器
橘皮残渣 由湖南鑫利生物科技有限公司提供,经甲醇提取橙皮苷、酸提取果胶后残余;95%乙醇、盐酸、氢氧化钠、30%过氧化氢 均为分析纯;耐高温α-淀粉酶、中性蛋白酶、糖化酶;所用其他试剂 均为分析纯。
HHS 4S电子恒温不锈钢水浴锅 上海光地仪器设备有限公司;PHS-25 pH计 上海精密科学仪器有限公司;DHG-9075A电热恒温鼓风干燥箱 上海齐欣科学仪器有限公司;SHZ-D(Ⅲ)循环水式真空泵 巩义市英峪仪器厂;FA2004B电子分析天平上海越平科学仪器有限公司;D971电动搅拌器 郑州长城科工贸有限公司;SRJX-2-9马弗炉 广州沪瑞明仪器有限公司。
1.2 实验方法
1.2.1 水不溶性膳食纤维的提取、脱色工艺流程 橘皮残渣→氢氧化钠浸泡→水洗至中性→盐酸浸泡水解(pH=2)→水洗至中性→H2O2漂白→水洗至中性→78%乙醇洗1~2遍→干燥→水不溶性膳食纤维(IDF)。
1.2.2 操作要点 称取10g(干基质量)橘皮渣,在一定温度、固液比下,加入一定浓度NaOH溶液,浸泡一段时间后,过滤,水洗至中性。然后在80℃下,加入pH=2的盐酸溶液反应1.5h[2,7-9],过滤,水洗至中性。在一定温度、pH下,加入一定浓度的H2O2漂白一段时间,过滤,78%乙醇洗1~2遍,干燥至恒重得IDF,测定IDF产率和提取率,计算公式如下:

1.2.2 分析测定方法
1.2.2.1 常规化学成分含量分析 水不溶性膳食纤维的含量测定:采用AOAC 991.43方法;水分含量测定:采用GB 5009.3-2010;蛋白质含量测定:采用GB 5009.5-2010;脂肪含量测定:采用酸水解法测定;灰分含量测定:采用GB 5009.4-2010。
1.2.2.2 持水力测试[10]取样品1.00g放入烧杯中,加入20℃水浸泡1h,滤纸滤干水分后,将其转移到表面皿中称重,计算持水力。做三组平行实验,求平均值。

1.2.2.3 溶胀性测试[10]称取样品1.00g,置于10m L量筒中,读干品体积,然后加入5m L蒸馏水,摇匀,在室温下放置24h,读溶胀后纤维的体积,计算溶胀性。做三组平行实验,求平均值。

1.3 实验设计
1.3.1 单因素实验设计
1.3.1.1 碱浓度对IDF产率的影响 在固液比1∶25(g/m L)、浸泡温度60℃、浸泡时间1h条件下,分别采用0.05、0.25、0.45、0.65、0.85mo1/L的NaOH进行碱解,比较浓度对IDF产率的影响。
1.3.1.2 固液比对IDF产率的影响 分别选取固液比为1∶15、1∶20、1∶25、1∶30、1∶35g/m L,NaOH浓度为0.25mol/L,浸泡温度为60℃,浸泡时间为1h提取IDF,比较固液比对IDF产率的影响。
1.3.1.3 碱浸泡温度对IDF产率的影响 分别选取碱浸泡温度为30、40、50、60、70℃,NaOH浓度为0.25mol/L,固液比为1∶25(g/m L),浸泡时间为1h提取IDF,比较固液比对IDF产率的影响。
1.3.1.4 碱浸泡时间对IDF产率的影响 分别选取浸泡时间为0.5、1.0、1.5、2.0、2.5h,NaOH浓度为0.25mol/L,固液比为1∶25(g/m L),浸泡温度为60℃提取IDF,比较固液比对IDF产率的影响。
1.3.2 正交实验设计
1.3.2.1 碱浸泡正交实验 根据单因素实验结果,选取碱浓度、固液比、碱浸泡温度、碱浸泡时间4个因素,做L9(34)正交实验。因素水平见表1。

表1 碱浸泡正交实验水平表Table1 Factors and levels of orthogonal tests for alkalisoaking
1.3.2.2 IDF脱色正交实验 经查阅资料,确定以H2O2为脱色剂。其作用机理是:H2O2+H2O=H3O++OOH-,其中OOH-具有强氧化性,从而使膳食纤维达到氧化脱色的目的。通过预实验和查找资料确定影响脱色效果的主要因素为:双氧水浓度、脱色温度、脱色时间、pH等[10,11-13],因此采用L9(34)正交实验进行优选,其因素水平见表2。

表2 IDF脱色正交实验水平表Table2 Factors and levels of orthogonal tests for IDF decoloration
2 结果与讨论
2.1 碱浸泡条件对IDF产率的影响
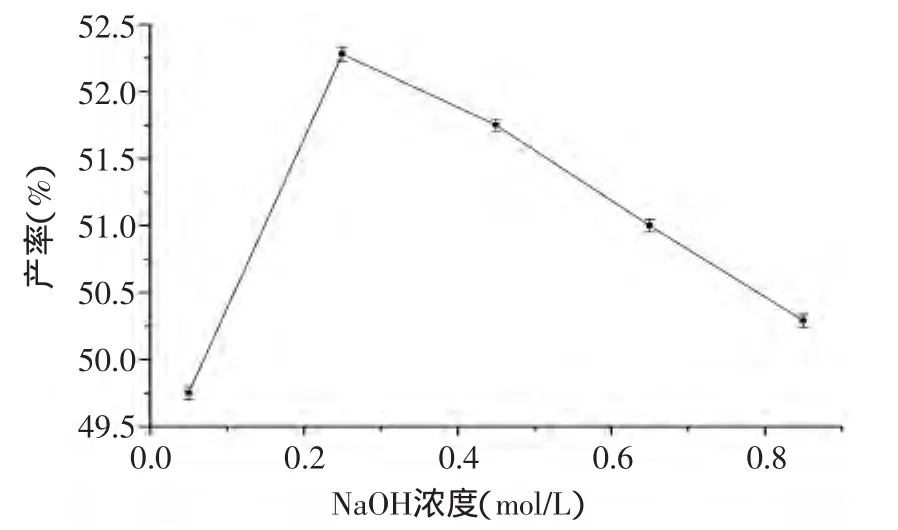
图1 NaOH浓度对IDF产率的影响Fig.1 Influence of NaOH concentration on the yield of IDF
2.1.1 碱浓度对IDF产率的影响 由图1可知,橘皮残渣中水不溶性膳食纤维的产率随NaOH浓度的升高而增加,当NaOH浓度为0.25mol/L时,产率达到最大,而后又急剧下降。因为NaOH是碱解蛋白质的重要试剂,浓度过低,碱解不充分[1];当浓度超过0.25mol/L,大部分纤维素会与NaOH发生反应,生成碱纤维素,使纤维素的结构性质受到破坏,这对不溶性纤维的制备产生影响,同时增大废液处理量[14]。
2.1.2 固液比对IDF产率的影响 由图2可知,随着固液比的增加不可溶性膳食纤维的产率现增加后减小,当固液比为1∶20时产率最大。这因为随着固液比的增加残渣中的半纤维素充分溶解,与固相渣分离,产率达到最大。之后固液比若再增加,就会有一部分水不溶性纤维素被水解成小分子多糖、低聚糖或者单糖,所以产率又降低[14-15]。

图2 固液比对IDF产率的影响Fig.2 Influence of solid-liquid ratio on the yield of IDF
2.1.3 碱浸泡温度对IDF产率的影响 由图3可知,随着温度的增加IDF产率不断上升,当NaOH浸泡温度在50℃时,IDF的产率达到较高值。因为氢氧化钠溶液随着温度升高,蛋白质、脂肪等物质的溶解性提高,而半纤维素等物质还没有发生水解作用,因此产率也不断提高。而当温度超过50℃时,由于温度过高部分的半纤维素及部分的纤维素都发生了水解,导致了IDF提取率不断下降[16]。

图3 碱浸泡温度对IDF产率的影响Fig.3 Influence of alkalisoaking temperature on the yield of IDF
2.1.4 碱浸泡时间对IDF产率的影响 由图4可知,随着浸泡时间的延长,橘皮残渣膳食纤维产率明显增加,并在1.5h左右达到最大。当浸泡时间超过1.5h后产率降低。这是因为,当浸泡时间较短时,IDF没有完全溶出,产率较低;而当浸泡时间过长,部分生成的膳食纤维降解,聚合度降低,产率下降。因此,选择时间为1.0~2.0h作为正交实验的因素水平范围[16]。
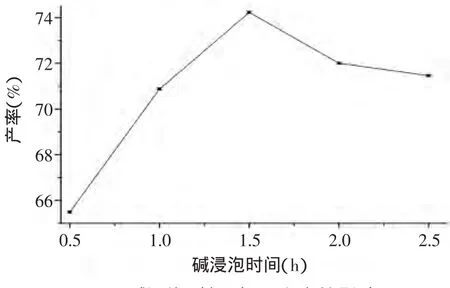
图4 碱浸泡时间对IDF产率的影响Fig.4 Influence of alkalisoaking time on the yield of IDF
2.1.5 碱浸泡正交实验 根据单因素实验结果,采用正交实验,以IDF产率为指标,考察碱浓度、固液比、碱浸泡时间和碱浸泡温度对IDF产率的影响,确定提取的最佳工艺条件。IDF产率正交实验结果见表3。

表3 碱提正交实验结果及分析Table3 Results of orthogonal test for alkalisoaking
由表3可以看出,影响橘皮残渣中IDF产率的主次顺序为:D>B>C>A,即碱提温度>料液比>碱提时间>NaOH浓度。通过对k值的比较,可知A1B1C1D2为橘皮残渣中不溶性膳食纤维提取的最优水平,通过验证实验,在该条件下得到IDF产率为65.34%,高于表3中其他组合的产率。
2.2 膳食纤维脱色正交实验
以IDF产率以及产品颜色为指标,考察H2O2质量分数、pH、脱色时间、脱色温度对IDF产率的影响,确定提取的最佳工艺条件。IDF产率正交实验结果见表4。
由表4可知,影响橘皮残渣中IDF产率的主次顺序为:A>B>C>D,即H2O2浓度>pH>脱色时间>脱色温度。通过对k值的比较,可知A1B3C2D1为橘皮残渣中不溶性膳食纤维提取的最优水平。而且在该条件下进行漂白后所得到的产品颜色为白色。
2.3 最佳工艺条件验证
根据碱浸泡及脱色正交实验得出的最佳工艺条件,按照1.2.1工艺流程进行最佳工艺条件验证,结果如表5所示。

表4 IDF脱色正交实验结果及分析Table4 Results of orthogonal test for IDF decoloration
由表5可知,在最佳工艺条件下,IDF的平均产率达到65.98%,平均提取率达到92.86%。和于海莲等[17]采用化学法提取橘皮中水不溶性膳食纤维最终提取率为61.79%相比,本研究IDF的提取率较高。
2.4 IDF功能性的测定
膳食纤维持水力与溶胀性的大小是衡量膳食纤维品质好坏的两个重要特征,持水力、溶胀性越大,膳食纤维达到生理活性就越好。按照1.2.2.2和1.2.2.3所述方法,测定最佳工艺条件下制得的IDF的持水力为8.48g/g,溶胀性为10.48m L/g。与于海莲等[17]采用化学法提取的橙皮IDF相比,本实验所得到的IDF的持水力和溶胀性均相对较高。
3 结论

表5 最佳工艺验证结果Table5 The verification results of optimum process conditions
本实验结果表明,提取果胶和橙皮苷后橘皮残渣中水不溶性膳食纤维制备的碱浸泡最佳工艺条件为:NaOH浓度为0.25mol/L、固液比为1∶15g/m L、碱浸泡温度为50℃、碱浸泡时间1.0h;IDF脱色最佳工艺条件为:H2O2质量分数为4%、pH为9、脱色时间3h、脱色温度为60℃。最终IDF的产率为65.98%,提取率为92.86%,持水力为8.48g/g,溶胀性为10.48m L/g。和之前有关柑橘属果膳食纤维提取研究相比,本研究制备的IDF的产率和提取率均相对较高,产品的品质相对较好,符合作为食品添加剂的质量标准[18],对实现橘皮渣二次利用具有一定的借鉴意义。
[1]吴笑臣,王科军,钟金莲,等.脐橙渣膳食纤维提取工艺的研究[J].中国酿造,2011(11):72-75.
[2]梁敏,潘英明,唐明明,杨恒建.从柚子皮中提取膳食纤维的研究[J].化工技术与开发,2003,32(6):20-22.
[3]李焕霞.柑橘膳食纤维制备工艺技术及品质分析研究[D].重庆:西南大学,2007.
[4]Grohmann K,Cameron R G,Buslig B S.Fractionation and pretreatmentoforange peelby diluteacid hydrolysis[J].Bioresource Technology,1995,54(2):129-141.
[5]郑红艳,范超敏,钟耕,王博.小米麸皮膳食纤维提取工艺的研究[J].食品工业技,2011(3):262-266,269.
[6]王华,李焕霞,刘树立.柑橘膳食纤维的微波-化学法制备工艺研究[J].食品科学,2008,29(8):155-157.
[7]欧阳玲花,蒲彪,张雪梅,等.柠檬皮膳食纤维制备工艺的研究[J].食品研究与开发,2005,26(6):80-83.
[8]潘英明,梁英,王恒山,等.从罗汉果渣中提取水不溶性膳食纤维的研究[J].广西植物,2003,23(4):370-372.
[9]金建昌.茭白壳中不溶性膳食纤维的研究[D].杭州:浙江大学,2006.
[10]林德荣,涂宗财,刘成梅.桔皮膳食纤维的提取及脱色工艺研究[J].粮食与食品工业,2008,15(6):14-16.
[11]韩军.葛根膳食纤维加工工艺及其性质的研究[D].长沙:中南林学院,2005.
[12]臧玉红.柑橘皮连续提取有效成分的工艺研究[D].天津:天津大学,2006.
[13]张存莉,邵宜添,邹勇,等.北枳椇果渣不溶性膳食纤维的制备及其性能特性研究[J].林产化学与工业,2010,30(4):59-64.
[14]王顺民,薛正莲,方玉双.菜籽皮不溶性膳食纤维提取工艺优化[J].食品工业科技,2012,33(4):308-311.
[15]李凤霞,胡书皋,张钟.薇菜水不溶性膳食纤维提取工艺研究[J].饮料工业,2007,10(5):21-23.
[16]郭金喜.杏渣中水不溶性膳食纤维提取工艺研究[D].乌鲁木齐:新疆农业大学,2010.
[17]于海莲,梁芳,张吟.从橙子皮中提取不可溶性膳食纤维的研究[J].内江科技,2012(7):32.
[18]GB/T 22494-2008大豆膳食纤维粉[S].
