副溶血弧菌胶体金检测试纸条的改进
2014-02-22王报贵王广峰武晓丽董素琴
王报贵,王广峰,武晓丽,董素琴,明 星,魏 华,徐 锋,*
(1.南昌大学生命科学与食品工程学院中德联合研究院,江西南昌330047;2.菏泽学院园林工程系,山东菏泽274000;3.江西中医学院基础医学部,江西南昌330004)
副溶血弧菌是一种能够引起急性肠胃炎且广泛存在的食源性致病菌,主要存在于海水、水生生物及海底沉淀物中,其特点是在高盐的环境中才能生长。所以该菌引起的食物中毒主要爆发于沿海地带,由于从业人员卫生意识薄弱,使食品之间因交叉污染和再次污染所引起的食物中毒的现象经常发生[1-2]。目前副溶血弧菌所引起的微生物性食物中毒、发生规模及人群暴露规模呈明显上升趋势,现已成为我国首要的食源性致病菌[3]。为了提高人们对副溶血弧菌的重视程度,降低食源性疾病的风险,建立一种快速、简便检测方法对及时控制副溶血弧菌食源性疾病具有重要意义。
针对于副溶血弧菌传统的检测方法,包括:生理生化实验、分子生物学检测、酶联免疫吸附法。目前最广泛的定量检测方法为最大可能数方法,不仅费时费力,而且操作复杂且灵敏度有限[4]。而以PCR[5]及ELISA为基础的检测方法,不仅需要专业的技术研究人员,严格的检测环境而且设备价格昂贵[6]。免疫胶体金层析技术近几年来在生物医学各领域中得到了日益广泛的应用,具有方便快捷、特异敏感、稳定性强、不需要特殊设备和试剂、结果判断直观等优点,但常规免疫胶体金层析技术显色强度具有一定的局限性,不利于肉眼对阳性信号的判断。本实验为了对副溶血弧菌进行快速准确的检测,降低疾病发生范围和危害,在常规试纸条免疫反应的基础上,首次利用金标二抗增强副溶血弧菌试纸条的显色强度,15m in检测结果即达到稳定,满足了非专业人员在现场快速检测的要求。
1 材料与方法
1.1 材料与仪器
副溶血弧菌单抗 购自上海慧耘生物技术有限公司;弗氏佐剂、K2CO3、BSA、氯金酸(HAuCl4)、柠檬酸钠 购自美国Sigma公司;二抗(羊抗鼠、羊抗兔、驴抗鼠)、TMB显色液、LB培养基、MRS培养基 购自北京中杉金桥生物技术有限公司;副溶血弧菌显色培养基 购自广东环凯微生物技术有限公司;健康日本大耳朵白兔(雌性) 购自南昌实验动物中心;新鲜活鱼 购自南昌市周围超市;滤纸、样品垫、胶金垫、NC膜、吸水纸、PVC底板、PNPB重悬液复溶液 中德伯尔生物技术有限公司提供;副溶血弧菌(ATCC 17802)、副溶血弧菌(CMCC 1.1616)、副溶血弧菌(CMCC 1.997)、副溶血弧菌(PVPA 0125)、霍乱弧菌(ATCC 14035)、霍乱弧菌(ATCC27562)、阪崎肠杆菌(ATCC 51329)、阪崎肠杆菌(CMCC 45402)、鼠伤寒沙门氏菌(ATCC 13311)、福氏志贺氏菌(ATCC 29903)、粉尘肠杆菌(PESA5)、单核增生李斯特(ATCC 19115)、大肠杆菌O157∶H 7(EDC)、肠致病性大肠杆菌(CMCC 44496)、鼠伤寒沙门氏菌(ATCC 13311)、阴沟肠杆菌(CMCC 45301)、白假丝酵母(Z1)、藤黄微球菌(CMCC 28003)、短双岐杆菌(WBBR 04)、长双歧杆菌(WBLO 01)、青春双岐杆菌(WBAD 08)、动物双歧杆菌(WBBR 05)、乳双歧杆菌(WLABO 9)、婴儿双岐杆菌(WBAN 07)、两歧双歧杆菌(WBBI 01)、唾液乳杆菌(ATCC 11741)、德式乳杆菌(ATCC 9649)、鼠李糖乳杆菌(ATCC 7469)、嗜酸乳杆菌(ATCC 4356)、保加利亚乳杆菌(WLAB 02)、植物乳杆菌(ATCC 8014) 共30株菌株等均为实验室保存,用20%的甘油保菌,-80℃保存。
BIO-DOT XYZ-3050点喷系统、M illi-Q水处理系统、HGS-201可编程切条机、ZX-6090B真空干燥箱、卡壳、HG-8胶体金试纸条读取仪 江西中德生物工程有限公司提供;超声破碎仪 浙江新芝生物科技公司;DNM 9026全自动酶标仪 北京普朗新技术有限公司。
1.2 实验方法
1.2.1 菌株生长条件 副溶血弧菌采用含有3.5% NaCl的Luria-Bertani(LB)高盐液体培养基,35℃过夜,其他所用菌株采用LB或MRS液体培养基进行常规培养,所有菌株用PBS洗涤经甲醛灭活后,-20℃保存备用。
1.2.2 多克隆抗体的制备 副溶血弧菌免疫日本大耳朵兔获得兔抗副溶血弧菌的多克隆抗体[7]。采用间接ELISA方法测定多抗血清效价[8]。采用斑点杂交检测多抗血清及鼠单抗的特异性,以便于观察是否与其他杂菌具有交叉反应。
1.2.3 多克隆抗体的纯化 本实验参照[9-10]等方法,采用辛酸硫酸铵沉淀和菌体逆向吸附法除去杂蛋白及非特异性的抗体,已获得特异性针对副溶血弧菌的兔多抗,但与金黄色葡萄球菌有一定的交叉反应[11]。
1.2.4 多克隆抗体与单克隆抗体的配对实验 采用双抗夹心ELISA进行抗体的配对实验[12]。捕获抗体的包被:纯化的多克隆抗体,从400倍开始稀释,100μL/孔,设无捕获抗体空白对照,37℃反应1h。用PBST洗涤3次后,用3%的BSA于37℃封闭1h,再用PBST洗涤3次后加入抗原(108CFU/m L)100μL/孔反应1h,设无抗原对照孔,洗涤去除多余抗原后,加入购买的单克隆抗体,从200倍开始稀释,设无检测抗体对照孔,37℃温育1h,PBST洗涤3次后加入经5000倍稀释的酶标羊抗鼠的IgG,100μL/孔,37℃温育30m in后,用PBST洗涤干净,加入显色液,100μL/孔,37℃温育15min后,加入10%的H2SO4,50μL/孔,终止显色,于450nm下测定OD值。本实验中设无捕获抗体、无检测抗体和无抗原孔作为阴性对照孔,排除假阳性的干扰。
1.2.5 胶体金的制备 胶体金的制备采用柠檬酸三钠还原法[13]。将100m L 0.01%的HAuCl4溶液加热煮沸,立即加入1.2m L 1%的柠檬酸三钠溶液,并不断搅拌,溶液的颜色由浅黄-蓝色-深蓝-红色依次变化,当溶液的颜色完全变为透明的红色时,停止加热,冷却至室温,4℃保存。
1.2.6 免疫胶体金的标记 将1个干净的小烧杯加入2m L胶体金,用48μL的0.2mol/L的K2CO3溶液将pH调整为8.0。缓慢滴加200μL单抗或羊抗鼠的二抗,使终浓度分别为25μg/m L,磁力搅拌并避光反应1h后缓慢加入10%BSA使终浓度1%,常温下避光搅拌封闭1h。4℃8000r/min转离心30min,弃上清,沉淀用含0.4%Tween-20的PNPB重悬液复溶,重悬液的用量为标记时胶体金体积的1/10,于4℃保存一周观察标记胶体金的稳定性。
1.2.7 免疫层析纸条的制备 硝酸纤维素膜(CN140,检测带为1.5mg/m L的兔多抗,质控线为1.0mg/m L驴抗鼠IgG)、吸水垫,依次固定于PVC底板上,切割成4mm的条子,组装成卡,用放入干燥剂的薄膜包装,封口,备用。
1.2.8 免疫胶体金标记的检测 将80μL的106CFU/m L副溶血弧菌菌液(实验组)及PBS(对照组)分别加入到2个组装好的试纸条(标记为0和1)中进行层析,5m in后在标记为1的试纸条样品垫上加入4μL的羊抗鼠标记的胶体金,再加入80μL的PBS进行层析。2m in后由胶体金读卡仪每隔30s读取试纸条T线、C线吸光值以及T/C比值,连续监控30m in。以反应时间为横坐标,T线、C线吸光值以及T/C比值为纵坐标绘制试纸条免疫动力学曲线,检测加入羊抗鼠标记的胶体金是否提高显色效果及确定试纸条定量检测的最佳时间。检测线与质控线均有条带为阳性,仅质控线显色为阴性,如质控线无条带,说明试纸条失效[14]。
1.2.9 免疫层析试纸条灵敏性的检测 副溶血弧菌纯培养物,用PBS稀释成不同的浓度(108、107、106、105CFU/m L),备用。将80μL不同梯度的副溶血菌液滴入加样孔中,15m in后进行检测。增强显色实验,将80μL不同梯度的副溶血菌液滴入加样孔中,5min后在加样孔加入4μL的羊抗鼠标记的胶体金,再加入80μL的PBS,根据1.2.8所确定的最佳时间,用胶体金读卡仪进行显色强度的测定。
1.2.10 食品中试纸条灵敏度的检测 取鱼肉样品,碾磨成糜,经2层滤纸过滤后,取滤液混入阪崎肠杆菌与志贺氏菌至终浓度为108CFU/g后,然后掺入不同稀释度的副溶血弧菌于混入阪崎肠杆菌与志贺氏菌的滤液中,至终浓度为108、107、106、105CFU/g,分别取80μL加入到制备好的试纸条加样孔中,进行增强显色实验后进行结果的观察。
1.2.11 免疫层系试纸条的异性的检测 以副溶血弧菌为阳性对照,材料中各菌株为阴性对照,进行试纸条的特异性检测。调整各菌液的浓度为108CFU/m L,取将80μL各菌液滴入加样孔中,15m in后进行检测。1.2.12 检出率的测定 将副溶血弧菌按照1.2.9的方法随机混入含108CFU/g阪崎肠杆菌、志贺氏菌的鱼肉样本,共接种80份样品。同时设定用无菌的PBS代替副溶血弧菌的阴性对照组20份。按照前述方法进行副溶血弧菌检出率的测定。
2 结果与讨论
2.1 实验原理图
实验原理如图1所示,当加入检测物后,随着免疫层析的进行,目标菌与金标垫上偶联胶体金的鼠单抗发生特异性结合形成抗原抗体复合物,被检测线上的抗体捕获,从而使检测线显色,而过量的胶体金偶联的鼠单抗被质控线上的驴抗鼠的二抗捕获从而使质控线显色。当加入偶联胶体金的羊抗鼠二抗时,被已经在检测线捕获的鼠单抗结合形成偶联物,从而进一步提高显色强度,有利于阳性结果的判断。
2.2 多克隆抗体和单克隆抗体配对
通过间接ELISA对抗体效价的检测得出:兔多抗的效价为100万[11],鼠单抗的效价为32万。说明单抗、多抗均具有较高的效价。由表1双抗夹心ELISA的配对实验可以看出:在捕获抗体稀释12800倍,检测抗体稀释5400倍时,仍具有较高的OD值(OD值>0.45)且阴性对照组OD值均小于0.1,说明购买的单抗与制备的兔多抗配对成功,可以用于制备胶体金试纸条。

图1 试纸条原理图Fig.1 Test-strip diagram
2.3 试纸条检测结果
偶联的胶体金放于4℃一周未发现死金现象,说明偶联的胶体金具有很好的稳定性。T、C线吸光度比值(T/C比值法)在一定程度上可有效地消除内在因素(环境温度、不同试纸条的加工差异、样品中基质效应)的干扰,实现试纸条的定量检测。
本实验实时记录了30m in内试纸条T线、C线的显色强度的变化,结果如图2所示,T线、C线吸光值25m in后进入稳定期(图2-A,图2-B),而T/C比值仅需15m in即可进入稳定(图2-C)。从图2可以看出,加入羊抗鼠二抗偶联的胶体金可明显的提高T线的显色强度,但对C线及T/C比值影响较小。

表1 多克隆抗体与单克隆抗体双抗夹心ELISA结果Table1 Resultof double-antibody sandwich ELISA
从图3对106CFU/m L的副溶血弧菌的检测实验可以看出:加入羊抗鼠二抗偶联的胶体金能将显色强度提高5倍,有利于肉眼进行观察,更准确的对阳性信号加以判断,同时由对照组(PBS组)可以看出加入羊抗鼠二抗偶联的胶体金不会产生非特异性的反应而引起假阳性,说明了该方法的可行性。因此下面的实验均采用该方法进行实验。

图2 胶体金试纸条免疫动力学曲线Fig.2 The immune kinetic reaction curve of colloidal gold test strip

图3 免疫层析试纸条检测结果Fig.3 Detection results of Vibrio parahemolyticusis by using the strip test
2.4 免疫层析试纸条灵敏性的检测
将80μL不同稀释度的副溶血弧菌纯培养物滴入加样孔中,待样品层析完毕后观察检测结果。如图4所示,用肉眼可以观测到检测限为106CFU/m L。

图4 不同浓度副溶血性弧纯培养菌胶体金免疫层析试纸条检测结果Fig.4 Detection results of the strip test for Vibrio parahemolyticusis samples at different concentrations
2.5 食品中试纸条灵敏度的检测
为了模拟实际样本的检测效果,验证在鱼肉糜样本的检测中,检测限是否会受到食品基质和杂菌的影响。本实验通过人工添加副溶血弧菌到含阪崎肠杆菌、志贺氏菌的鱼肉糜样本测定最低检出限。实验结果表明,在鱼肉糜样本的模拟检测中,最低检测限均为107CFU/g,如图5所示。比在纯培养物样本中的检测限要高(见图4),可能是由于鱼肉糜样本成分的复杂对检测限有一定的影响,但高浓度杂菌不影响该方法的特异性。

图5 鱼肉糜样品中副溶血弧菌胶体金免疫层析试纸条检测结果Fig.5 Detection results of the strip test for Vibrio parahemolyticusis in fish paste samples
2.6 试纸条特异性的检测
以副溶血弧菌(ATCC 17802)为阳性对照,材料中各菌的菌液分别取80μL用胶体金试纸条进行检测。结果如图6所示,副溶血弧菌不同菌株检测后试纸条的T、C线均显色,结果为阳性。各常见菌株及PBS空白组只有C线显色,结果为阴性,如表2所示。结果说明改进的胶体金试纸条能对不同的副溶血性弧菌检测成阳性结果,但对相近种属的霍乱弧菌及其他常见菌株均无交叉反应,表明该方法制备的胶体金试纸条较高的特异性。

表2 副溶血弧菌胶体金免疫层系试纸条特异性检测结果Table2 Specificity of the strip test in detection of Vibrio parahemolyticusis

图6 3株不同副溶血性弧菌胶体金免疫层析试纸条检测结果Fig.6 Detection results of the strip test for three different Vibrio parahemolyticusis
2.7 模拟实际样本的检出测定
模拟实际样本检测的结果在80个阳性样本中有79份显示阳性,检出率为98.7%,在阴性对照组中均未检出,说明该方法可用于实际样品的检测。
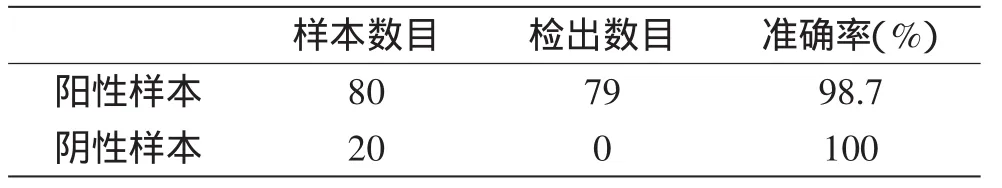
表3 模拟实际样本的检出测定Table3 Determination of actual sample
3 结论与讨论
免疫胶体金层析技术是继免疫荧光、酶免疫和放射免疫后发展的一种新技术,因具有操作简单,检测速度快,样品不需要特殊处理及不需借助复杂设备仅用肉眼就能判断结果等优点,特别适用于野外及实验条件不具备的场所使用[15],现已经在医学检测和诊断方面得到广泛应用[16]。
试纸条的灵敏度、特异性与所用的捕获抗体与检测抗体具有直接的关系,当抗体的特异性好时,实验结果具有较好的灵敏性与特异性。本实验所用的单抗较好的特异性相关,所以胶体金标记的单抗对常见的一些菌株均没有交叉反应的现象。在副溶血弧菌试纸条检测中,为了进一步提高检测的灵敏度,本研究在常规试纸条免疫反应的基础上,利用羊抗鼠的抗体能与鼠单抗特异性免疫结合,而与兔多抗不结合的原理,进行免疫试纸条的检测。当检测线上的兔多抗捕获到抗原抗体复合物时,即能与胶体金标记的羊抗鼠的二抗免疫结合,从而使更多的胶体金在检测线上得到聚集,提高了显色强度,有利于肉眼进行观察。当检测线上未捕获到鼠单抗时,即不能与胶体金标记的羊抗鼠的二抗免疫结合,因此不会改变试纸条的特异性。加入胶体金标记的羊抗鼠的二抗时,能明显的提高检测限的显色强度,方便了结果的判断。由于在周边超市所购买的鱼肉样本中副溶血弧菌均未检出,所以实验中采用添加菌到鱼肉糜样本中模拟实际样品。实验中检测模拟样品时出现1例假阴性可能的原因:温度的影响,温度过低反应速度降低,从而使弱阳性不能完全显示出来;灰尘、风的影响,灰尘落在试纸条上及风吹影响样品的扩散速度,导致结果不能正常观察。本实验中,在对纯培养物及鱼肉糜样本中的检测限分别为106CFU/m L和107CFU/g,且高浓度杂菌的存在不影响检测灵敏度和特异性。
实验结果表明,副溶血弧菌胶体金免疫层系试纸条具有较好的特异性及灵敏度,结合试纸条在15m in内就可以完成快速检测的优点,说明该试纸条比酶联免疫技术、PCR技术具有更广泛的适用范围,对常见细菌性食物中毒的初筛具有重要意义。
[1]林秋云,曾树权,尹映华,等.一起副溶血性弧菌引起食物中毒的实验室检测[J].中国微生态学杂志,2012,24(2):178-180.
[2]丁建华,周寿荣.一起副溶血弧菌引起的学生集体食物中毒[J].中国校医,2004,18(12):155-157.
[3]刘秀梅.食源性疾病监控技术的研究[J].中国食品卫生杂志,2004,16(1):3-9.
[4]Habib I,Sampers I,Uyttendaele M,et al.Performance characteristics and estimation of measurement uncertainty of three plating procedures for Campylobacter enumeration in chickenmeat[J].Food Microbiology,2008,25(1):65-74.
[5]Lehmann LE,Hunfeld K-P,Emrich T,et al.A multiplex real-time PCR assay for rapid detection and differentiation of 25 bacterial and fungal pathogens from whole blood samples[J].MedicalMicrobiology and Immunology,2008,197(3):313-324.
[6]Madi M,Hamilton A,Squirrell D,et al.Rapid detection of foot-and-mouth disease virus using a field-portable nucleic acid extraction and real-time PCR amplification platform[J].The Veterinary Journal,2012,193(1):67-72.
[7]郑晶,申洪.创伤弧菌溶细胞毒素及金属蛋白酶的基因克隆,蛋白表达,抗体制备及其致病性研究[D].广州:南方医科大学,2008.
[8]王谦.抗链霉素单克隆抗体制备与ELISA方法的建立[D].北京:中国农业大学,2003.
[9]Perosa F,Carbone R,Ferrone S,et al.Purification of human immunoglobulins by sequential precipitation with caprylic acid and ammonium sulphate[J].Journal of Immunological Methods,1990,128(1):9-16.
[10]张燕欣,赵云英,李富桂.应用辛酸硫酸铵法提纯兔抗鸡传染性法氏囊病IgG抗体[J].黑龙江畜牧兽医,2013(1):106-108.
[11]王报贵,武晓丽,董素琴,等.副溶血弧菌的磁珠捕获及检测[J].食品工业科技,2013,34(13):147-152.
[12]黄岭芳.快速检测大肠杆菌O157∶H7胶体金免疫层析方法的建立[D].南昌:南昌大学,2011.
[13]宋宏新,符海英,薛海燕,等.两种胶体金制备方法的比较研究[J].河南工业大学学报:自然科学版,2012,33(1):53-56.
[14]Banchongaksorn T,Hurtado A JC,Chauhan V,etal.A rapid dipstick antigen capture assay for the diagnosis of falciparum malaria[J].Bulletin of the World Health Organization,1996,74(1):47-54.
[15]王振东,姜超,杨宇,等.贝氏柯克斯体重组抗原P1表达纯化及胶体金免疫层析方法的建立[J].中国媒介生物学及控制杂志,2012,23(4):285-288.
[16]曾小军,陈红根,袁建华,等.快速胶体金免疫层析法的建立及其对血吸虫病的诊断效果[J].中国血吸虫病防治杂志,2005,17(1):24-27.
