麦芽蛋白与多酚相关指标对麦汁敏感蛋白和敏感多酚含量的影响
2014-02-21李天宇董建军余俊红胡淑敏黄树丽黄淑霞孙军勇
李天宇,董建军,余俊红,陆 健,刘 佳,胡淑敏,黄树丽,黄淑霞,尹 花,孙军勇
(1.江南大学粮食发酵工艺与技术国家工程实验室,江苏无锡214122; 2.青岛啤酒有限公司啤酒生物发酵工程国家重点实验室,山东青岛266061; 3.江南大学工业生物技术教育部重点实验室,江苏无锡214122; 4.江南大学生物工程学院,江苏无锡214122)
啤酒是一种稳定性不强的胶体溶液,易受到外界条件及本身成分的影响,导致其胶体平衡状态被破坏从而产生沉淀,使啤酒变混浊。而国家啤酒标准[1]将优级淡色啤酒的浊度值规定为小于0.9EBC。
国内外对啤酒胶体稳定性进行了多年的研究,Bam forth[2]和Chapon等[3]指出造成啤酒混浊的主要物质为敏感蛋白和敏感多酚,2mg/L含量敏感蛋白能造成啤酒1EBC浊度,王宝忠等[4]指出啤酒敏感蛋白含量同强化后啤酒浊度值具有强的正相关性。Asano[5]、Shewry[6]、Jones[7]和 Evens[8]等解释了麦汁和啤酒敏感蛋白主要来自麦芽,敏感多酚主要来自麦芽与酒花[2]。两者结合导致产生冷混浊以及永久性混浊[8]。Robinson等[9-10]从遗传学角度分析了影响不同品种麦芽敏感蛋白含量的差异,指出缺少合成硅胶吸附蛋白(Silica Eluent,SE)的麦芽品种其酿造的啤酒混浊形成能力较低。Evans等[8]采用多克隆抗体的方法,建立了啤酒敏感蛋白与麦芽蛋白间的联系。但是这些方法较复杂,不利于在实际生产中推广。
由于敏感蛋白和敏感多酚在不同麦芽中含量差异较大,会对生产过程中的胶体稳定性造成很大影响。因此从麦芽等原料源头上预测其对麦汁、啤酒胶体稳定性的影响,进而提前进行调控,对减少整个酿造过程胶体稳定性的波动,具有重要现实意义。
现阶段对于用麦芽相关指标评价胶体稳定性的研究还未见报道,本文首先分析了不同麦芽麦汁敏感蛋白及敏感多酚含量差异,并研究了两者同麦芽相关指标关系。其次,研究了不同麦芽的搭配比例对麦汁敏感蛋白和敏感多酚的影响,以期从胶体稳定性的角度,提出原料搭配的原则。
1 材料与方法
1.1 材料与仪器
麦芽 澳大利亚麦芽 Gairdner、Baudin及Vlamingh,加 拿 大 麦 芽 Metcalfe、Copeland、及PolarStar,国产麦芽垦七;酒花 青岛大花;大米 江苏英盛米业粳米;单宁酸、PVP吸附剂 Sigma公司; α-淀粉酶、Folin-Ciocalteu(FC)试剂、Na2CO3、没食子酸、溴甲酚绿、硼酸、硫酸铵、重铬酸钾 上海生物工程试剂公司;单宁酸溶液 取0.1000g单宁,用超纯水定容至1L,充分混匀;PVP溶液 取0.4000g PVP,用超纯水定容至1L,充分混匀。
高速离心机 美国 Sigma公司;LB-8糖化仪 德国Lochner公司;紫外分光光度计 美国GE公司;EBC粉碎仪 德国Buhler公司;单宁分析仪 德国Pfeuffer公司;浊度计 瑞典Sigrist公司。
1.2 实验方法
1.2.1 麦芽指标的测定 麦芽总酚的提取[11]:使用EBC粉碎仪充分粉碎麦芽,称取1g麦芽粉加入到10m L 80%(V/V)的丙酮中,超声处理(40kHz,120W)1h后,10000×g离心10m in,上清即为麦芽总酚提取液。提取液于-20℃避光保存,在 24h内使用。
麦芽总酚的测定采用FC法[12]:取0.5m L的样品,加入到2.5m L的Folin-Ciocalteu试剂(10倍稀释)中反应5m in,随后加入2m L 7.5%Na2CO3,并用去离子水定容至10m L。室温保温1h,在760nm波长下测定吸光值。
麦芽总氮、可溶性氮、库尔巴哈值测定参照QBT 1686-2008[13]。
1.2.2 麦汁制备工艺 糖化工艺参考实际生产工艺,具体步骤如下。糊化:取粳米粉32g,依次加入0.075g CaSO4,100m L蒸馏水(60℃),10μL淀粉酶。糖化:取 56.50g麦芽粉,依次加入 0.075g CaSO4,230m L蒸馏水(50℃),15μL乳酸。采用的工艺曲线见图1。糖化醪液用双层滤纸过滤,并加入150m L保温蒸馏水进行洗糟。在滤后麦汁中依次加入0.320g酒花,25μL乳酸,并在102℃煮沸60m in,煮沸结束后冷却至室温,使用双层滤纸过滤,滤后麦汁用于下一步分析。
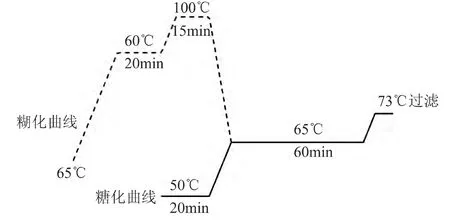
图1 工艺曲线Fig.1 Craft curve
1.2.3 麦汁敏感蛋白及敏感多酚的测定 采用单宁分析仪测定[14]。
1.2.4 麦汁浊度的测定 采用浊度计进行测定。
1.2.5 麦芽搭配 不同品种麦芽粉碎后,将两个品种的麦芽粉分别按重量比0∶10、1∶9、3∶7、5∶5、7∶3、9∶1、10∶0搭配混匀,按照1.2.1糖化制备麦汁。
2 结果与分析
2.1 麦芽指标与麦汁敏感蛋白、敏感多酚的关系
2.1.1 麦芽相关指标分析 为研究麦芽指标与麦汁敏感蛋白和敏感多酚的关系,选择加麦(Copeland、Metcalfe、PolarStar)、澳 麦 (Gairdner、Baudin、V lam ingh)及国麦垦七等7个品种的麦芽共30个样品按1.2.2糖化工艺制备麦汁,并分析麦芽自身指标与麦汁敏感蛋白和敏感多酚含量的关系。选择与蛋白和多酚相关的麦芽指标:总氮、总酚、可溶氮及库值进行了分析。总氮是衡量麦芽蛋白含量的重要指标,其差异会对麦汁中蛋白含量造成影响,如表1所示,30个麦芽样品中总氮含量分布范围为1.36~1.93g/100g,其中澳麦Gairdner、Baudin的总氮含量要低于加麦Metcalfe、Copeland中的含量,这表明不同产区的不同麦芽品种其氮含量会有一定差异,而这可能与产区气候以及不同品种的遗传信息差异有关。总酚作为评价麦芽多酚含量的重要指标,其含量差异对麦汁多酚含量具有重要影响,30个麦芽样品总酚含量分布范围为2.30~3.11mg/g。麦芽蛋白的溶解程度对麦汁中氮的含量具有重要影响,因此可溶性氮及库值与麦汁氮含量紧密相关,30个麦芽样品可溶性氮含量分布范围为0.63~0.88g/100g,库值分布范围为39%~49%,由于两者的含量受大麦品种及制麦工艺的影响较大,因此不同麦芽样品间表现出了较大的差异。30个麦芽样品的四个指标差异显著,说明不同品种间大麦及不同工艺制得的麦芽,其蛋白和多酚含量确实差异显著。这种显著性的差异可能是由于大麦自身遗传信息的差异或制麦过程中蛋白酶以及酚类酶活性的不同造成的[7,15-16]。
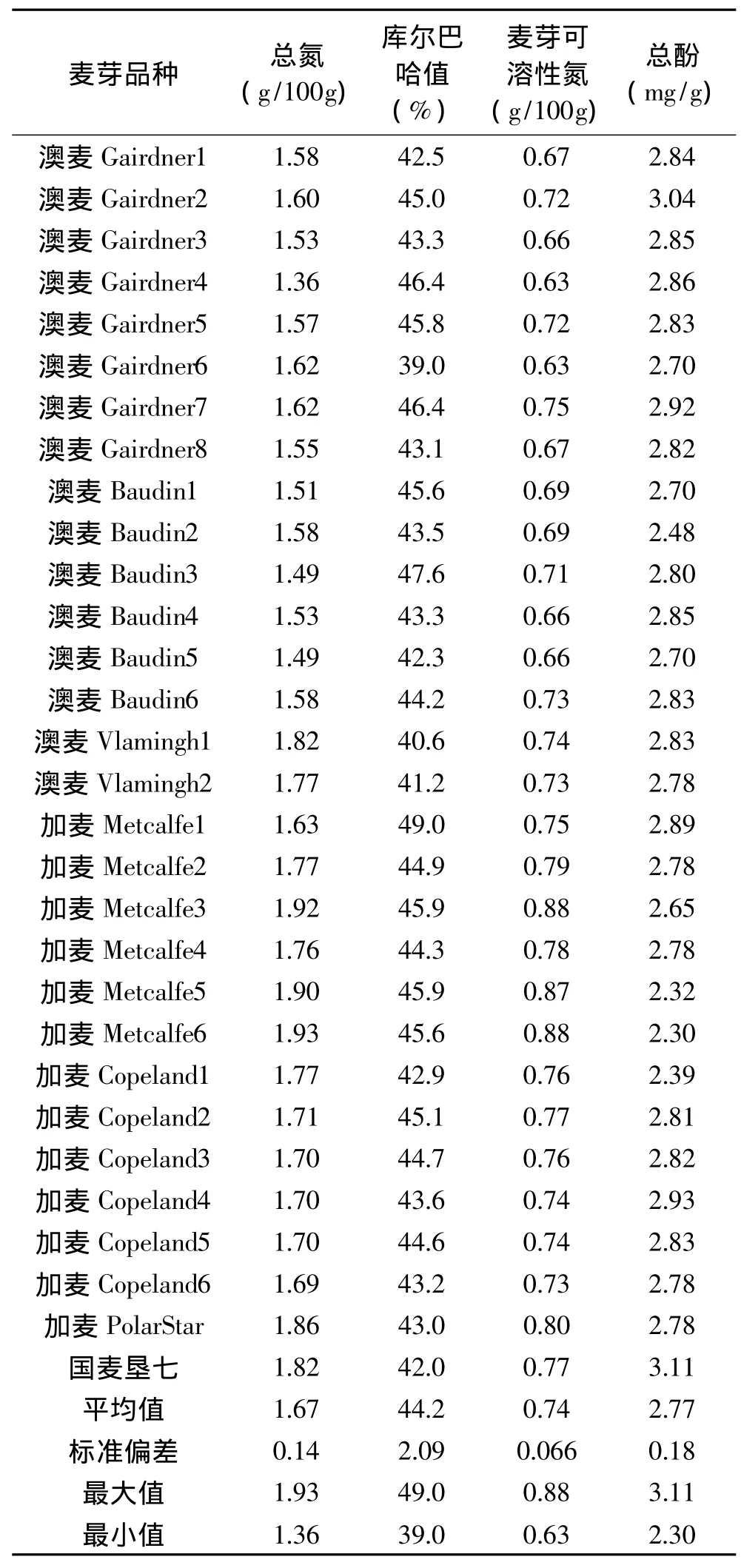
表1 麦芽相关指标含量Table1 The content of related indexes ofmalts
2.1.2 麦汁敏感蛋白和敏感多酚含量分析 采用1.2.2糖化工艺制备麦汁,分析麦汁的敏感蛋白及敏感多酚含量差异。结果如表2所示,麦汁敏感蛋白含量分布范围为7.79~14.16EBC,敏感多酚分布范围为23.2~57.5mg PVP/L,麦汁起始浊度值分布范围为0.60~5.41EBC。其中澳麦Gairdner及Baudin敏感蛋白含量明显低于加麦Metcalfe,而澳麦Gairdner的敏感多酚含量明显处于较高水平,麦芽品种间的差异可能跟不同品种大麦自身遗传信息不同有关,缺少合成硅胶吸附蛋白(SE)的品种其敏感蛋白的含量较低[9-10]。同一品种不同批次麦芽所制备的麦汁其敏感蛋白和敏感多酚含量也存在差异。这可能与大麦的收获季节、产地、储藏时间[16]以及不同麦芽厂使用的制麦工艺不同有关[17],研究中选用的一些麦芽样品分别来自于春季和秋季的大麦样品,由不同麦芽生产厂提供(如澳麦Gairdner和加麦Metcalfe)。这些差异均能反映到麦芽相关指标上。

表2 不同麦芽麦汁样敏感蛋白与敏感多酚的含量Table2 Content of sensitive protein and sensitive polyphenol in differentworts
2.1.3 麦汁敏感蛋白、敏感多酚同麦芽指标的关系 将麦汁敏感蛋白和敏感多酚与麦芽指标进行相关性分析。结果如表3,麦汁敏感蛋白与麦芽总氮(r=688,p<0.01)、可溶性氮(r=0.686,p<0.01)存在显著正相关。这可能是由于敏感蛋白是麦芽中醇溶性储藏蛋白溶解产生的[18],而蛋白的溶解程度与麦芽的可溶性氮相互关联,从而决定了麦汁敏感蛋白与麦芽可溶性氮呈现相关性。另外,由于麦汁中敏感蛋白主要由麦芽蛋白的溶解产生,可溶性蛋白或多肽,因此麦芽可溶性氮更能特定反应麦汁敏感蛋白含量。进一步的数据分析表明,当可溶性氮含量低于0.70g/100g左右时,其对应的麦汁敏感蛋白含量低于9EBC。比较麦汁敏感多酚含量与麦芽总酚含量间的关系发现,麦汁敏感多酚含量与麦芽总酚具有较强相关性(r=0.646,p<0.01)。敏感多酚主要来源于麦芽和酒花,其中70%的麦芽多酚都在麦汁中保留下来,而酒花的添加量较少,且大部分浸出的敏感多酚在煮沸过程被除去[2],所以麦汁敏感多酚含量与麦芽多酚表现为典型正相关性。但麦汁中敏感蛋白与敏感多酚的含量与麦汁的初始浊度值并没有表现出较强的相关性,这可能是由于麦汁浊度是多种物质含量综合作用的结果,麦汁浊度不仅与麦汁中敏感蛋白、敏感多酚含量相关而且与麦汁中大分子的多糖、糊精等相关,并且麦汁的糖组分含量以及粘度值远大于啤酒,这都会对麦汁浊度造成影响。另外,敏感蛋白与敏感多酚作为潜在的形成混浊的物质与麦汁的初始浊度值也可能没有存在必然的联系。
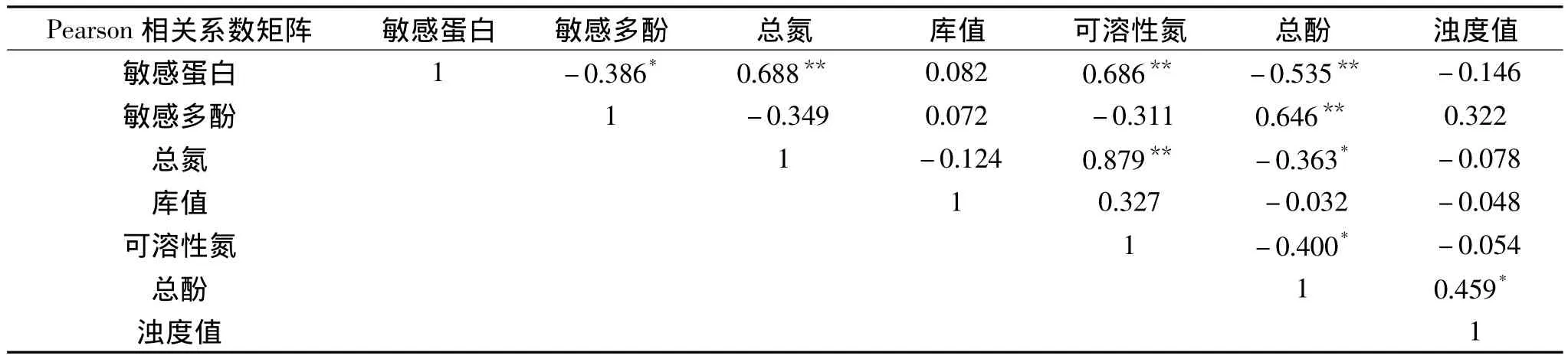
表3 麦芽和麦汁各指标间的相关性分析Table3 The correlationship between indexes ofmalts and itswort
综上可知,麦芽可溶性氮及总酚指标可以初步评价麦汁敏感蛋白、敏感多酚的含量,为从原料的角度控制胶体稳定性的研究提供了数据依据。
2.2 麦芽搭配比例对麦汁敏感蛋白和敏感多酚含量的影响
选择可溶性氮、总酚差异较大的加麦Metcalfe、澳麦Gairdner和国麦垦七(如表4),将麦芽Metcalfe分别与澳麦Gairdner、国麦垦七按照不同比例搭配采用1.2.2麦汁制备工艺制备相应的麦汁。

表4 实验麦芽指标Table4 Themalt index used formalt blending
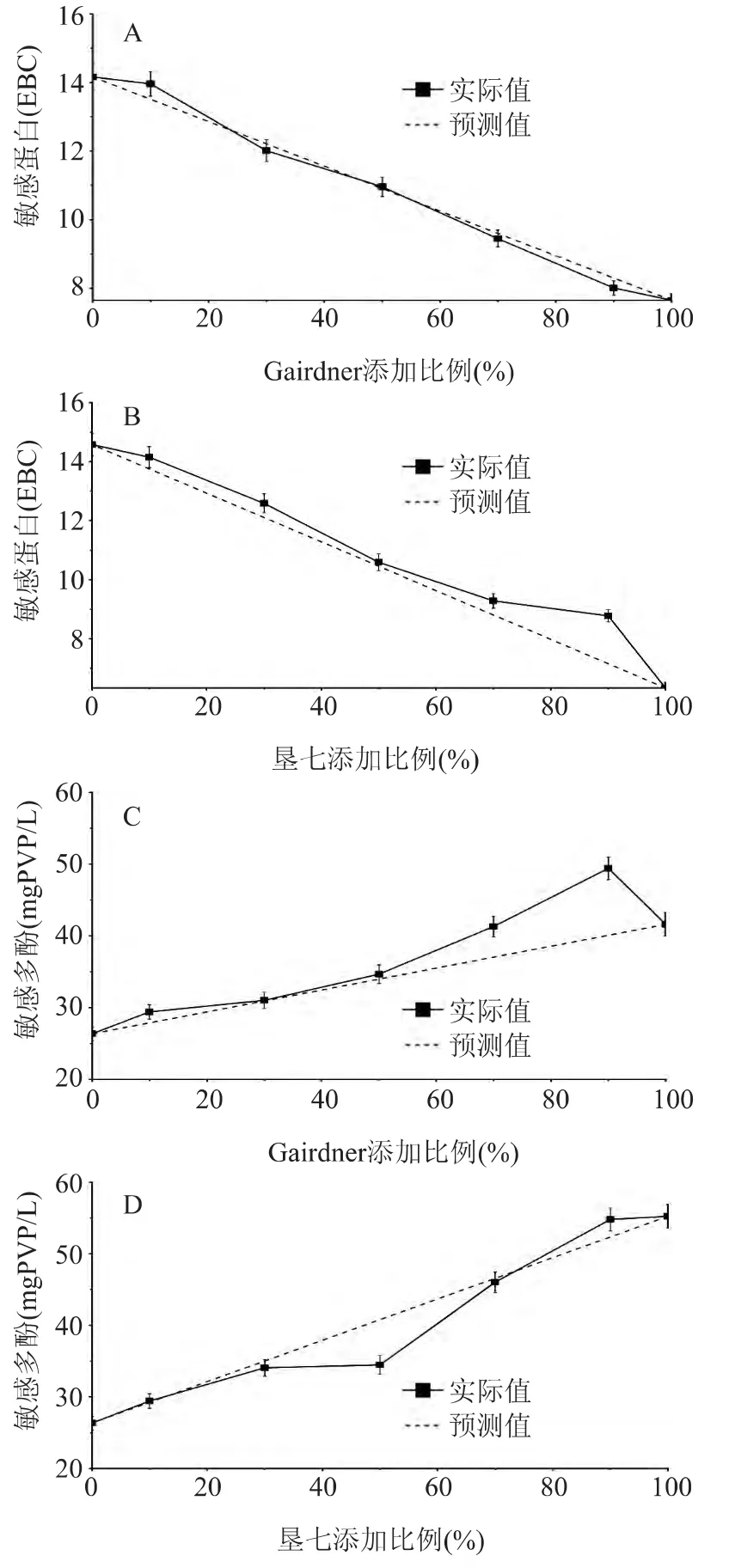
图2 不同麦芽搭配比例对麦汁敏感蛋白和敏感多酚含量的影响Fig.2 Effect ofmalt blending on content of sensitive protein and sensitive polyphenol ofwort
分析搭配后制备麦汁的敏感蛋白发现,麦汁敏感蛋白的理论预测值与实际值符合的很好,说明麦芽搭配时,不同品种的麦芽的蛋白溶解没有表现出协同或拮抗作用。因此在实际生产中,当预测到麦汁的敏感蛋白过高时,可以通过搭配可溶性氮含量较低的麦芽来调控麦汁的敏感蛋白。
敏感多酚的结果如图2(C和D),将加麦Metcalfe与澳麦Gairdner麦芽搭配时发现,除搭配比例为90%(加麦Metcalfe∶澳麦Gairdner=9∶1)以外,其它比例下的搭配实际值均与预测值符合的较好。加麦Metcalfe和国麦垦七搭配时,除在比例50%(加麦Metcalfe∶国麦垦七=5∶5)时实际值低于预测值,其它比例搭配时实际值也均与预测值相符。这表明敏感多酚受到的影响因素较为复杂,一方面由于敏感多酚易受外界氧、pH的影响[19],会造成含量上的波动;另一方面敏感多酚是一类易被氧化的中低聚体原花青素,占总酚的含量较低(仅占总酚3.3%)[19],在煮沸过程中大量与蛋白结合形成沉淀,沉淀量与酚的氧化水平紧密相关[20],这都会造成其含量上的波动。
3 结论与讨论
本研究发现在相同的糖化工艺下,不同麦芽制备麦汁的敏感蛋白和敏感多酚同麦芽自身的可溶性氮和总酚密切相关,可以用这两个指标初步评价或预测麦汁敏感蛋白及敏感多酚的含量。进而可以有针对性的选择麦芽样品用于麦汁制备,来保证麦汁中敏感蛋白及敏感多酚含量处于合理水平。另外,当生产使用的麦芽中可溶性氮和总酚含量较高时,也可有针对性选择的两者含量较低的麦芽按照质量比例搭配制备麦汁,进而来保证麦汁中的敏感蛋白与敏感多酚处于合理水平。
啤酒的胶体稳定性研究是一个复杂而长期的过程,之前的研究重点集中于成品啤酒和下游处理工艺的研究。对于原料同麦汁和啤酒的胶体稳定性的对应关系研究相对较少。但影响胶体稳定性的主要因素敏感蛋白、敏感多酚主要来源于原料麦芽,从源头的控制尤为重要。
[1]郭新光,张五九,方贵权,等.GB4927-2008啤酒[S].北京:中国标准出版社,2009
[2]Bamforth CW.Beer haze[J].Journal of the American Society of Brewing Chemists,1999,57:81-90.
[3]Chapon L.The mechanics of beer stabilization[J].Brewers’Guaidian,1994,123:46-50
[4]王宝忠.啤酒非生物稳定性控制体系的研究[D].呼和浩特:内蒙古农业大学,2012
[5]Asano K.Characterization of haze-forming proteins of beer and their role in chill haze formation[J].J Am Soc Brew Chem,1982,40:147-154.
[6]Shewry P R.Barley seed proteins[J].American Society ofCereal Chemists,1993:131-197
[7]Jones B L,Budde A D.How various malt endoproteinase classes affect wort soluble protein levels[J].Journal of Cereal Science,2005,41(1):95-106.
[8]Evans D E,Robinson L H,Sheehan M C,et al.Application of immunologicalmethods to differentiate between foam-positive and haze-active proteins originating from malt[J].J Am Soc Brew Chem,2003,61(2):55-62.
[9]Doner L W,Becard G,Irwin P L.Binding of flavonoids by polyvinyl-polygyrrolidone[J].Journal of Agricultural and Food Chemistry,1993,41:753-757.
[10]Robinson L H,Juttner J,Milligan A,et al.The identification of a barley haze active protein that influences beer haze stability: Cloning and characterisation of the barley SE protein as a barley trypsin inhibitor of the chloroform/methanol type[J].Journal of Cereal Science,2007,45(3):343-352.
[11]Zhao H F,Fan W,Dong J J,et al.Evaluation of antioxidant activities and total phenolic contents of typical malting barley varieties[J].Food Chemistry,2008,107(1):296-304.
[12]Singletion V L,Joseph A,Rossi J.Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents[J].Am JEnol Vitic,1965,16(3):144-158.
[13]张五九,康永璞,熊晓帆,等.QBT 1686-2008啤酒麦芽[S].北京:中国轻工业出版社,2008.
[14]Chapon L.Nephelometry as a method for studying the relations between polyphenols and protein[J].J Inst brew,1993,99:49-56.
[15]孔维宝,樊伟,陆健,等.麦芽制造过程中酚类物质及其相关酶类的变化[J].食品与生物技术学报,2007,26(5): 61-65.
[16]Qi J C,Chen J X,Wang J M,et al.Protein and hordein fraction content in barley seeds as affected by sowing date and their relations tomalting quality[J].Journal of Zhejiang University Science,2005,6B(11):1069-1075.
[17]Moll M.Colloidal stability of beer.In:Brewing Science[M].Academic Press,1987:1-327.
[18]Zhang G,Chen J,Wang J,et al.Cultivar and Environmental Effects on(1→3,1→4)-β-D-Glucan and Protein Content in Malting Barley[J].Journal of Cereal Science,2001,34(3): 295-301.
[19]Osman A M.Barley and malt proteins and proteinases:III.A simple method for estimating the combined actions of malt proteinases and the extent of protein degradation during malting[J].J Inst brew,2003,109(2):150-153.
[20]Mcmurrough I,Baert T.Identification of proanthocyanidins in beer and their direct measurement with a duel electrode electrochemical detector[J].J Inst brew,1994,100:409-416.
