基质金属蛋白酶-9在声带息肉中的表达
2014-02-20宁金梅赵树波刘德华杨明早
宁金梅,吴 平,赵树波,刘德华,杨明早,朱 媛,孙 勇
(1.曲靖市第一人民医院 耳鼻咽喉科,云南 曲靖 655000;2.昆明医科大学第二附属医院 耳鼻喉科,云南 昆明 650101)
近年来随着生活水平的提高,嗓音疾病渐渐被人重视。声带息肉是临床上的常见病及多发病,多见于成人,男女均可发病,是引起声音嘶哑的常见原因之一。常发生于一侧声带前、中三分之一交界处的边缘,有蒂或广基,也可双侧均发生。随着社会交流的增多,环境污染问题的加剧,其发病率有明显上升趋势,直接影响人们的生理和心理健康。声带的结构分为鳞状上皮层、固有层浅层、固有层中层、固有层深层和声带肌层五层。任克氏间隙(Reinke'sspace)是位于声带上皮下与声韧带之间的一个柔软的、含有无定形物质的潜在间隙,其形态和张力决定了声带的振动特点,是一个具有高度特异性的结缔组织屏障,全层几乎没有淋巴引流,主要为细胞外基质(extracellular matrix,ECM)和成纤维细胞(fibroblast,Fb),是声带息肉的好发部位。声带息肉的发病原因有以下学说:⑴吸烟;⑵循环障碍学说;⑶炎症学说;⑷机械创伤学说;⑸内分泌紊乱;⑹变态反应。另外,近年来临床研究发现特殊类型的声带息肉与胃食管反流发生有着密切关系,胃食管反流的反流物含有不同成分,其中胃酸和胃蛋白酶是损伤咽喉粘膜的主要成分,长期刺激咽喉组织,引起声带弥漫性充血水肿,严重时出现声带小结、声带息肉。导致声带息肉的形成可能是多方面因素共同作用的结果,而其中某一方面起主导作用。但是什么因素作用导致声带结构的改变,生成息肉,并不是十分清楚。
MMP-9能有效降解明胶和基膜的主要成分Ⅳ,Ⅴ,Ⅶ,Ⅹ型胶原,其高表达可导致细胞外基质和血管基底膜降解加速,在多种炎症性和肿瘤性疾病致病过程中发挥重要作用。研究发现MMP9的基质降解作用比MMP2高出近25倍,MMP9在粘膜内胃癌转移中的作用比MMP2更强[1-4]。目前已证实,高表达的MMP-9与肿瘤血管生成、细胞增殖、凋亡抑制、细胞免疫抑制等都有十分密切的关系,所以研究声带息肉中MMP-9的表达也许可以为研究声带息肉的发生机制提供一些线索。
材料与方法
一、临床资料 实验组:选择近年声带息肉患者标本35例,其中男性22例,女性13例,年龄24-62岁,平均年龄为41岁,病程1月至8年,均经病理诊断确诊,且排除其他声带病变。所有患者均为初次手术。对照组:正常声带组织标本18例(因非喉部疾病死亡24-48h内的尸体标本,或病理科保存的正常声带组织标本蜡块)。
二、试验方法:2组标本经10%甲醛固定,石蜡包埋,作4μm厚的连续切片,HE染色,选取标本中细胞成分多的部位作切片进行免疫组织化学染色。
三、结果判断 阳性判断标准:与迈新公司的阳性对照片中阳性细胞相比。相同或比其深者为阳性,比其弱或没有染色者为阴性。MMP-9以细胞浆出现黄色为阳性细胞,将每张切片着色强度与着色细胞数量进行分级。阳性细胞计数:0~5%为差,6%~15%为±,16%~25%为+,26%~50%为++,>50%为+++。阳性细胞表达强度:差无着色或染色与迈新公司的阳性对照片中阳性细胞相比比其弱,+黄色,++棕黄色,+++棕色。
四、图像定量分析 应用Nikon Eclipse 50i计算机图像分析仪,在400倍镜下对行MMP-9染色的切片每张随机选取3个视野的上皮细胞和相邻的细胞间质。因声带息肉病理组织学变化多样,为增加研究的可比性,在MMP-9的连续切片中,选取的视野相同。用Nikon Mivnt显微图像分析软件(WindowsXP版),每个视野随机圈定3个阳性单位(3个阳性细胞的细胞质),测定这3个阳性单位均值代表该视野的阳性单位均值。用阳性单位均值表示被染色物质的多少,阳性单位均值越大,说明物质的相对含量越高,即抗原物质表达的水平越高,反之亦然。
结 果
一、免疫组化观察结果 MMP-9在正常声带组中,阳性反应主要位于炎性细胞、成纤维细胞和上皮细胞。不同的标本中各种细胞的表达可不一样,常以某一种细胞的表达为主,表达计数大多为+,强度多为+~++。也表达于血管内皮细胞、横纹肌和软骨细胞见图1。在声带息肉组中,几乎所有切片上皮细胞、成纤维细胞、炎性细胞、和血管内皮细胞都明显表达MMP-9。在上皮细胞的表达:计数和表达强度均在+~++之间;在成纤维细胞的表达:计数大多为+~+++,表达强度大多为++;在炎性细胞的表达:计数多为+~+++,表达强度大多为++;在血管内皮细胞的表达:计数多为+~+++,表达强度大多为++见图2-5。
二、统计结果 正常声带和声带息肉组间MMP-9阳性单位均值比较有统计学差异见附表,声带息肉组阳性单位均值(42.9661±9.8012)高于正常声带组(16.6147±8.4834)。

图1 MMP-9在正常声带组织固有层中的表达,主要着色于纤维细胞和炎性细胞(免疫组化MaxVision TM法,×200)
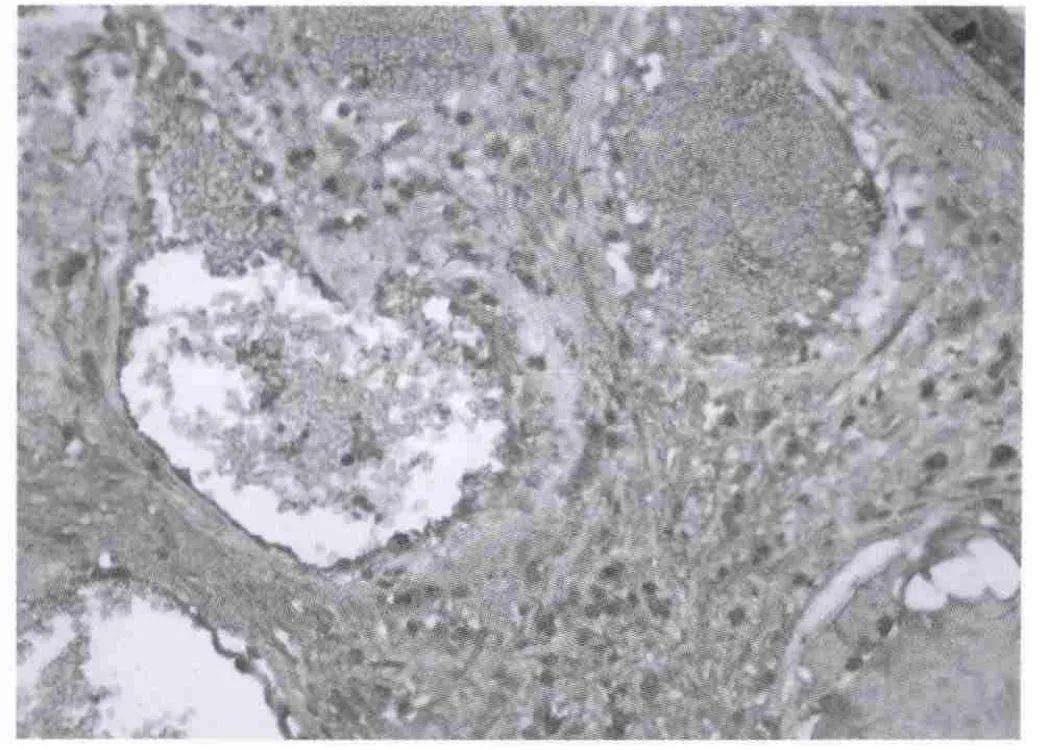
图2 MMP-9在声带息肉组织中的表达,主要着色于炎性细胞和血管内皮细胞(免疫组化MaxVisionTM×200)
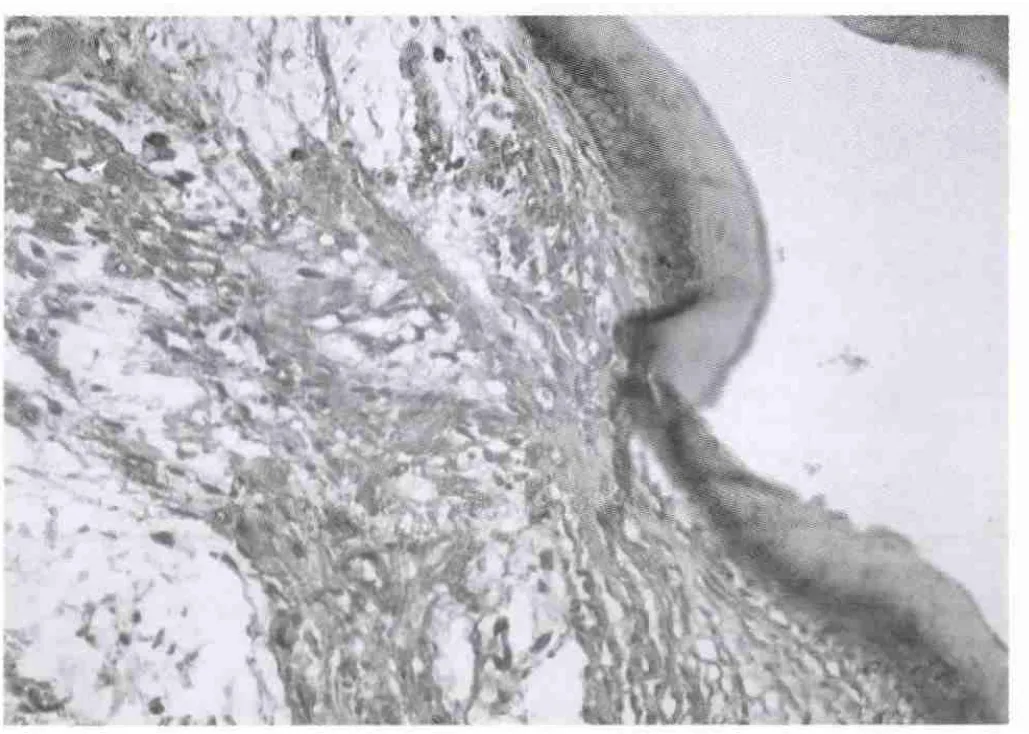
图3 MMP-9在声带息肉组织中的表达,主要着色于上皮细胞和纤维细胞(免疫组化MaxVisionTM法,×200)

图4 MMP-9在声带息肉组织中的表达,主要着色于纤维结缔组织和血管壁(免疫组化MaxVisionTM法,×400)

图5 MMP-9在声带息肉组织中的表达,主要着色于血管内皮细胞(免疫组化MaxVisionTM法,×200)
讨 论
本文在光镜下观察到,声带息肉组中多数息肉被覆鳞状上皮不同程度增生,表面可见轻到中度角化或角化过度。部分病例棘细胞水样变性。间质可见,结构疏松,不同程度水肿,炎性细胞浸润,毛细血管密集、扩张、充血,含铁血黄素沉着,纤维细胞增生,玻璃样变性等。以上改变可以某种为主或共同存在。固有层结缔组织排列紊乱,层状结构消失,可见少量腺体增生。炎性细胞数量较正常声带组织多。这也说明声带息肉的形成过程中存在着炎症反应。

附表 正常声带和声带息肉MMP-9阳性单位均值比较
已进行了大量关于MMPs在生理和病理情况下组织重塑方面生物学行为的研究,MMPs能降解细胞外基质、基底膜和其它蛋白,同时降低细胞免疫力。Malinsky等[5]研究发现:MMP-2 and MMP-9在鼻息肉中的表达显著高于对照组(中鼻甲);慢性鼻窦炎合并鼻息肉的患者中,MMP-2 and MMP-9 mRNA基因的表达显著高于对照组。Yigit等[6]研究得出结论:鼻息肉的严重程度主要与MMP-2/TIMP-1 增 加 有 关 ,其 次 是MMP-9/TIMP-1。因此,对于鼻息肉病人,选择性抑制MMP-2或MMP-9,活化TIMP-1可能是一种新的治疗方案。Yeo等[7]研究报告:MMP-9在鼻息肉中的表达高于对照组(下鼻甲粘膜),在复发性鼻息肉中的表达也显著高于鼻息肉组,特别是在基质中的表达。由此得出结论,MMP-9可能与鼻息肉的复发有关。Wang等[8]研究得出结论:不被TIMP-1抑制的MMP-9 mRNA的显著上调,促进了经呼吸道感染病毒的蛋白水解活动,这可能使慢性鼻窦炎合并鼻息肉患者的病变进一步进展。国外学者Karahan等[9]在声带息肉的研究中显示:和正常声带相比,MMP-2,MMP-9在声带息肉间质梭形细胞和血管壁的表达显著增强。在我们的实验中,MMP-9在正常声带和声带息肉中均呈程度不一的阳性反应。在正常声带中,MMP-9阳性反应主要位于炎性细胞、成纤维细胞和上皮细胞,不同的标本中各种细胞的表达可不一样,常以某一种细胞的表达为主。几乎所有声带息肉切片上皮细胞、成纤维细胞、炎性细胞、和血管内皮细胞都明显表达MMP-9。声带息肉组MMP-9染色较正常声带组深,经图像定量分析,正常声带和声带息肉组间MMP-9阳性单位均值比较均有统计学差异,声带息肉组MMP-9阳性单位均值(42.9661±9.8012),高于正常声带组(16.6147±8.4834)。
[1]LIG,ZHANGY,QIANY,et al.Interleukin-17A promotes rheumatoid arthritis synoviocytes migration and invasion under hypoxia by increasing MMP2 and MMP9 expression through NF-κB/HIF-1α pathway[J].Mol Immunol,2013,53(3):227-236.
[2]MALIAV,WAGH UV,HEGDEMV,et al.In vitro antimetatic activity of enterolactone,a mammalian lignan derived from flax lignan,and down-regulation of matrix metalloproteinases in MCF-7 and MDA MB 231 cell lines[J].Indian JCancer,2012,49(1):181-187.
[3]MISHRA A,SRIVASTAVA A,MITTAL T,et al.Association of matrix metalloproteinases(MMP2,MMP7 and MMP9)genetic variants with left ventricular dysfunction in coronary artery disease patients[J].Clin Chim Acta,2012,413(19-20):1668-1674.
[4]APOSTOLIDOUE,PARASKEVA E,GOURGOULIANISK,et al.Matrix metalloproteinases2 and 9 increase permeability of sheep pleurain vitro[J].BMCPhysiol,2012,12:2.
[5]MALINSKY RR,VALERA FC,CAVALLARIFE,et al.Matrix metalloproteinases and their impact on sinusal extension in chronic rhinosinusitis with nasal polyps[J].Eur Arch Otorhinolaryngol,2013,270(4):1345-1348.
[6]YIGITO,ACIOGLUE,GELISGENR,et al.Theeffect of corticosteroid on metalloproteinase levels of nasal polyposis[J].Laryngoscope,2011,121(3):667-673.
[7]YEONK,EOMDW,OH MY,et al.Expression of matrix metalloproteinase 2 and 9 and tissue inhibitor of metalloproteinase1 in nonrecurrent vsrecurrent nasal polyps[J].Ann Allergy Asthma Immunol,2013,111(3):205-210.
[8]WANGJY,WATANABES,MATSUKURA S,et al.Effects of double-stranded RNA poly(I:C)on matrix metalloproteinase mRNA expression in human nasal polyp epithelial cells[J].Zhonghua Er Bi Yan Hou Tou Jing Wai Ke Za Zhi,2010,45(3):229-232.
[9]KARAHANN,BASPINARS,YARIKTASM,et al.Matrix Metalloproteinases(MMP-2 and MMP-9)and cyclooxygenase-2(COX-2)expressions in vocal fold polyps[J].J Voice,2009,23(1):29-33.