多糖凝胶的孔径和化学结构对单壁碳纳米管流动性和选择性分离的影响
2014-02-18檀付瑞金赫华李红波刘春华李清文
杨 鹏 檀付瑞 张 静 金赫华 李红波,* 刘春华,* 李清文
(1合肥工业大学化学工程学院,合肥230009;2中国科学院苏州纳米技术与纳米仿生研究所,江苏苏州215123)
1 引言
单壁碳纳米管(SWCNTs)是一种独特的分子级一维纳米材料,可以看作是石墨烯绕中心轴沿着卷曲矢量卷曲而成的无缝空心管.SWCNTs的直径和螺旋形等结构特征可由手性矢量(Ch)唯一确定,手性矢量用Ch=na1+ma2(n,m)的形式来表示,其中a1和a2为石墨烯层六角网格的基矢,n和m均是整数,不同的卷曲角度和曲率,即(n,m)决定了SWCNTs的不同性质.1根据电子能带计算结果,具有不同卷曲结构的SWCNTs按照导电属性的不同可分为半导体型(s)-SWCNTs和金属型(m)-SWCNTs两大类.2m-SWCNTs具有优良的导电性能,是理想的导线和电极材料.3而s-SWCNTs具有优异的电子迁移率,在传感器、电子器件、场效应晶体管(FETs)等方面有着良好的应用前景.4-6但是目前通过常规生长方法只能够制备两种不同导电属性的混合物,这将极大地阻碍它们在高端科技领域的应用,如何得到高效的m/s分离对SWCNTs在电子及光电器件等领域的应用是极其重要的.
凝胶柱色谱法被广泛应用于分离各种小分子天然有机化合物和蛋白质核酸等生物高分子.7,8而SWCNTs可以看作是碳的高分子形式,它的结构与脱氧核糖核酸(DNA)有许多相似之处,比如直径小于2 nm,长度都在几百纳米到几微米范围内.从生物分离中得到了启发,凝胶柱色谱法被创造性地应用于SWCNTs的分离.李红波等9也阐述了这种操作简单、成本低、分离效果好的分离技术引起了大家广泛关注,并且有望成为大规模工业化生产的有效方法之一.在2006年,Arnold10和Heller11等使用Sephacryl S500凝胶色谱柱,将1%胆酸钠(SC)水溶液分散的SWCNTs进行淋洗,可得到不同长度和直径的碳管.2009年,Moshammer等12通过改变SWCNTs的表面特性和凝胶的孔径(Sephacryl S200),获得了m/s分离的SWCNTs.与此同时,Kataura等13,14用琼脂糖凝胶(Sepharose 2B),获得了高纯的m-和s-SWCNTs.最近,Kataura课题组15和我们课题组16利用小孔径的Sephacryl凝胶,分别利用分散液连续淋洗或者用二元表面活性剂梯度淋洗的方法,获得了窄直径分布和单一手性的SWCNTs.
凝胶柱色谱法是根据目标物质具有不同的尺寸和形状或者是根据物质与多孔填料之间的作用力不同实现分离的,这两种途径都可控制目标物质通过多孔凝胶柱的方式和保留行为.因此,多糖凝胶的孔径尺寸范围和化学结构将很大程度影响有机化合物和大分子的流动和分离.17凝胶色谱法是分离一维纳米材料的一种新途径,13,14到目前为止很少人注意SWCNTs的流动性依赖于凝胶的性能.在这篇文章中,重点研究了凝胶孔径尺寸和化学结构对m-和s-SWCNTs在多糖凝胶中的流动和保留行为和对m-/s-SWCNTs分离的影响,进而阐述了实现高选择性和高纯度m-/s-SWCNTs分离的关键因素.
2 实验部分
2.1 试剂与仪器
采用纯化后的HiPCO SWCNTs(Lot No.P0276,Carbon Nanotechnologies Inc.,TX),十二烷基硫酸钠(SDS,纯度99%,Sigma-Aldrich公司)作为分散剂,SDS和脱氧胆酸盐(DOC,纯度99%,Sigma-Aldrich公司)分别被用于淋洗m-和s-SWCNTs.葡聚糖凝胶(Sephacryl S100,S300,S500,GE Health公司);葡聚糖(Sephadex G100,Sigma公司);交联琼脂糖凝胶(Sepharose 2B,Sigma公司);交联琼脂糖和葡聚糖的共聚凝胶(Superdex 200,GE Health公司)六种糖基凝胶用作填料.柱色谱内径为1 cm,所有溶液均用二次去离子水配制.超声分散和表征设备:超声波细胞破碎仪(XL 2000,美国Misonix公司),多功能台式高速离心机(Allegra X 22R,美国BECKMANCOULTER有限公司),紫外-可见-近红外(UV-Vis-NIR)分光光度计(Lambda 950,美国PerkinElmer公司),紫外-可见-分光光度计(Lambda 25,美国Per-kin Elmer公司),场发射电子显微镜(FESEM)(Quanta 400 FEG).
2.2 单壁碳纳米管的分散和分离
准确称取1.2 mg SWCNTs放入玻璃样品瓶中,随后加入4 mL质量分数为1%的SDS水溶液,配成0.3 mg∙mL-1SWCNTs溶液,用超声波细胞破碎仪在4 W功率条件下超声2 h后,在20 kg离心力下离心6 h,吸取上层清液用于分离.分别取Sephacryl S100,Sephacryl S300,Sephacryl S500,Sephadex G100,Sepharose 2B和Superdex 200凝胶若干毫升,用去离子水抽滤洗涤5次除掉乙醇后填入六根色谱柱中,使凝胶在柱内自然沉降一段时间,凝固后的凝胶在色谱柱内高度均为7 cm.将六根色谱柱分别用1%SDS水溶液常压润洗2 h后再加压润洗1 h,随后将SWCNTs初始分散液各1 mL分别加入这六根色谱柱中.待SWCNTs分散液全部浸入凝胶后,用1%SDS和0.25%DOC依次淋洗,收集洗出液,并记录分离所用的时间.
2.3 样品的表征
为了确定s-/m-SWCNTs分离的结果,将原始分散液和两次淋洗出的组分进行UV-Vis-NIR吸收光谱表征.UV-Vis-NIR吸收光谱被记录在Perkin Elmer Lambda 750上,用水做空白样.用场发射电子显微镜(FESEM)(Quanta 400 FEG)测得SEM图.
3 结果与讨论
3.1 凝胶孔径尺寸对单壁碳纳米管流动和保留特性的影响
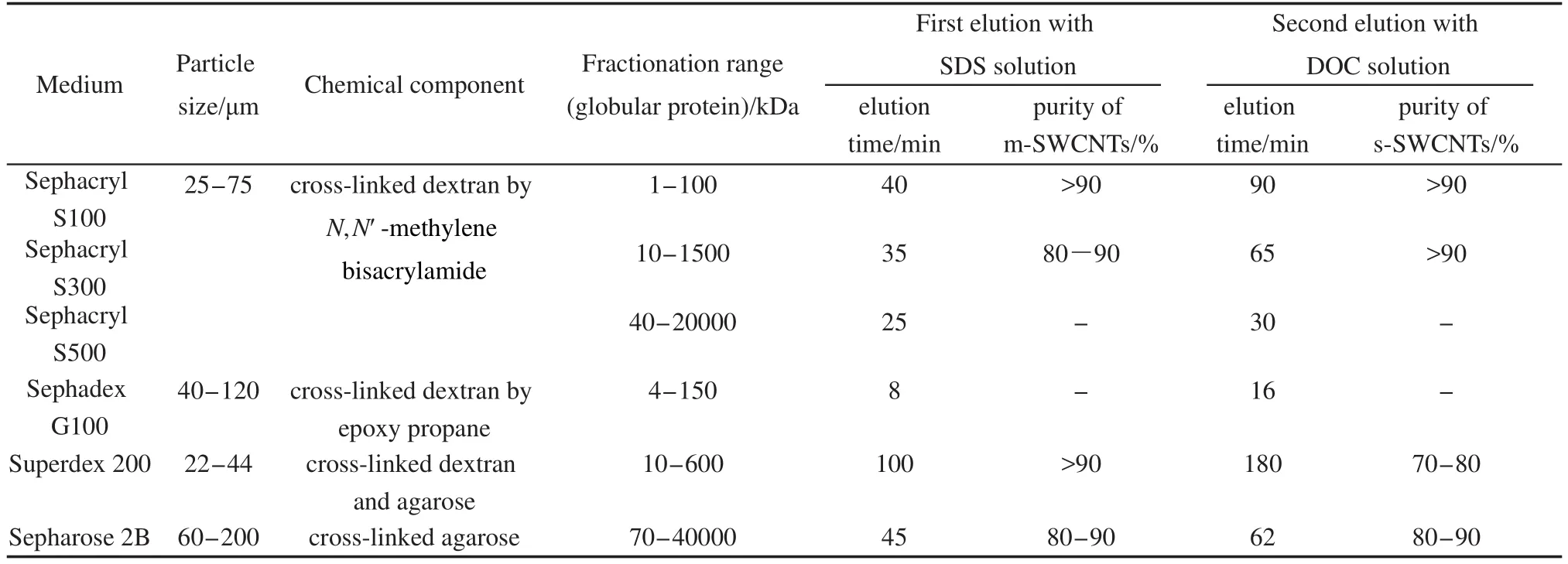
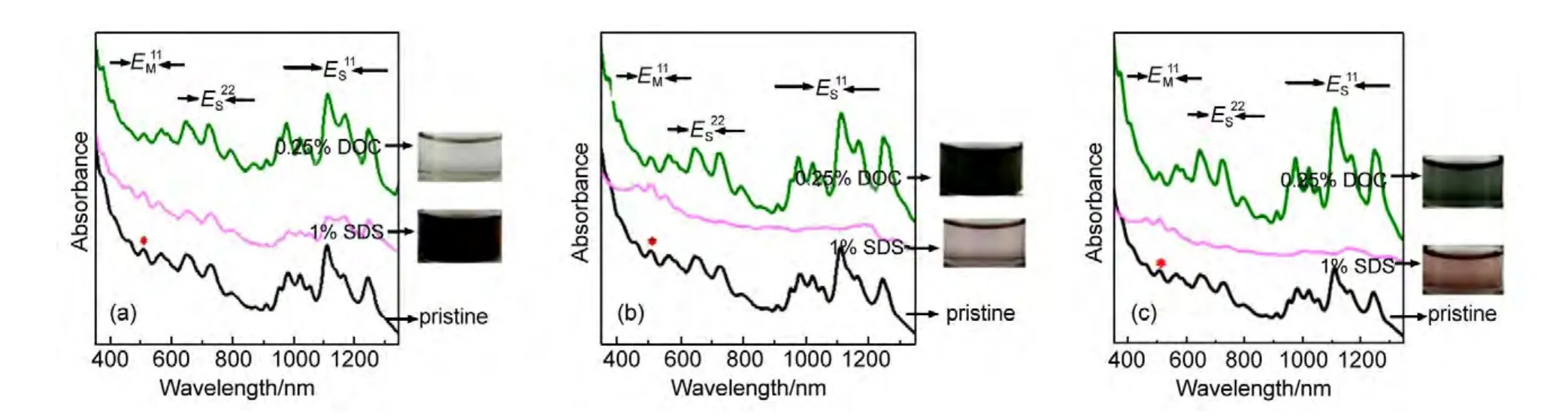
为了研究SWCNTs在多孔凝胶中的流动特性,我们选择三种具有相同化学结构和凝胶颗粒大小,不同孔径尺寸的Sephacryl S100,S300和S500凝胶进行对比研究.一般来说,凝胶孔径的范围用球蛋白的分离范围来确定的,成正比关系.这三种凝胶的分离范围(球蛋白)分别为1-100,10-1500,40-20000 kDa,它们的孔径尺寸范围都在5-200 nm之间.如图1(a)所示,Sephacryl S100、S300和S500三种凝胶具有相似的红外光谱谱图,在1657和1528 cm-1处的吸收峰对应酰胺键结构中C=O和N―H的平面振动,说明具有相同的化学结构,都是N,N′-亚甲基双丙烯酰胺的葡聚糖交联结构.图1(b)是这三种Sephacryl凝胶颗粒的FESEM图,可以看出具有不同的表面形态和孔径,孔尺寸范围大小顺序为:S100 图1 Sepharcryl S100,S300和S500颗粒的红外光谱图(a)和FESEM图(b)Fig.1 Infrared(IR)spectra(a)and field emission scanning electron microscope(FESEM)images(b)of Sepharcryl S100,S300,and S500 particles 向三根色谱柱加入1 mL SWCNTs初始分散液,待全部渗入凝胶后,用1%SDS溶液和0.25%DOC溶液依次淋洗,收集洗出液并记录时间.图2是在填有三种Sephacryl凝胶的色谱柱中添加了SDS分散的SWCNTs、SDS淋洗以及DOC淋洗过程中SWCNTs表现出不同流动性的比较.不同电子结构的SWCNTs具有不同的颜色,18当用不同淋洗条件淋洗时,很容易看出SWCNTs不同的移动情况.首先将分散的SWCNTs各取1 mL,加入到这三根色谱柱中,SWCNTs分散液渗入到凝胶中后呈现出不同的颜色分布和扩散长度.在S500色谱柱中,SWCNTs会快速地向下扩散,没有颜色上的区别,都呈灰黑色.而在S100和S300色谱柱中,渗入凝胶的SWCNTs明显呈现出不同的上下两层颜色,上层凝胶呈暗绿色,下层是红棕色.当我们加入1%SDS溶液淋洗时,两个色谱柱下层的红色溶液开始移动,收集了红棕色的洗出液.而在装有S500色谱柱中,灰黑色的样品随着SDS淋洗液向下移动,贯穿了整个色谱柱,我们收集了灰黑色的洗出液.最后使用DOC溶液淋洗,在S500柱中,由于第一次淋洗时大部分碳管已被洗出,第二次淋洗出来的SWCNTs浓度很低.而在S100和S300柱顶部保留的样品开始缓慢向下移动,并且S100柱中的颜色比S300柱中的深,但扩散的范围比S300的小.在SWCNTs渗入凝胶和用表面活性剂淋洗时,SWCNTs的流动行为表现出如此大的不同,反映出SWCNTs在多孔凝胶中的移动特征,表明SWCNTs在多孔凝胶中移动时,凝胶孔径尺寸起到了重要作用. 已有的研究结果表明,当用SDS分散SWCNTs时,SDS分子吸附在碳管表面,并且根据SWCNTs的直径和手性差异,具有不同的表面堆积密度.19,20大管径的SWCNTs比小管径的SWCNTs表面堆积的SDS密度大,使得小管径SWCNTs与凝胶之间的作用力比大管径SWCNTs与凝胶的作用力强.此外,溶液中过多自由的SDS分子趋向与SDSSWCNT作用,形成更加稳定的胶束结构.21,22上面所述说明SWCNTs被SDS和DOC两次淋洗表现出不同的流动行为是与凝胶孔径有关的.我们推测:当用比较弱的淋洗剂SDS进行淋洗时,SWCNTs与大孔径尺寸的S500凝胶之间的吸附力很小,吸附在凝胶孔洞中的SWCNTs很容易自由流动,被淋洗剂洗脱出来;而对于孔径较小的S100和S300凝胶,不同结构的SWCNTs在和凝胶中具有不同的吸附力,一部分SWCNTs可以通过凝胶洗脱出来,而另一部分SWCNTs留在凝胶中,需要用更强的淋洗剂(DOC)才能被洗脱出来. 图2 单壁碳纳米管在S100,S300和S500中渗透淋洗时分离过程的照片Fig.2 Sequential photographs of SWCNT permeation and elution during sample loading in Sephacryl S100,S300,and S500 gel column 图3(a)是SWCNTs的初始分散液以及1%SDS溶液淋洗出来的SWCNTs的吸收光谱图和溶液光学照片.初始分散液是一个典型的单分散HiPCOSWCNTs的吸收曲线,对于HiPCO-SWCNTs,m-SWCNTs的第一范霍夫(Van Hove)奇点之间跃迁所需的能量比较大,该跃迁引起的吸收峰EM11一般在400-600 nm范围内,而s-SWCNTs的Van Hove奇点之间跃迁所需的能量ES11在950-1350 nm范围内,ES22通常在550-900 nm范围内.同SWCNTs初始分散液的吸收光谱相比,在S100和S300色谱柱中经1%SDS淋洗出的红棕色SWCNTs溶液表现出明显减弱的ES22和ES11半导体性特征吸收带以及增强的EM11金属性特征吸收带,说明主要富集了m-SWCNTs.然而,对于S500色谱柱,第一次收集淋洗溶液的吸收光谱和SWCNTs初始分散液的吸收光谱很接近,只有在ES11小波数(950-1050 nm)的吸收峰有轻微的降低,没有实现m-和s-SWCNTs的分离.图3(b)是继续用DOC溶液从三根色谱柱中淋洗出来的SWCNTs吸收光谱图.从S100和S300凝胶色谱柱中收集的SWCNTs溶液都是绿色的,表现出明显减弱的金属性特征吸收带以及增强的半导体性特征吸收带,说明富集的是s-SWCNTs.但是从S500凝胶色谱柱中收集的组分浓度很低,吸光度很小,为了便于观察比较,我们将吸收光谱的数值扩大了4倍,可以看出s-SWCNTs小直径区域的吸收峰有些增加.经过计算,第一步SDS洗脱时,从S100凝胶中淋洗得到的m-SWCNTs的纯度高达95%,从S300凝胶洗脱的m-SWCNTs纯度达到80%-90%,并且第二步DOC洗脱时,从两个柱中淋洗出的s-SWCNTs的纯度均大于90%. 图3 单壁碳纳米管初始分散液以及Sephacryl S100,S300,S500色谱柱中淋洗出溶液的吸收光谱和光学照片Fig.3 The normalized optical absorption spectra and optical images of the pristine SWCNTs and collected SWCNT fractions from Sephacryl S100,S300,and S500 gel columns 从上述结果可以看出,在结构相同孔径依次增大的Sephacryl S100、S300、S500三种凝胶中,孔径最小的S100分离出的m-和s-SWCNTs纯度最高,而大孔径的S500却不能实现分离.说明凝胶孔径对分离SWCNTs的结果和纯度有很大的影响,是提高分离纯度的一个关键因素. 除了Sephacryl凝胶,其它的多糖凝胶如琼脂糖(Agarose)和交联琼脂糖(Sepharose 2B)也能够进行SWCNTs的m/s分离.13,14但到目前为止还没有人研究凝胶结构对SWCNTs流动性和m/s分离的影响.我们选用了分别与Sephacryl S系列孔径尺寸相近但结构不同的多糖凝胶(Sephadex G100、Superdex 200和Sepharose 2B)进行了SWCNTs流动性和m/s分离的对比研究.表1是六种凝胶分离范围、化学结构、分离碳管时淋洗时间和分离纯度的比较.Sephadex G100与Sephacryl S100的孔径尺寸相似,但是Sephadex G100带有更疏水的环氧丙烷基团.将样品加入Sephadex G100色谱柱后,与图2中Sephacryl S100分离情况有明显差异.SWCNTs在Sephadex G100凝胶中快速扩散,使用SDS溶液淋洗时,SWCNTs遍布整个色谱柱,并且快速流出,在图4(a)中,我们可以看到两步淋洗出来的SWCNTs溶液与初始分散液的吸收光谱没有明显的差异,无法进行SWCNTs的m/s分离.有趣的是,孔径范围相近的Superdex 200和Sephacryl S100,两种凝胶都可以有效地分离SWCNTs,但是Superdex 200色谱柱淋洗m-和s-SWCNTs的移动速度比Sephacryl S100色谱柱慢很多,SWCNTs在凝胶中表现出不同的流动特性.由于这三种凝胶都具有相同的葡聚糖结构,只是带有不同的官能团,碳管不同的流动特性表明多糖中交联的官能团对碳管的吸附起到了很重要的作用.根据碳管在凝胶中的滞留时间,我们推测,SDS-SWCNTs与三种凝胶官能团之间的作用力大小顺序是:琼脂糖>双丙烯酰胺官能团>环氧丙烷官能团.我们也比较了具有类似孔径范围的Sepharose 2B和Sephacryl S500两种凝胶,发现碳管在交联琼脂糖结构的Sepharose 2B中也表现出了较长的滞留时间,暗示有较强的吸附力. 从图4(b,c)中的吸收光谱来看,与初始SWCNTs分散液相比,Superdex 200和Sepharose 2B凝胶中由1%SDS洗脱的SWCNTs组分表现出明显增强的金属特征峰而半导体特征峰几乎没有,说明富集了高纯度的m-SWCNTs;第二步0.25%DOC溶液洗脱的SWCNTs组分表现出明显增强的半导体特征峰,但是金属特征峰只有一定程度的减弱,表明所富集的s-SWCNTs中还混有少量的m-SWCNTs.我们认为:对于琼脂糖改性的凝胶,由于与SWCNTs的作用力过强,在使用SDS淋洗时,一部分m-SWCNTs也保留在多孔凝胶中,因此降低了s-SWCNTs的分离纯度,但是对分离出高纯度的m-SWCNTs是有益的.例如,与Sephacryl S100和S300凝胶相比,虽然用Superdex 200凝胶分离出来的s-SWCNTs纯度不高,但可以获得高纯度的m-SWCNTs.此外,由于Sepharose 2B和Sephacryl S500具有相似的孔径范围,交联琼脂糖Sepharose 2B可以实现一定的m/s分离而Sephacryl S500则不能,也意味着在凝胶柱色谱技术分离SWCNTs过程中,多糖凝胶的化学结构比孔径尺寸发挥了更大的作用. 表1 各种多糖凝胶以及用1%SDS和0.25%DOC两步淋洗得到的溶液各种性质对照Table 1 Comparative properties of various polysaccharide gels as well as the corresponding sorting results of SWCNTs by a two-step elution with 1%SDS and 0.25%DOC solutions 图4 初始单壁碳纳米管分散液以及1%SDS和0.25%DOC两步淋洗得到的分离溶液的归一化光吸收光谱图及光学照片Fig.4 Normalized optical absorption spectra and optical images of the pristine SWCNTs and collected two fractions by a two-step elution with 1%SDS and 0.25%DOC solutions 从表1上看,我们选用的六种凝胶的颗粒尺寸对分离的影响不大.比如,Sephacryl三种凝胶颗粒尺寸范围都是25-75 μm,S100和S300能够得到很好的分离效果,而S500不能.比较Sephadex G100和Sepharose 2B也可以得到上述结论. 我们认为多糖凝胶色谱柱分离SWCNTs是基于吸附机理的,柱色谱分离时,展现出不同的流动性和分离结果,是因为具有不同导电属性的SWCNTs被SDS包裹程度不同,进而影响与凝胶之间的吸附作用力.大直径的m-SWCNTs表面覆盖的SDS密度大,与凝胶之间的作用力弱,很容易随着淋洗液向下流动.小直径的s-SWCNTs表面覆盖的SDS少,渗入小孔内部后与多孔凝胶产生强有力的吸附作用,使s-SWCNTs选择性的保留在凝胶中.孔径较小的Sephacryl S100和S300凝胶由于具有较大的比表面积,能够充分地吸附SWCNTs,将不同结构的SWCNTs与凝胶之间吸附力的差异体现出来,大孔径凝胶比表面积小,与m-和s-SWCNTs的作用力都很弱,因而小孔径凝胶的分离效果更好.带有琼脂糖结构的Sepharose 2B和Superdex 200凝胶与SWCNTs的作用力太强,不仅会保留小直径s-SWCNTs,还会留住一些大直径的m-SWCNTs,导致s-SWCNTs分离纯度降低.所以凝胶结构和孔径尺寸共同影响SWCNTs的分离效果和纯度.在影响SWCNTs流动性和分离结果的诸多因素中,适当调控凝胶的结构和孔径尺寸是提高分离效率和纯度的关键步骤. 当用SDS分散SWCNTs时,SDS包裹在SWCNTs表面形成胶束,会调控碳管表面性能,进而影响SWCNTs在多孔凝胶中的流动性以及分离结果.我们系统地研究了多糖凝胶的化学结构和孔径尺寸对凝胶柱色谱法分离SWCNTs以及流动性的影响.多孔凝胶与s-SWCNTs之间有较强吸附作用力,选择性地保留住s-SWCNTs,进而通过两步表面活性剂淋洗的方法分离出m-和s-SWCNTs.在Sephacryl系列凝胶中,与大孔径的S500相比,小孔径S100和S300凝胶具有较大的比表面积,对s-SWCNTs的吸附力较强,能够很好地分离出m-和s-SWCNTs.带有环氧丙烷官能团的葡聚糖凝胶与SWCNTs的作用力很弱不能分离SWCNTs.琼脂糖结构的凝胶与SWCNTs的作用力最强,而带有氨基官能团的葡聚糖凝胶对SWCNTs选择性最好.这些都说明了吸附机理在碳管分离中的作用,也说明了在SWCNTs选择性分离时,凝胶结构和孔径尺寸起到了非常重要的作用.因此,选择合适结构和孔径的凝胶,对于分离出高纯度的m-/s-SWCNTs是极其重要的. (1) Saito,R.;Dresslhaus,G.;Dresselhaus,M.S.Physical Review B2000,61(4),2981.doi:10.1103/PhysRevB.61.2981 (2) Ryabenko,A.G.;Dorofeeva,T.V.;Zvereva,G.I.Carbon2004,42(8-9),1523.doi:10.1016/j.carbon.2004.02.005 (3) Hecht,D.S.;Hu,L.B.;Irvin.G.Adv.Mater.2011,23(13),1482.doi:10.1002/adma.201003188 (4)Kong,J.;Franklin,N.R.;Zhou,C.W.;Chapline,M.G.;Peng,S.;Cho,K.J.;Dai,H.J.Science2000,287(5453),622.doi:10.1126/science.287.5453.622 (5) Javey,A.;Guo,J.;Wang,Q.;Lundstrom,M.;Dai,H.J.Nature2003,424,654.doi:10.1038/nature01797 (6) Wind,S.J.;Appenzeller,J.;Avouris,P.Phys.Rev.Lett.2003,91,058301.doi:10.1103/PhysRevLett.91.058301 (7) Jaisi,D.P.;Saleh,N.B.;Blake,R.E.;Elimelech,M.Environmental Science&Technology2008,42,8317.doi:10.1021/es801641v (8) Jaisi,D.P.;Elimelech,M.Environmental Science&Technology2009,43,9161. (9) Li,H.B.;Zhang,J.;Jin,H.H.;Li,Q.W.Acta Phys.-Chim.Sin.2012,26(10),2447.[李红波,张 静,金赫华,李清文.物理化学学报,2012,26(10),2447.]doi:10.3866/PKU.WHXB201209041 (10)Arnold,K.;Hennrich,F.;Krupke,R.;Lebedkin,S.;Kappes,M.M.Physica Status Solidi B-Basic Solid State Physics2006,243,3073. (11) Heller,D.A.;Mayrhofer,R.M.;Baik,S.;Grinkova,Y.V.;Usrey,M.L.;Strano,M.S.Journal of the American Chemical Society2004,126,14567.doi:10.1021/ja046450z (12)Moshammer,K.;Hennrich,F.;Kappes,M.M.Nano Research2009,2,599.doi:10.1007/s12274-009-9057-0 (13) Tanaka,T.;Urabe,Y.;Nishide,D.;Kataura,H.Applied Physics Express2009,2(12). (14) Liu,H.;Feng,Y.;Tanaka,T.;Urabe,Y.;Kataura,H.Journal of Physical Chemistry C2010,114,9270. (15) Liu,H.P.;Nishide,D.;Tanaka,T.;Kataura,H.Nature Communications2011,2,309. (16) Gui,H.;Li,H.;Tan,F.;Jin,H.;Zhang,J.;Li,Q.Carbon2012,50,332. (17) McCormick,T.J.;Foley,J.P.;Lloyd,D.K.Journal of Chromatography B-Analytical Technologies in the Biomedical and Life Sciences2003,785,1.doi:10.1016/S1570-0232(02)00756-0 (18) Zhao,P.;Einarsson,E.;Xiang,R.;Murakami,Y.;Maruyama,S.Journal of Physical Chemistry C2010,114,4831.doi:10.1021/jp910959s (19) Tummala,N.R.;Striolo,A.Physical Review E2009,80,021408. (20) Tummala,N.R.;Striolo,A.ACS Nano2009,3,595.doi:10.1021/nn8007756 (21) O'Connell,M.J.;Bachilo,S.M.;Huffman,C.B.;Moore,V.C.;Strano,M.S.;Haroz,E.H.;Rialon,K.L.;Boul,P.J.;Noon,W.H.;Kittrell,C.;Ma,J.P.;Hauge,R.H.;Weisman,R.B.;Smalley,R.E.Science2002,297,593.doi:10.1126/science.1072631 (22)Vaisman,L.;Wagner,H.D.;Marom,G.Advances in Colloid and Interface Science2006,128,37.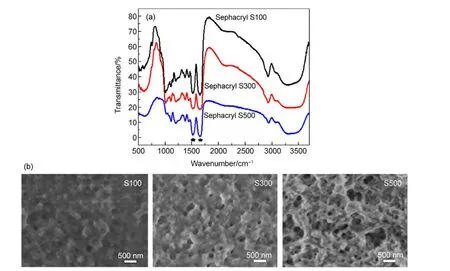

3.2 凝胶孔尺寸对单壁碳纳米管选择性分离的影响

3.3 凝胶结构对SWCNTs流动性和分离的影响
4 结论
