川西北高原野生垂穗披碱草遗传多样性的ISSR分析
2014-02-16郑经红陈仕勇陈智华李世丹钟金城
郑经红, 陈仕勇, 陈智华, 李世丹, 钟金城
(1. 西南民族大学青藏高原研究院, 四川 成都 610041; 2. 西南民族大学生命科学与技术学院, 四川 成都 610041)
川西北高原野生垂穗披碱草遗传多样性的ISSR分析
郑经红1, 陈仕勇2, 陈智华2, 李世丹2, 钟金城1
(1. 西南民族大学青藏高原研究院, 四川 成都 610041; 2. 西南民族大学生命科学与技术学院, 四川 成都 610041)
采用ISSR分子标记技术对25份来自川西北高原的野生垂穗披碱草(Elymus nutansGriseb.)种质进行遗传多样性研究. 研究结果如下: (1)筛选出10条ISSR引物对25份材料共扩增出120条清晰的条带, 其中多态性条带85条, 多态性条带比率为70.8%; 每条引物扩增条带数变化为9-17条, 平均每条引物总扩增的带数为12条, 其中多态性的条带数变幅为3-16条, 平均每条引物的多态性条带数为8.5条. (2)供试的25份垂穗披碱草种质间的遗传相似系数变幅为0.703-0.974, 平均值为0.828, 供试材料间表现出了丰富的遗传多样性. (3)基于遗传相似系数对供试材料进行了聚类分析和主成分分析, 聚类分析结果可以将供试的野生垂穗披碱草种质资源分明显分成3类, 聚类分析结果与材料的地理来源间具有一定的相关性.
垂穗披碱草; 遗传多样性; ISSR; 种质保护
垂穗披碱草(Elymus nutans Griseb.), 又名钩头草、弯穗草, 是禾本科小麦族披碱草属的一种重要的多年生草本植物[1-2]. 野生垂穗披碱草资源主要分布于我国的华北、西北、西南包括青藏高原等区域. 垂穗披碱草具有较强的生态适应性和抗逆特性如具有极强的抗旱性和耐寒性, 其生境也包括了沟谷、滩地、高山林缘带、灌丛草甸及高山草甸等. 该草草质柔软、无刚毛、无刺毛、无异味, 饲用价值较高, 是一种优良的禾本科饲草[3]. 同时它也是草原和草甸等群落的重要组成成分, 具有较好的生态价值. 目前它与披碱草属的另外一种饲草老芒麦均是青藏高原等高寒牧区退化草地改良及人工草地建设中应用最为广泛的牧草种类, 具有非常重要的推广应用价值. 但是目前我国审定登记的垂穗披碱草品种仅有“甘南”、“康巴”、“阿坝“三个品种. 其中“甘南”、“康巴”两个品种年代较久, 品种退化较严重, 它们已经远不能满足生态建设及草地畜牧业发展的需要, 所以亟待加快垂穗披碱草种质资源的收集、创新及综合评价研究.
简单序列重复区间扩增多态性(Inter-simple sequence repeat, ISSR)是一种基于PCR技术的高效的分子标记[4].相应的ISSR引物可直接在植物基因组中进行PCR扩增, 扩增产物可以用聚丙烯酰胺或琼脂糖凝胶电泳检测. ISSR分子标记技术可以高效、快速及灵敏地检测出基因组DNA的多态性, 无需预先知道基因组DNA中的序列信息即可检测. 同时, PCR扩增出的谱带丰富且具有良好的重复性, 操作过程简便、成本较低, 也适合于大样本的检测. 目前, ISSR分子标记技术已经在植物种群遗传学、种质资源遗传评价、分类学与系统发生学等方面得到了迅速而广泛的应用[5]. 目前已在小麦族中的披碱草属、仲彬草属等资源的遗传多样性评价、系统发育与演化等方面得到成功的应用[6-7]. 目前, 对于野生垂穗披碱草种质资源的遗传评价方面的研究报道还较少, 特别是对来自川西北高原分布的野生垂穗披碱草资源遗传多样性的研究还较少. 本研究采用ISSR分子标记技术对收集自川西北高原的野生垂穗披碱草种质资源进行遗传多样性分析, 为川西高原野生垂穗披碱草种质资源的收集、保护及育种开发等提供有益的参考.
1 材料与方法
1.1 供试材料
试验收集了来自青藏高原东缘地区四川甘孜和阿坝的25份野生垂穗披碱草资源, 材料的编号和具体来源情况如表1所示.
1.2 DNA提取
将垂穗披碱草的种子剥去外稃后在冰箱中低温保存处理24h, 然后置于光照培养箱中24℃条件下发芽, 待供试的种子发芽后将幼苗转移到实验的瓦盆中. 数周后待其开始分蘖且叶片较多时取其较嫩的叶片提取基因组DNA. 植物基因组总DNA的提取采用改良的CTAB法进行[8]. 最后提取的植物DNA采用1.0%的琼脂糖凝胶电泳法和紫外分光光度计法及检测其纯度和浓度.
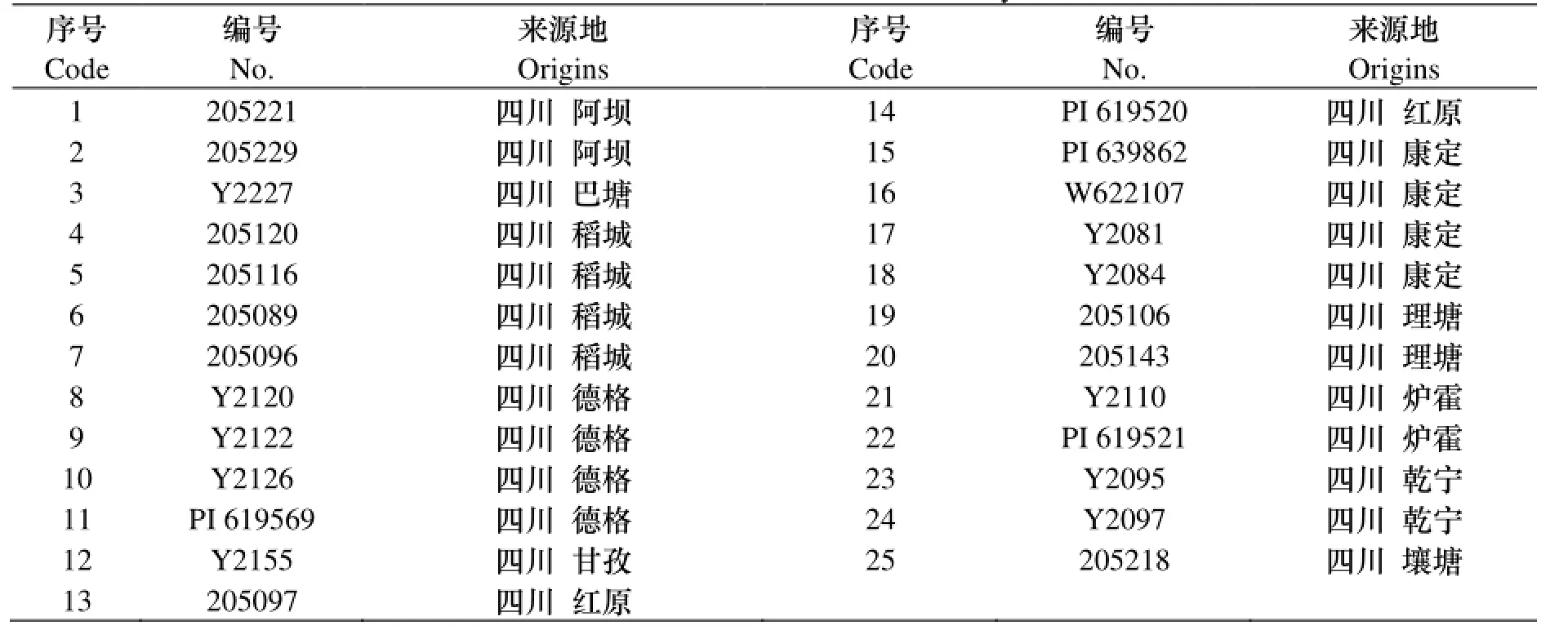
表1 供试材料表Table 1 the material used in the study
1.3 引物筛选
试验选取四个经电泳检测质量较高材等料:川的西D獐N牙A菜进多行糖I的SS提R取引及物含的量测筛定选. 经PCR及电泳分析后, 选择多态性较好、条带清晰的引物用作后续ISSR的研究分析. 最后试验挑选了其中的10条多态性好及条带较清晰引物, 筛选出的引物情况如表2所示.
1.4 ISSR扩增和电泳
本试验扩增程序和反应体系参照Ma等[9]的试验进行. 反应体系总体积20μL, 其中含1×PCR buffer(10mol/L Tris-HCl, 50mmol/L KCl, 0.1% Triton X-100, 1.5mol/L MgCl2), 0.2mmol/L dNTPs, 5pmol引物, 30 ng模板DNA, 1U Taq DNA聚合酶(北京天根公司). PCR扩增在PTC-200 PCR仪上进行扩增, 扩增程序: 94 ℃ 5 min(预变性); 94 ℃30S(变性), 51.3 ℃ 45 S(退火), 72 ℃ 2min(延伸), 45个循环; 最后72 ℃延伸10min; 4 ℃保存.
PCR扩增的产物在6%浓度的聚丙烯酰胺凝胶中(丙烯酰胺: 甲叉=19: 1, 7.5mol/L尿素, 1×TBE缓冲液)进行分离并采用银染法进行条带检测[10]. 每个样品上样6μL, 以D2000 Marker(北京天根公司)为对照, 在DYCZ-20D电泳仪(北京六一)上采用80W恒定功率条件进行电泳. 首先预电泳30min, 然后加样电泳1h, 电泳结束后再用0.1%的AgNO3进行银染色, 并在Na2CO3弱碱显影液中进行显色, 电泳结果采用数码相机照相保存及分析.
1.5 数据统计与分析
在ISSR电泳分析图谱中, 选择条带清晰且重复性较好的进行分析, 同时将实验扩增产物的每一个条带均视为一个位点, 然后统计本研究中扩增的总位点数及多态性位点数. 按照条带的有、无分别进行赋值, 有带的记为1, 无带的则记为0. 本研究中供试材料间的遗传相似系数GS值则按照Nei-Li的方法进行计算. 其相关的计算公式为: GS=2Nij/(Ni+Nj), 其中Nij为供试物种材料i和j中共有的扩增位点的数目, Ni表示材料i中出现的扩增位点的数目, Nj代表材料j中出现的扩增位点的数目. 另外, 在分析软件NTSYS 2.1中, 根据不同材料间的遗传相似系数GS值采用不加权成对群算术平均法(UPGMA)进行聚类分析和主成分分析[11].
2 结果与分析
2.1 ISSR标记多态性
本试验筛选出了10条扩增条带清晰、多态性较好的引物对25份野生垂穗披碱草种质资源进行了ISSR电泳分析. 本试验中10条引物共扩增出了120条清晰的条带, 其中多态性条带为85条, 多态性条带比为70.8%. 每条引物扩增的条带数变幅为9-17条, 平均扩增的条带数为12条; 其中条带引物扩增的多态性条带数变幅为3-16条, 平均值为8.5条(如表2所示). 本试验ISSR电泳扩增出的片段长度大小约在200-2000bp之间(如图1所示). ISSR分子标记在垂穗披碱草资源遗传多样性评价中表现出了较好的效果.
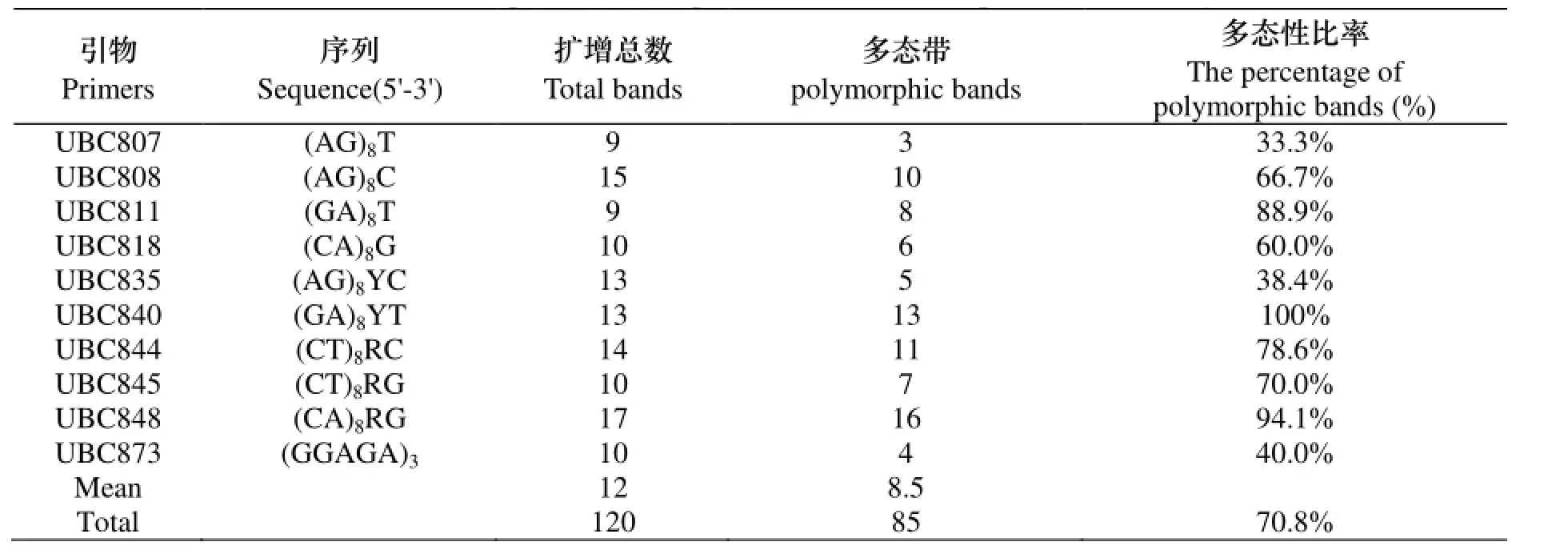
表2 10个ISSR引物序列及扩增结果Table 2 The sequences and amplification results of 10 primers in the study
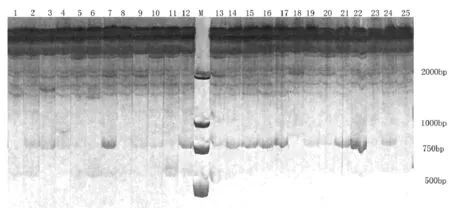
图1 引物UBC807对25份垂穗披碱草的扩增图Fig.1 PCR amplification patterns of primer UBC807 in 25 Elymus nutans
2.2 遗传相似系数及聚类分析
在NTSYS软件中基于Dice遗传相似系数(GS值)计算出25份野生垂穗披碱草种质间的遗传相似性系数变幅为0.703-0.974, 其中供试材料的平均GS值为0.828, 供试野生垂穗披碱草表现出了丰富的遗传多样性. 在本研究中供试材料Y2227(四川巴塘)与Y2110(四川炉霍)的供试材料之间的遗传相似系数GS值最小为0.703, 这也表明了这两份垂穗披碱草种质间的遗传距离较远, 它们间的亲缘关系也相对较远; 同时地理来源均来自于四川康定的W622107和Y2081这两份供试材料间的遗传相似系数GS值最高为0.9744, 这也表明了这两份供试垂穗披碱草种质的遗传距离最小, 供试材料间的亲缘关系也相对较近.
基于不同供试材料间的Dice遗传相似系数值, 采用UPGMA法对供试的垂穗披碱草材料进行了聚类分析(如图2所示). 从聚类图中可以看出25份供试的垂穗披碱草材料被明显地分成3个大类, 聚类分析与其地理来源表现出了一定的相关性. 第一类主要包括四川阿坝(205221、205229)、稻城(205116、205089、205096)、德格(Y2120、Y2126、PI619569)、甘孜(Y2155)以及红原(205097、PI619520)的11份材料; 该类材料主要分布在川西
北高原的边缘地带. 第二类主要包括四川康定(PI639862、W622107、Y2081)、理塘(205106、205143)、炉霍(PI619521、Y2110)、壤塘(205218)以及乾宁(Y2095、Y2097)的10份材料; 此类材料主要分布在川西北高原的中南部. 第三类包括了四川康定(Y2084)、德格(Y2122)、巴塘(Y2227)以及稻城(205120)的5份材料; 该类的材料的聚类从地理来源上看较混杂, 和地理来源的相关性不是很大. 这可能与材料间具有相似的小生境有关, 材料间发生了趋同变异.

图2 25份垂穗披碱草材料基于遗传相似系数的UPGMA聚类图Fig.2 UPGMA dendrogram of 25 Elymus nutans based on genetic similarity coefficients
2.3 主成分分析
在NTSYS软件中基于Dice遗传相似系数对供试垂穗披碱草材料进行主成分分析, 并根据前三个主成分进行绘图(如图3所示). 在主成分分析图中, 供试材料间的关系较近者其在图中的位置便较近, 相反其亲缘关系较远者其在图中的位置也较远. 供试的垂穗披碱草种质材料中来自同一地区或者相近地理来源的材料基本能够划分在一起. 这也表明了在本研究中聚类分析的结果与主成分分析的结果基本保持一致. 另外, 本研究中的主成分分析图也更加直观地反映了供试的垂穗披碱草种质材料间的亲缘关系.

图3 25份垂穗披碱草基于ISSR标记的主成份分析Fig.3 The principal coordinate analysis of 25 Elymus nutans based on ISSR data
3 讨论
3.1 川西北高原野生垂穗披碱草ISSR标记的遗传多样性
ISSR分子标记由于其快简便、快速、稳定性和重复性较好等特点广泛地应用于植物遗传研究的各个方面. 在本研究中, 筛选出的10条效果较好的ISSR引物能够在25份供试材料中扩增出120条清晰的条带, 这其中包括了多态性条带85条, 多态性条带比率为70.8%, 其揭示了川西北高原野生垂穗披碱草资源具有丰富的遗传多样性.本研究中ISSR标记的多态性与相关研究中的RAPD的多态性效果相当, 但是ISSR的稳定性和重复性明显好于RAPD技术[12]. 另外, 本研究中的10条ISSR引物能够将25份材料分开, 为种质资源的鉴定等研究提供了一定的参考. 所以, 本研究也表明ISSR分子标记技术在垂穗披碱草种质资源的遗传评价、种质鉴定等中应用是行之有效的.
3.2 川西北高原野生垂穗披碱草的遗传变异
目前, 不同的技术和方法均在不同程度上揭示了不同地区内垂穗披碱草种质资源的遗传多样性.如马啸等[13]采用酸性聚丙烯凝胶电泳分析了来自于青藏高原等地区的33份野生垂穗披碱草种质的醇溶蛋白遗传多样性, 其研究结果揭示了供试的垂穗披碱草材料间具有丰富的醇溶蛋白遗传多样性. 张建波等[14]也同样采用酸性聚丙烯凝胶电泳分析了川西北高原不同垂穗披碱草种质的醇溶蛋白遗传特性, 其结果也揭示了该地区内垂穗披碱草种质资源具有丰富的醇溶蛋白遗传多样性, 同时其聚类分析与供试材料的海拔间表现出了一定的相关性. 邓竹佳等[12]采用RAPD技术也揭示了28份来自川西北的野生垂穗披碱草的遗传变异和分化情况. 这些研究结果与本研究的结果基本一致, 均不同程度地揭示了野生垂穗披碱草资源的遗传变异和分化, 为垂穗披碱草资源的进一步创新和利用提供了参考.
3.3 川西北高原野生垂穗披碱草种质资源的保护
对野生植物资源进行遗传多样性等评价, 可以为相关物种资源的保护和利用提供重要的参考[15]. 目前的一些研究都表明了川西北高原野生垂穗披碱草具有丰富的遗传特性, 但是随着沙化、退化、盐碱化等生态环境的不断恶化, 其野生优异基因资源等都不同程度的受到破坏和丧失, 所以非常有必要对其制定合理的保护和利用策略. 杨智永等[16]研究了川西北若尔盖地区的垂穗披碱草种群分化及其性状的遗传规律, 结果发现其在细胞学核型和生物学性状上存在显著的差异; 其种群分化成了不同的气候生态型及生物生态型. 严学兵等[17]研究了来自青海、甘肃地区9个垂穗披碱草种群的遗传变异及其地理分化因素, 结果发现海拔是影响其遗传结构的主要因素. Chen等[15]也分析了来自我国西部包括青藏高原地区垂穗披碱草的遗传和地理分化, 研究发现地理隔离及海报等生态因子对其遗传变异和分化具有重要的作用. 本研究中ISSR分析结果也揭示了川西北高原野生垂穗披碱草资源在其相近的生态地理区域内表现出了一定的遗传相似性. 所以本研究也建议在川西北地区垂穗披碱草应该按照不同的生态地理区域进行保护和利用. 另外, 关于经纬度、海拔等因子在野生垂穗披碱草种质资源遗传变异中的作用和重要性仍待进一步的研究和综合分析.
[1] 卢宝荣. 披碱草属与大麦属系统关系的研究[J]. 植物分类学报, 1997, 35:193-207.
[2] 周永红, 郑有良, 杨俊良等. 10种披碱草属植物的RAPD分析及其系统学意义[J]. 植物分类学报, 1999, 37: 425- 432.
[3] 陈默君, 贾慎修. 中国饲用植物[M]. 北京:中国农业出版社, 2002: 119-120.
[4] ZIETKIEWICZ E, RAFALAKI A, LABUD D, et al. Genome fingerprinting by simple sequence repeat (SSR)-anchored polymerase chain reaction amplification[J]. Genomic, 1994, 20:176-183.
[5] 朴红梅, 李万良, 穆楠, 等. ISSR标记的研究与应用[J]. 吉林农业科学, 2007, 32: 28-31.
[6] 李永祥, 李斯深, 李立会, 等. 披碱草属12个物种遗传多样性的ISSR和SSR比较分析[J]. 中国农业科学, 2005, 38: 1522-1527.
[7] 张利, 周永红, 丁春邦, 等. 应用ISSR标记研究仲彬草属植物的遗传变异[J]. 广西植物, 2006, 36: 375-380.
[8] WELSH J, MCLENLAND M. Fingerprinting Genome Using PCR with Arbitrary Primers[J]. Nucl Acids Res, 1990,18: 7213-7218.
[9] MA X, ZHANG XQ, ZHOU YH, et al. Assessing genetic diversity of Elymus sibiricus (Poaceae:Triticeae) populations from Qinghai-Tibet Plateau by ISSR markers[J]. Biochem Syst Ecol, 2008, 36: 514-522.
[10] SUN GL, SALOMON B, BOTHMER VON R. Analysis of tetraploid Elymus species using wheat microsatellite makers and RAPD
makers[J]. Genome, 1997, 40:806-814.
[11] ROHLF J F. NTSYS-PC: Numerical taxonomy and multivariate analysis system(Version 2.0)[M]. New York: Exeter software, 1994.
[12] 邓竹佳, 苗佳敏, 张新全, 等. 川西北高原野生垂穗披碱草RAPD变异研究[J]. 草业与畜牧, 2010, 181: 17-21.
[13] 马啸, 周永红, 于海清, 等. 野生垂穗披碱草醇溶蛋白遗传多样性分析[J]遗传, 2008, 28: 699-706.
[14] 张建波, 白史且, 张新全, 等. 川西北高原野生垂穗披碱草醇溶蛋白遗传特性研究[J]. 安徽农业科学, 2008, 10: 121-124.
[15] CHEN SY, MA X, ZHANG XQ, et al. Genetic variation and geographical divergence in Elymus nutans (Poaceae: Triticeae) from west China[J]. Biochem Syst Ecol, 2009, 37(6): 716-722.
[16] 杨智永, 卞志高, 盘朝邦, 等. 若尔盖高原垂穗披碱草种群分化和性状遗传规律研究[J]. 四川草原, 1995, 2: 1-16.
[17] 严学兵, 郭玉霞, 周禾, 等. 青藏高原垂穗披碱草遗传变异的地理因素分析[J]. 西北植物学报, 2007, 27: 328-333.
Assessment of genetic diversity of Elymus nutans in northwest plateau of Sichuan province using ISSR markers
ZHENG Jing-hong1, CHEN Shi-yong2, CHEN Zhi-hua2, LI Shi-dan2, ZHONG Jin-cheng1
(1. Institute of Qinghai-Tibet Plateau, Southwest University for Nationalities, Chengdu 610041, P.R.C.;
2. School of Life Science and Technology, Southwest University for Nationalities, Chengdu 610041, P.R.C.)
The genetic diversity of 25 Elymus nutans wild accessions from northwest plateau of Sichuan province was investigated using 10 ISSR primers. A total of 120 were detected, of which a total of 85 bands were polymorphic. The amplified bands for each primer were ranged from 9 to 17, in an average of 12. Likewise, the polymorphic bands for each primer varied from 3-16 bands with a mean of 8.5 bands. The genetic similarity (GS) values based on ISSR data ranged from 0.703-0.974 with a mean of 0.828, indicating a rich genetic diversity. The cluster analysis (UPGMA) and principle component analysis (PCA) based on ISSR data showed that all 25 Elymus nutans could be divided into three groups, which showed some correlation with the geographical origins of E. nutans.
Elymus nutans;genetic diversity; ISSR; germplasm conservation
S811.5; S812
: A
: 1003-4271(2014)03-0330-06
10.3969/j.issn.1003-4271.2014.03.02
2014-03-25
陈智华(1961-), 男, 汉族, 陕西咸阳人, 教授, 博士, 研究方向: 生物多样性保护.
猜你喜欢
杂志排行
西南民族大学学报(自然科学版)的其它文章
- Polymorphisms of growth hormone (GH) and insulin-like growth factor I (IGF-I) genes in prolific Lezhi Black Goat: possible association with litter size
- 遗产型景区应如何应对危机事件浅析
——以九寨沟“10.2”事件为例 - 乐至黑山羊GH和IGF-I基因多态性及其与产羔性状的关联性分析
- 解决不同类型指派问题的EXCEL模型
- 基于mtDNA COⅠ基因的西藏牦牛遗传多样性及系统进化研究
- Polymorphisms of growth hormone (GH) and insulin-like growth factor I (IGF-I) genes in prolific Lezhi Black Goat: possible association with litter size
