藏药波棱瓜子总木脂素对刀豆球蛋白(ConA)致免疫性肝损伤小鼠保护作用及其机制探讨
2014-02-16顾健李佳川樊利娜
顾健, 李佳川, 樊利娜
(西南民族大学化学与环境保护工程学院, 四川 成都 610041)
【特约专稿】
藏药波棱瓜子总木脂素对刀豆球蛋白(ConA)致免疫性肝损伤小鼠保护作用及其机制探讨
顾健, 李佳川, 樊利娜
(西南民族大学化学与环境保护工程学院, 四川 成都 610041)
目的:波棱瓜子是常见的用于治疗肝病的藏药, 疗效确切. 前期研究表明, 总木脂素是波棱瓜子抗肝损伤的有效部位, 但疗效尚不明确. 本研究拟考察藏药波棱瓜子总木脂素对ConA致小鼠免疫性肝损伤的保护作用, 并进一步探讨其对抗肝损伤的作用机制.方法:采用尾静脉注射一次性ConA(20mg/kg)诱发小鼠免疫性肝损伤, 造模8h后取血样和肝脏, 考察不同剂量的波棱瓜子总木脂素对各组小鼠脏器系数、血清丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、骨过氧化物酶(MPO)、一氧化氮(NO)、一氧化氮合酶(NOS)及肝组织匀浆中超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)等生化指标活力或水平的影响; 以HE染色对肝组织进行组织病理学检查; 免疫组织化学法检测波棱瓜子总木脂素对各组小鼠肝脏中肿瘤坏死因子-α(TNF-α)、干扰素-γ(IFN-γ)、白细胞介素-4(IL-4)、白细胞介素-10(IL-10)、核转录因子-κB(NF-κB)表达的影响.结果:波棱瓜子总木脂素可以降低ConA所致免疫性肝损伤小鼠肝脏系数及血清ALT、AST、ALP活力, 显示出较好的保肝作用. 同时波棱瓜子总木脂素也可降低肝损伤小鼠血清NO水平和MPO、NOS活力, 并减少肝组织匀浆中MDA的含量, 增强SOD和GSH-Px活性, 表现出良好的抗氧化作用; 免疫组化结果显示, 波棱瓜子总木脂素还能抑制诸如TNF-α、IFN-γ、IL-4、NF-κB等促炎症因子的表达, 促进抗炎症因子IL-10的表达, 从而抑制肝脏炎症反应而发挥其保肝作用. 病理观察结果也表明, 波棱瓜子总木脂素能减轻ConA对肝组织的损伤.结论: 波棱瓜子总木脂素对ConA致小鼠免疫性肝损伤都具有一定的保护作用,其保肝作用可能与其抗炎、抗氧化能力有关.
波棱瓜子总木脂素; 免疫性肝损伤; 刀豆球蛋白A; 保肝; 抗炎; 抗氧化
研究表明, 以肝细胞炎症、脂质过氧化、肝功能异常为主要特点的肝脏损伤是各种肝脏疾病发生发展的病理生理基础, 一般多由病毒、药物、毒剂、酒精、缺氧等因素引起. 肝损伤发病机制颇为复杂, 一般认为有化学性和免疫性两大类. 前者主要通过细胞色素P450及结合反应产生的中间代谢产物产生损伤, 如改变质膜的完整性、诱导线粒体功能失调、钙超载诱导细胞凋亡、降解酶的活性及自由基的作用等. 而免疫性肝损伤则主要是通过体内各种细胞因子、一氧化氮、补体及免疫变态反应等产生损伤. 如在病毒性肝炎中, 乙肝病毒(HBV)可诱导T细胞介导的细胞免疫反应, 并不直接杀伤肝细胞. 而是通过募集免疫效应细胞至感染的肝脏细胞, 分泌各种炎症、趋化、粘附因子, 一方面可清除入侵的HBV; 另一方面, 上述免疫活性物质可进一步诱导免疫效应细胞释放出过量的炎症因子, 造成更为严重的炎症反应, 从而损伤肝细胞[1]. 而通过减少炎症因子释放, 抑制粘附分子表达等, 可不同程度减轻肝脏损伤, 为肝损伤的临床治疗提供了一个切实可行的切入点.
流行病学调查表明, 肝损伤是严重危害人类健康的疾病临床常见疾病之一. 而我国是各类肝病的高发区域,尤其以HBV感染最为常见. 目前, 针对病毒性肝炎的治疗, 现多提倡综合治疗, 虽然可以通过保护肝实质细胞,
减轻肝损伤, 减缓肝功能的衰退, 控制病情, 但尚无确切有效的药物, 现有的药物只是治标不治本. 因此, 亟需寻找更为安全有效的药物对抗肝脏损伤.
藏医药对肝病的治疗已经引起了国内外学者的关注, 且有望从藏药材中发现治疗肝炎的药材或新的先导化合物. 波棱瓜子为葫芦科波棱瓜Herpetosperalga pedunculosumWal1.的干燥成熟种子, 始载于藏医学著作《月王药诊》, 广泛用于多种藏药复方制剂, 其味苦, 性寒, 能清腑热, 胆热, 具有清热解毒、去火降热、助消化作用,用于治疗赤巴病, 肝病(肝热、黄疸型传染性肝炎), 胆病以及消化不良[2-4]. 目前已报道, 波棱瓜子可用于治疗乙型肝炎病毒、化学物质导致的肝损伤及肝癌等疾病. 前期药效学研究也表明, 波棱瓜子具有较强抗乙肝病毒、保肝降酶活性, 发现并确定其抗肝炎的有效部位为总木脂素[5-7]. 然而, 波棱瓜子抗肝损伤的作用机理, 尚不十分清楚. 因此, 本研究以藏药波棱瓜子总木脂素为研究对象, 采用ConA诱导小鼠免疫性肝损伤模型, 选择肝功能生化指标, 免疫功能观察指标, 分别从脂质过氧化, 免疫调节和细胞因子水平方面, 探讨波棱瓜子总木脂素对免疫性肝损伤的保护作用及其机制, 以期为波棱瓜子总木脂素在病毒性肝炎等免疫性肝损伤中的应用提供实验依据. 为逐步确定波棱瓜子治疗肝病作用物质基础, 扩大其临床应用范围, 充分开发利用这一药用资源奠定基础.
1 材料与方法
1.1 试验药物
波棱瓜子总木脂素, 由西南交通大学生命科学与工程学院提供; 联苯双酯滴丸, 浙江万邦药业有限公司, 批号: 20081107; 复方甘草酸苷片, 日本米诺发源制药株式会社, 批号: 12084.
1.2 动物
ICR小鼠, SPF级, 20±2g, 雄性, 动物合格证号: 动物合格证号: SCXK[川]2013-24, 购于成都达硕实验动物研究中心.
1.3 试剂
刀豆蛋白A(ConcanavalinA, ConA), 美国Sigma公司产品; ALT(批号: 2013018)、AST(批号: 2013018)、ALP(批号: 2013003), 均购自长春汇力生物技术有限公司; NO(批号: 20131010)、NOS(批号: 20131010)、MPO(批号: 20131009)、总蛋白(批号: 20131010)、MDA(批号: 20131011)、SOD(批号: 20131010)、GSH-Px(批号: 20131011),均为南京建成生物工程研究所产品; TNF-α(批号: bs-2081R)、IFN-γ(批号: bs-0480R)、IL-4(批号: bs-0581R)、IL-10(批号: bs-6761R), 均购自北京博奥森生物技术有限公司; NF-κB(批号: BA1297), 武汉博世德生物工程有限公司; 生物素化山羊抗兔IgG(批号: 13152A11), 北京中山金桥生物有限公司; 辣根酶标记链霉素卵蛋白素(批号: 13152A11), 北京中衫金桥生物有限公司; 浓缩型DAB显色试剂盒(批号: K135925C), 北京中衫金桥生物有限公司.
1.4 方法
1.4.1 主要试剂的配制
ConA剂量为20mg/kg, 应用时无菌条件下, 溶于生理盐水中制成1mg/ml的溶液.
1.4.2 动物分组、给药、造模
ICR小鼠, 雄性, 20±2g, 80只, 按体质量分层, 随机分成8组, 空白组、模型组、给药组(0.375g/kg、0.75g/kg、1.5g/kg、3g/kg)、阳性对照(联苯双酯200mg/kg、复方甘草酸苷片113mg/kg), 各组按实验设计剂量连续给药7d, 末次给药后1h, 除空白组, 其余各组一次性尾静脉注射ConA20mg/kg, 诱导免疫性肝损伤[8-11].
1.4.3 检测指标
尾静脉注射ConA后, 禁食不禁水8h, 小鼠取样前称重, 摘眼球取血后, 立即推颈处死, 解剖取出肝脏, 滤纸擦拭, 称重, 计算肝脏系数. 肝脏系数(%)=(肝脏质量mg/体质量g)×100%. 血样室温静臵30min, 4000rpm/min、离心10min, 取上清, 备用. 按说明书分别测定血清ALT、AST、ALP、NO、NOS、MPO. 取上述肝脏组织, 一部分臵于10%福尔马林溶液固定, 脱水、修剪、包埋、切片、HE染色、封片等, 最后镜检; 免疫组化法测定相关炎性细胞因子TNF-α、IFN-γ、NF-κB、IL-4、IL-10. 阳性表达: 颜色为浅黄色或棕黄色, 阴性表达为蓝色, 底色为
白色, 主要表达在细胞浆、细胞膜, 或间质等. 一部分制备成10%肝匀浆, 备用, 测定MDA、SOD、GSH-Px.
1.5 数据分析
2 结果与分析
2.1 对ConA致免疫性肝损伤小鼠肝脏系数的影响
与空白组比较, 模型组小鼠肝脏肿胀明显. 与模型组比较, 波棱瓜子总木脂素能显著降低ConA诱导的免疫性肝损伤小鼠升高的肝脏系数水平(p<0.01). 结果见表1.
表1 波棱瓜子总木脂素对ConA致免疫性肝损伤小鼠肝脏系数的影响, n=10)Table 1 The effects of the total lignans from Tibetan Medicinal Herpetospermum Seeds on the liver coefficients of immunologic liver injury mice induced by ConA(, n=10)
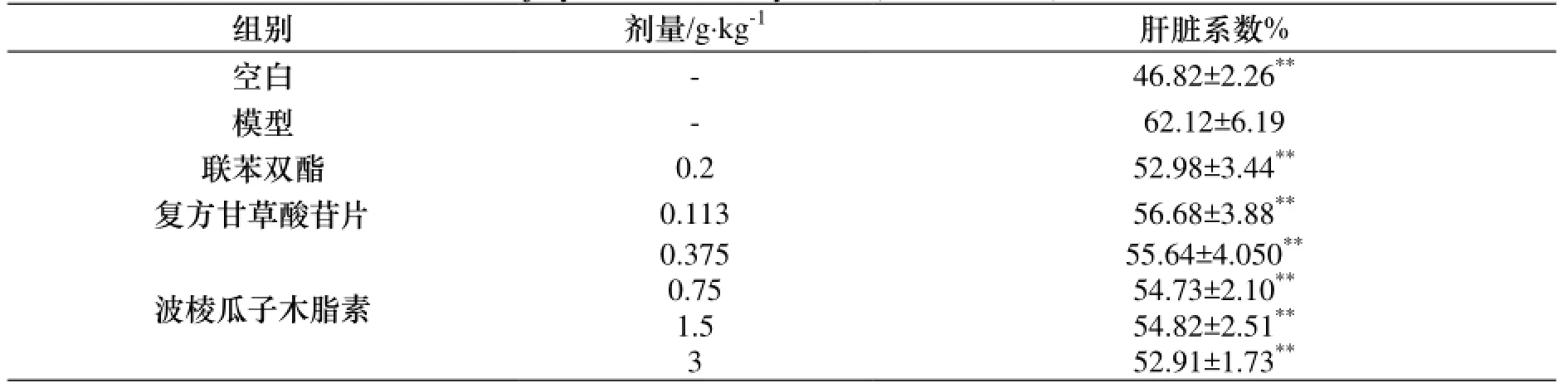
表1 波棱瓜子总木脂素对ConA致免疫性肝损伤小鼠肝脏系数的影响, n=10)Table 1 The effects of the total lignans from Tibetan Medicinal Herpetospermum Seeds on the liver coefficients of immunologic liver injury mice induced by ConA(, n=10)
与模型组比较, * p<0.05, ** p<0.01.
等:川西獐牙菜多糖的提取及含量测定组别 剂量/g·kg-1肝脏系数%空白 - 46.82±2.26**模型 - 62.12±6.19联苯双酯 0.2 52.98±3.44**复方甘草酸苷片 0.113 56.68±3.88**波棱瓜子木脂素0.375 55.64±4.050**0.75 54.73±2.10**1.5 54.82±2.51**3 52.91±1.73**
2.2 对ConA致免疫性肝损伤小鼠血清AST、ALT、ALP活力的影响
与空白组比较, 模型组小鼠血清中的AST、ALT、ALP活力明显高于空白组, 表明ConA致免疫性肝损伤模型建立成功. 与模型组比较, 波棱瓜子总木脂素能降低免疫性肝损伤小鼠血清中的AST、ALT、ALP活力(p<0.05~0.01), 表明波棱瓜子总木脂素能够降低ConA引起的酶活性升高, 减轻肝脏损伤程度. 结果见表2.
表2 波棱瓜子总木脂素对ConA致免疫性肝损伤小鼠血清ALT、AST、ALP的影响(, n=10)Table 2 The effects of the total lignans from Tibetan Medicinal Herpetospermum Seeds on the levels of serum ALT, AST and ALP of immunologic liver injury mice induced by ConA( , n=10)

表2 波棱瓜子总木脂素对ConA致免疫性肝损伤小鼠血清ALT、AST、ALP的影响(, n=10)Table 2 The effects of the total lignans from Tibetan Medicinal Herpetospermum Seeds on the levels of serum ALT, AST and ALP of immunologic liver injury mice induced by ConA( , n=10)
与模型组比较, * p<0.05, ** p<0.01.
组别 剂量/g·kg-1ALT/U·L-1AST/U·L-1ALP/U·L-1空白 - 39.56±2.33**96.82±5.56**122.59±4.18**模型 - 213.1±2.96 218.29±6.70 220.68±34.63联苯双酯 0.2 174.93±13.90**170.18±11.64**149.84±22.39**复方甘草酸苷片 0.113 197.67±8.10*189.35±13.91**153.32±23.66**波棱瓜子木脂素0.375 176.05±21.81**175.94±16.20**118.68±21.37**0.75 147.06±10.21**171.59±13.81**133.10±32.89**1.5 178.61±17.33**164.47±22.90**125.06±19.07**3 163.65±18.42**159.06±23.52**110.90±19.32**
2.3 对肝脏组织病理学的影响
病理检查结果显示, 空白组小鼠肝组织结构清晰完整, 未见点状坏死和炎性细胞浸润, 肝内未见纤维组织增生及假小叶形成; 模型组小鼠肝组织可见点状坏死及小灶性坏死, 肝小叶内大多数肝细胞肿胀, 伴有较多炎性细胞浸润. 波棱瓜子总木脂素各剂量组、联苯双酯组、复方甘草酸苷片组均有一定程度的肝细胞损害, 轻度灶
性坏死, 浊肿, 与模型组比较, 损伤程度较轻, 炎性细胞浸润也减少, 提示波棱瓜子总木脂素能够改善肝脏组织病变, 对免疫性肝损伤小鼠有很好的保护作用. 结果见图1.
2.4 对小鼠血清NO含量、NOS活力的影响
表3 波棱瓜子总木脂素对ConA致免疫性肝损伤小鼠血清NO、NOS的影响(, n=10)Table 3 The effects of the total lignans from Tibetan Medicinal Herpetospermum Seeds on the levels of serum NO and NOS of immunologic liver injury mice induced by ConA(, n=10)

表3 波棱瓜子总木脂素对ConA致免疫性肝损伤小鼠血清NO、NOS的影响(, n=10)Table 3 The effects of the total lignans from Tibetan Medicinal Herpetospermum Seeds on the levels of serum NO and NOS of immunologic liver injury mice induced by ConA(, n=10)
与模型组比较, * p<0.05, ** p<0.01.
组别 剂量/g·kg-1NO/umol·L-1NOS/U·ml-1空白 7.99±1.48**18.87±3.04**模型 15.39±1.53 29.98±2.45联苯双酯 0.2 10.35±1.74**23.66±2.08**复方甘草酸苷片 0.113 12.59±1.76*27.99±1.87**波棱瓜子木脂素 0.375 11.53±1.55**22.43±1.95**0.75 10.94±1.57**20.60±2.29**1.5 12.47±1.77**23.94±3.07**3 11.88±1.29**21.84±3.26**
与空白组比较, 模型组小鼠血清NO含量升高, NOS活力增强. 与模型组比较, 波棱瓜子总木脂素各剂量组均能降低免疫性肝损伤小鼠升高的血清NO、NOS水平(p<0.05~0.01). 结果见表3.
2.5 对小鼠血清MPO活力的影响
与空白组比较, 模型组小鼠血清中MPO含量显著升高. 与模型组比较, 波棱瓜子总木脂素能明显减轻小鼠血清MPO的含量(p<0.01). 结果见表4.
表4 波棱瓜子总木脂素对ConA致免疫性肝损伤小鼠血清MPO的影响, n=10)Table 4 The effects of the total lignans from Tibetan Medicinal Herpetospermum Seeds on the level of serum MPO of immunologic liver injury mice induced by ConA(, n=10)
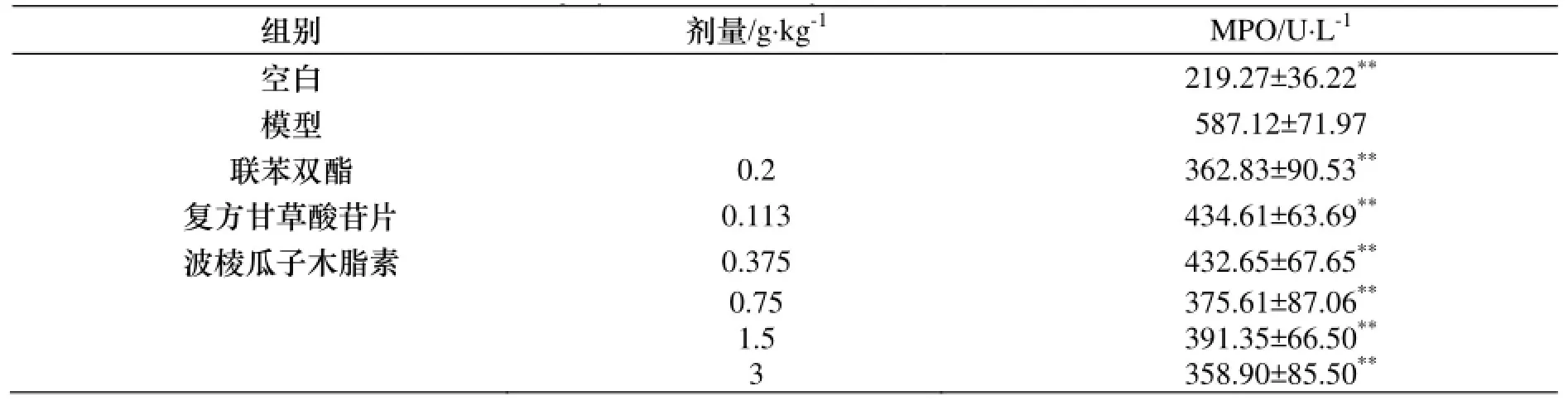
表4 波棱瓜子总木脂素对ConA致免疫性肝损伤小鼠血清MPO的影响, n=10)Table 4 The effects of the total lignans from Tibetan Medicinal Herpetospermum Seeds on the level of serum MPO of immunologic liver injury mice induced by ConA(, n=10)
与模型组比较, * p<0.05, ** p<0.01.
组别 剂量/g·kg-1MPO/U·L-1空白 219.27±36.22**模型 587.12±71.97联苯双酯 0.2 362.83±90.53**复方甘草酸苷片 0.113 434.61±63.69**波棱瓜子木脂素 0.375 432.65±67.65**0.75 375.61±87.06**1.5 391.35±66.50**3 358.90±85.50**
表5 波棱瓜子总木脂素对ConA致肝损伤小鼠肝匀浆MDA、SOD、GSH-Px的影响(,n=10)Table 5 The effects of the total lignans from Tibetan Medicinal Herpetospermum Seeds on the level of MDA, SOD and GSH-Px in liver homogenates of liver injury mice induced by ConA(, n=10)
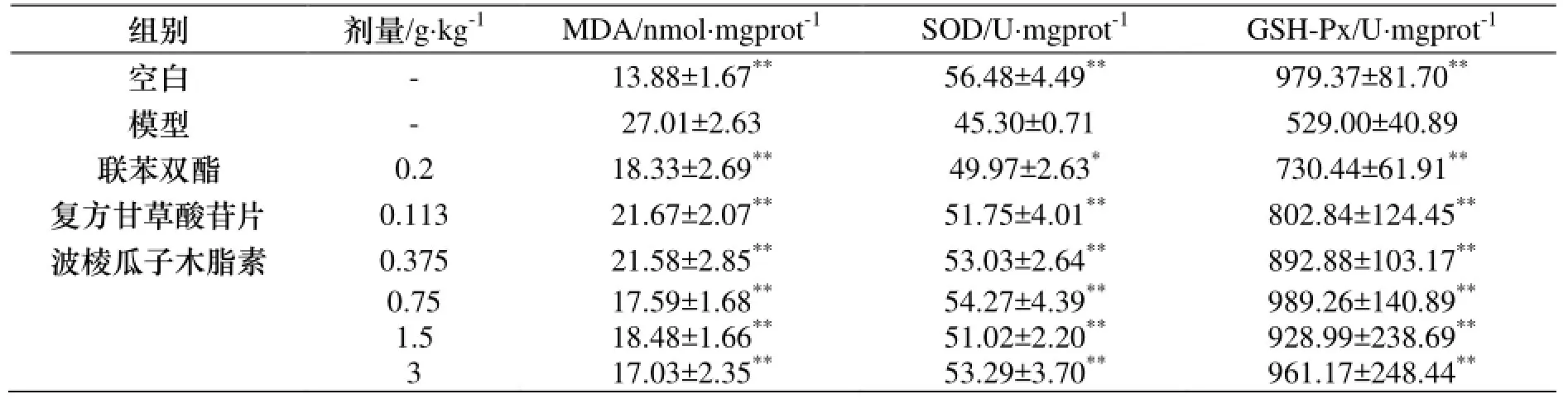
表5 波棱瓜子总木脂素对ConA致肝损伤小鼠肝匀浆MDA、SOD、GSH-Px的影响(,n=10)Table 5 The effects of the total lignans from Tibetan Medicinal Herpetospermum Seeds on the level of MDA, SOD and GSH-Px in liver homogenates of liver injury mice induced by ConA(, n=10)
与模型组比较, * p<0.05, ** p<0.01.
组别 剂量/g·kg-1MDA/nmol·mgprot-1SOD/U·mgprot-1GSH-Px/U·mgprot-1空白 - 13.88±1.67**56.48±4.49**979.37±81.70**模型 - 27.01±2.63 45.30±0.71 529.00±40.89联苯双酯 0.2 18.33±2.69**49.97±2.63*730.44±61.91**复方甘草酸苷片 0.113 21.67±2.07**51.75±4.01**802.84±124.45**波棱瓜子木脂素 0.375 21.58±2.85**53.03±2.64**892.88±103.17**0.75 17.59±1.68**54.27±4.39**989.26±140.89**1.5 18.48±1.66**51.02±2.20**928.99±238.69**3 17.03±2.35**53.29±3.70**961.17±248.44**
2.6 对小鼠肝匀浆MDA含量及SOD、GSH-Px活力的影响
与空白组比较, 模型组小鼠肝匀浆中MDA含量明显升高, SOD、GSH-Px活性明显下降(p<0.01), 表明ConA致免疫性肝损伤小鼠与氧化应激有一定的联系. 与模型组比较, 波棱瓜子总木脂素对肝组织MDA的含量均有不同程度的降低, SOD、GSH-Px的活性有不同程度的升高(p<0.01), 表现出较好的抗氧化作用. 结果见表5.
2.7 对小鼠TNF-α、IFN-γ、NF-κB表达的影响
与空白组比较, 模型组小鼠肝脏中IFN-γ、TNF-α和NF-κB表达水平明显升高(p<0.05). 与模型组比较, 波棱瓜子总木脂素能明显或部分降低小鼠肝组织中IFN-γ、TNF-α和NF-κB的表达(p<0.05). 结果见表6和图2-4.
表6 波棱瓜子总木脂素对ConA致肝损伤小鼠肝脏TNF-α、IFN-γ、NF-κB表达的影响(±s ,n=10)Table 6 The effects of the total lignans from Tibetan Medicinal Herpetospermum Seeds on the express of TNF-α, IFN-γ and NF-κB in liver of liver injury mice induced by ConA(±s , n=10)
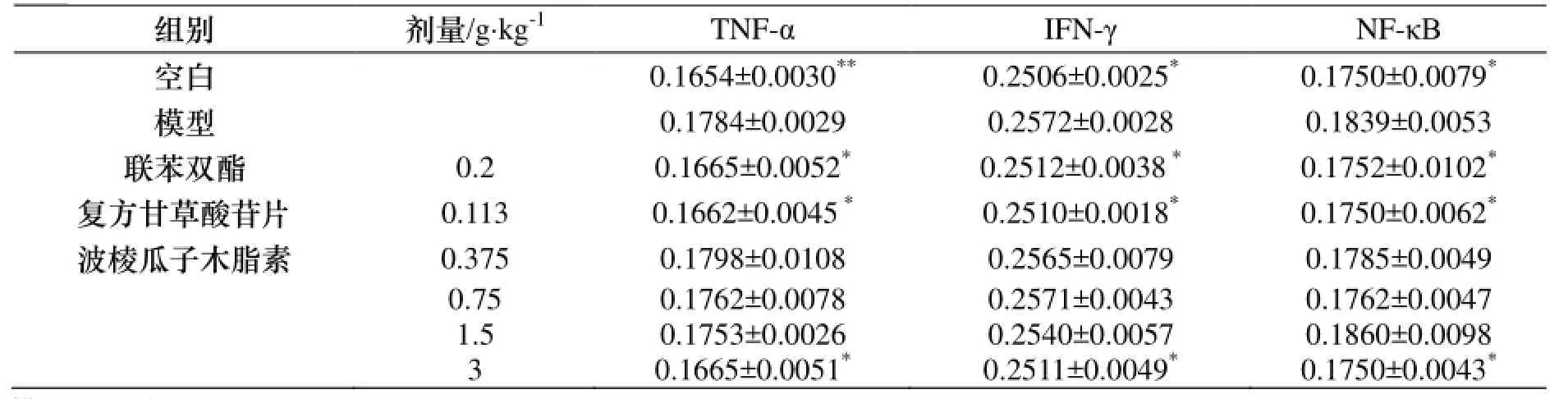
表6 波棱瓜子总木脂素对ConA致肝损伤小鼠肝脏TNF-α、IFN-γ、NF-κB表达的影响(±s ,n=10)Table 6 The effects of the total lignans from Tibetan Medicinal Herpetospermum Seeds on the express of TNF-α, IFN-γ and NF-κB in liver of liver injury mice induced by ConA(±s , n=10)
与模型组比较, * p<0.05, ** p<0.01.
组别 剂量/g·kg-1TNF-α IFN-γ NF-κB空白 0.1654±0.0030**0.2506±0.0025*0.1750±0.0079*模型 0.1784±0.0029 0.2572±0.0028 0.1839±0.0053联苯双酯 0.2 0.1665±0.0052*0.2512±0.0038*0.1752±0.0102*复方甘草酸苷片 0.113 0.1662±0.0045*0.2510±0.0018*0.1750±0.0062*波棱瓜子木脂素 0.375 0.1798±0.0108 0.2565±0.0079 0.1785±0.0049 0.75 0.1762±0.0078 0.2571±0.0043 0.1762±0.0047 1.5 0.1753±0.0026 0.2540±0.0057 0.1860±0.0098 3 0.1665±0.0051*0.2511±0.0049*0.1750±0.0043*
表7 波棱瓜子总木脂素对ConA致肝损伤小鼠肝脏IL-4、IL-10表达的影响(±s , n=10)Table 7 The effects of the total lignans from Tibetan Medicinal Herpetospermum Seeds on the express of IL-4and IL-10 in liver of liver injury mice induced by ConA(±s , n=10)
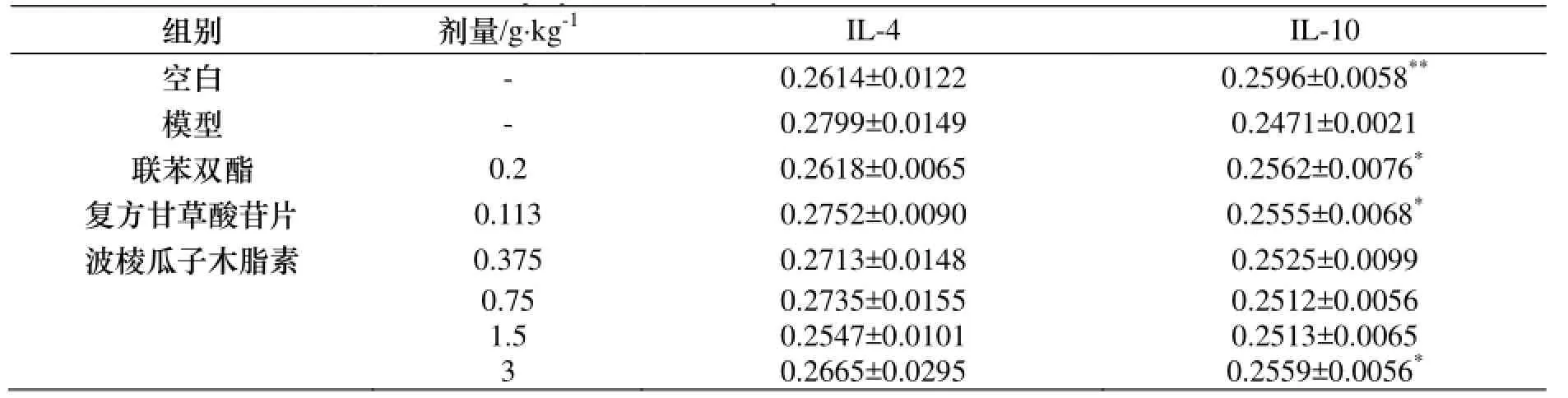
表7 波棱瓜子总木脂素对ConA致肝损伤小鼠肝脏IL-4、IL-10表达的影响(±s , n=10)Table 7 The effects of the total lignans from Tibetan Medicinal Herpetospermum Seeds on the express of IL-4and IL-10 in liver of liver injury mice induced by ConA(±s , n=10)
与模型组比较, * p<0.05, ** p<0.01.
等:川西獐牙菜多糖的提取及含量测定组别 剂量/g·kg-1IL-4 IL-10空白 - 0.2614±0.0122 0.2596±0.0058**模型 - 0.2799±0.0149 0.2471±0.0021联苯双酯 0.2 0.2618±0.0065 0.2562±0.0076*复方甘草酸苷片 0.113 0.2752±0.0090 0.2555±0.0068*波棱瓜子木脂素 0.375 0.2713±0.0148 0.2525±0.0099 0.75 0.2735±0.0155 0.2512±0.0056 1.5 0.2547±0.0101 0.2513±0.0065 3 0.2665±0.0295 0.2559±0.0056*
2.8 对小鼠IL-4、IL-10表达的影响
与空白组比较, 模型组小鼠肝组织中IL-4表达水平明显升高, IL-10表达水平明显降低(p<0.01). 与模型组比较, 波棱瓜子总木脂素能明显或部分降低IL-4表达, 升高IL-10表达(p<0.05), 显示出一定的抗炎作用. 结果见表7和图5-6.
3 讨论
肝脏是含酶丰富的脏器, 一旦肝细胞受损, 其胞浆中所含的各种酶可进入血液, 如ALT、AST、ALP等. 通过检测血清中上述酶的活性, 可反映肝细胞受损情况. 本研究采用ConA致免疫性肝损伤动物模型对波棱瓜子总木脂素进行药效筛选, 结果表明, 波棱瓜子总木脂素能显著降低小鼠血清中丙氨酸氨基转移酶ALT、门冬氨酸氨基转移酶AST、碱性磷酸酶ALP水平, 纠正肝脏系数的变化, 提示波棱瓜子总木脂素对ConA致免疫性肝损伤有保护作用. 病理检查结果表明, 波棱瓜子总木脂素能够改善免疫性肝损伤肝脏组织病理学变化和肝脏组织炎症. 其保护作用可能与阻止肝实质细胞膜通透性改变, 肝细胞的破损、坏死和程序性死亡有关.
研究表明, 肝脏损伤过程伴随着严重的氧化应激反应. 其中, NO是体内典型的自由基, 充当神经递质、抑制血小扳聚集、介导免疫反应等功能, 是体内高效的气体传递调节递质. 免疫性等各种原因导致的肝损伤时, 肝细胞、枯否细胞合成NO增多, 活性氧的生成超过清除, 肝脏处于氧化应激状态. 实验显示, 波棱瓜子总木脂素能显著降低血清NO含量和抑制与之相关的NOS的活力, 通过减弱NO过度表达而保护肝脏. MPO则是氧化应激的重要介质, 能介导炎性反应、调节免疫应答, 是中性粒细胞释放的重要的过氧化物酶类, 通过释放活性氧和其它毒性物质造成组织损伤. ConA经尾静脉注射可使MPO明显升高, 表明肝脏组织炎症反应十分明显. 给予波棱瓜子
总木脂素可以降低ConA导致的MPO过高水平, 减少炎性细胞浸润, 起到抗氧化损伤作用. 过高的自由基还可直接攻击细胞膜脂质成分, 生成脂质过氧化产物. 其中MDA的含量高低与自由基损伤程度密切相关, 能增加细胞膜通透性, 造成生理功能紊乱, 导致肝细胞肿胀、坏死, 可反映机体脂质过氧化程度. SOD和GSH-Px是评定抗氧化水平主要观察的生物化学指标. SOD是体内一种非常重要的抗氧化酶和氧自由基清除剂, 可催化超氧阴离子的歧化反应, 其活性与清除超氧自由基能力成正相关, 可减轻肝细胞的损伤, 对维持体内过氧化物平衡起重要作用. GSH-Px广泛存在于机体内, 是重要的过氧化物分解酶, 它可以催化脂质过氧化物的还原, 阻断脂质过氧化反应, 起到保护细胞膜的作用[12-17]. 本实验中ConA损伤肝脏, 导致肝组织中MDA含量异常升高, SOD和GSH-Px活性减弱. 连续给予波棱瓜子总木脂素7d, 可降低肝组织中MDA含量, 增强SOD和GSH-Px活性, 说明波棱瓜子总木脂素可能通过保护肝细胞膜, 清除自由基, 抑制脂质过氧化发挥其保护肝脏的作用.
在免疫性肝损伤中, 各种炎症因子发挥着至关重要的作用. 虽然早期炎症反应有助于宿主清除病原微生物;然而, 过度的炎症反应对于宿主而言是一种极为有害的应激反应. 在本研究所采用的ConA所致肝损伤中, 各类炎症因子发挥至关重要的作用, 而早期肝细胞损害与细胞因子作用有关, 在淋巴细胞浸润前, 即已出现相关细胞因子的峰值. TNF-α、IFN-γ是参与该疾病模型最重要的细胞因子, 亦是是引起急、慢性肝损伤的重要因素之一. TNF-α是一种由活化的T细胞、NKT细胞及Kupffer细胞分泌的多效促炎性细胞因子的产物, 能激活T, B淋巴细胞,增加自然杀伤细胞的杀伤能力, 也能够激活NF-κB信号转导途径, 引起各种炎症因子的释放, 直接或间接引起肝细胞的免疫损伤. 干扰素IFN-γ是由Th1细胞及NK细胞所分泌的巨噬细胞激活剂, 能增加巨噬细胞吞噬能力, 刺激细胞释放氧化因子和TNF-α, 诱导Fas激活肝细胞的程序性死亡[18-25]. NF-κB能诱导与免疫和炎症有关的多种细胞因子和粘附分子的表达, 是炎症反应的上游环节, 在免疫性肝损伤病理生理过程中高表达, 控制早期基因表达, 引起下游调控基因激活, 参与了肝损伤的发生和发展, 干预疾病过程, 影响机体的免疫应答、炎症反应、氧化应激、细胞凋亡过程[26]. IL-4是NKT细胞分泌产生, 通过自分泌进一步增加NKT细胞对肝脏细胞的细胞毒作用. IL-10是免疫抑制剂, 是抗炎性细胞因子, 对肝脏具有保护作用. 本实验的研究结果显示, 波棱瓜子总木脂素能够促进抗炎性细胞因子IL-10的表达, 抑制IFN-γ、IL-4的过强表达, 减少TNF-α生成, 抑制NF-κB信号途径的激活, 减少后续炎症因子的释放, 减轻肝细胞的损伤.
综上所述, 波棱瓜子总木脂素连续给药能够降低ConA所致免疫性肝损伤小鼠血清酶活力升高, 改善肝脏病理损伤如炎症、出血及坏死, 对免疫性肝损伤表现出一定的保护作用, 其机制与抗氧化应激、抗炎作用有关.
[1] 王薇, 孙公凯, 杨世忠. 慢性乙型肝炎的现代研究进展[J]. 海南医学院学报, 2011,17(6): 861-864.
[2] 帝玛尔, 丹增彭措. 晶珠本草[M]. 王继祖, 罗达尚, 王振华等译. 上海: 上海科学技术出版社, 1986.
[3] 张洪彬. 波棱瓜子抗肝损伤有效部位化学成分及其活性研究[D]. 成都: 成都中医药大学, 2007.
[4] 李隆云, 德吉拉姆, 卫莹芳, 等. 藏药波棱瓜子的文献查考[J]. 中国中药杂志, 2005, 30(12): 893-894.
[5] 谭睿, 石雪蓉. 藏药色吉美多对小鼠实验性肝损伤的保护作用. 中草药, 2005, 36(4): 576-577.
[6] 丛龙波, 王琪, 李仙义, 等. 藏药波棱瓜子抗肝炎药效物质基础研究[J]. 医学研究杂志, 2007, 36(8): 75-76.
[7] 张梅. 藏药波棱瓜子治疗肝病有效成分的研究[D]. 成都: 成都中医药大学, 2003.
[8] BULAU AM,FINK M,MAUCKSCH C, et al. In vivo expression of interleukin-37 reduces local and systemic inflammation in concanaval- inA-induced hepatitis[J]. Scientific World Journal, 2011, 11: 2480- 2490 .
[9] LIN LIUYH, LISL, et al. Protective role of synthetic oligo deoxy nucleotides expressing immuno suppressive TTAGGG motifs in ConcanavalinA-induced hepatitis[J]. Immunol Lett, 2013, 151(1): 54-60.
[10] 杨涛. JBP485对ConA诱导小鼠自身免疫性肝损伤的保护作用[D]. 大连: 大连医科大学, 2008.
[11] WOLF D,HALLMANN R,SASS G, et al.TNF-alpha-induced expression of adhesion molecules in the liver is under the control of TNFR1--relevance for concanavalin A-induced hepatitis[J]. J Immunol, 2001, 166(2): 1300-1307.
[12] TU CT,HAN B,LIU HC, et al.Curcumin protects mice against concanavalinA-induced hepatitis by inhibiting intrahepatic intercellular adhesion molecule-1 (ICAM-1) and CXCL10 expression[J].Mol Cell Biochem, 2011, 358(1-2): 53-60.
[13] LU JW,WANG H,YAN-LI J,et al. Differential effects of pyrrolidine dithiocarbamate on TNF-alpha - mediated liver injury in two different models of fulminant hepatitis[J]. J Hepatol, 2008, 48 (3): 442-452.
[14] DENIS M,BUDDLE BM.Bovine dendritic cells are more permissive for Mycobacterium bovis replication than macrophages,but release more IL-12 and induce better immune T-cell proliferation[J].Immunol Cell Biol, 2008, 86(2): 185-91.
[15] YAMASHITAJ, IWAMURA C, SASAKI T, et al. Apoli poproteinA-II suppressed concanavalinA-induced hepatitis via the inhibition of CD4 T cell function[J]. J Immunol, 2011, 186 (6): 3410-3420.
[16] AL-SHAMSI M,SHAHIN A,MENSAH-BROWN EP,et al. Derangements of liver tissue Bioenergetics in ConcanavalinA-induced hepatitis[J]. BMC Gastroenterol, 2013, 13(1): 6-10.
[17] TU CT,YAO QY,XU BL,et al. Curcumin Protects Against ConcanavalinA-Induced Hepatitis in Mice Through Inhibiting the Cytoplasmic Translocation and Expression of High Mobility Group Box 1[J]. Inflammation, 2013, 36(1): 206-215.
[18] 张引强.中药荣肝合剂对刀豆蛋白A介导的免疫性肝损伤降酶效应的机制研究[D]. 北京: 中国中医科学院, 2010.
[19] CAO L,ZOU Y,ZHU J, et al. Ginsenoside Rg1 attenuates concanavalinA-induced hepatitis in mice through inhibition of cytokine secretion and lymphocyte infiltration[J].Molecular and Cellular Biochemistry, 2013, 380(1-2): 203-210.
[20] HATANO M,SASAKI S, OHATA S,et al. Effects of Kupffer cell-depletion on ConcanavalinA-induced hepatitis [J]. Cell Immunol, 2008, 251 (1): 25-30.
[21] MOHAMED DI,ELMELEGY AA,EL-AZIZ LF,et al.Fenofibrate A peroxisome proliferator activated receptor-α agonist treatment ameliorates ConcanavalinA-induced hepatitis in rats[J]. Eur J Pharmacol, 2013, 721 :35-42.
[22] KELLEY KW,DANTZER R. Alcoholism and inflammation:neuroimmunology of behavioral and mood disorders[J]. Brain Behav Immun, 2011, 25(11): 13-20.
[23] TAKASHIMA K,MATSUNAGA N,YOSHIMATSU M, et al.Analysis of binding site for the novel small-molecule TLR4 signal transduction inhibitor TAK-242 and its therapeutic effect on mouse sepsis model[J].Br J Pharmacol,2009,157(7): 1250-1262.
[24] 李晓冬, 李俊, 李荣, 等. 橙皮苷对刀豆蛋白A致小鼠免疫性肝损伤的保护作用[J].安徽医科大学学报, 2010, 45(3): 350-353.
[25] 金娟, 许建明, 刘晓昌,等.异甘草酸镁对刀豆蛋白A诱导的小鼠免疫性肝损伤的保护作用[J]. 中华肝脏病杂志, 2009, 17(5): 389-390.
[26] 秦金东, 薛永志. NF-κB在免疫性肝损伤中的研究进展[J]. 包头医学院学报, 2011, 27(3): 119-121.
The protective effect and its mechanism of total Lignans from Tibetan medicinal Herpetospermum Seeds on Concanavalin A-induced liver injury in mice
GU Jian, LI Jia-chuan, FAN Li-na
(Southwest University for Nationalities, Chengdu 610041, P.R.C.)
Objective:To investigate the protection effect and mechanism of the total Lignans from Tibetan MedicinalHerpetospermumSeeds on immunologic liver injury induced by ConA.Methods:Immunologic liver injury was induced by a single intravenous injection of ConA (20mg/kg). Then animals were sacrificed at the 8h post-injection, blood samples and liver were collected. Subsequently, organ index of liver, and biochemical parameters, such as ALT, AST, ALP, NO, NOS, MPO in serum and SOD, MDA, GSH-Px in liver tissue were evaluated. The pathological changes of the liver tissue were measured by HE staining. Finally, the expressions of TNF-α, IFN-γ, IL-4, IL-10, NF-κB were tested with immunohistochemical method.
Herpetospermum seed; Hepatoprotective; concanavalin A; anti-inflammatory; anti-oxidant
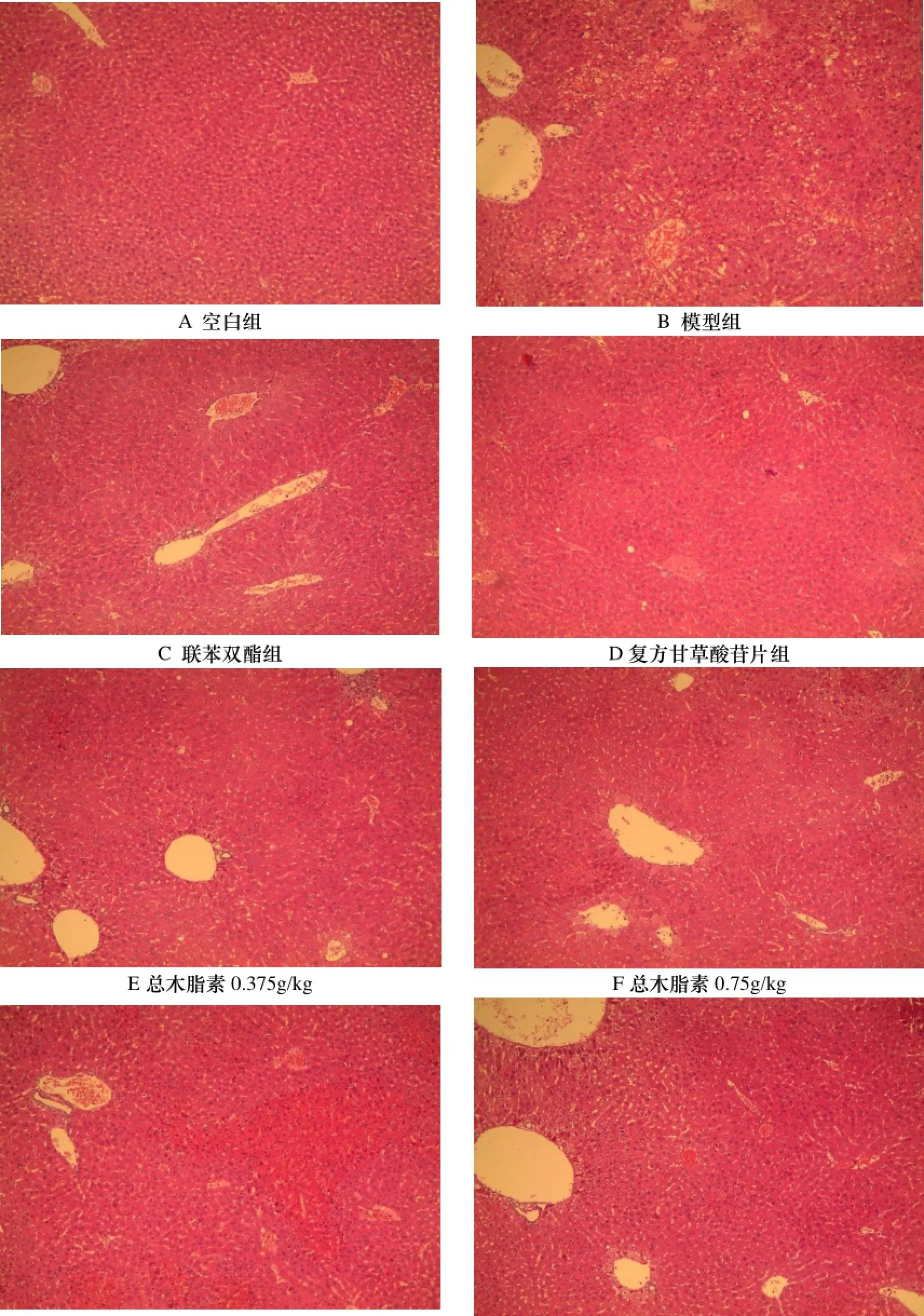
图1 对ConA致免疫性肝损伤小鼠肝组织病理学影响(HE, ×100)Figure 1 The effects on the histopathologyof immunologic liver injury mice induced by ConA(HE, ×100)

图2 对ConA致免疫性肝损伤小鼠肝组织肿瘤坏死因子-α(TNF-α)的影响Figure 2 The effects on theTNF-α of immunologic liver injury mice induced by ConA
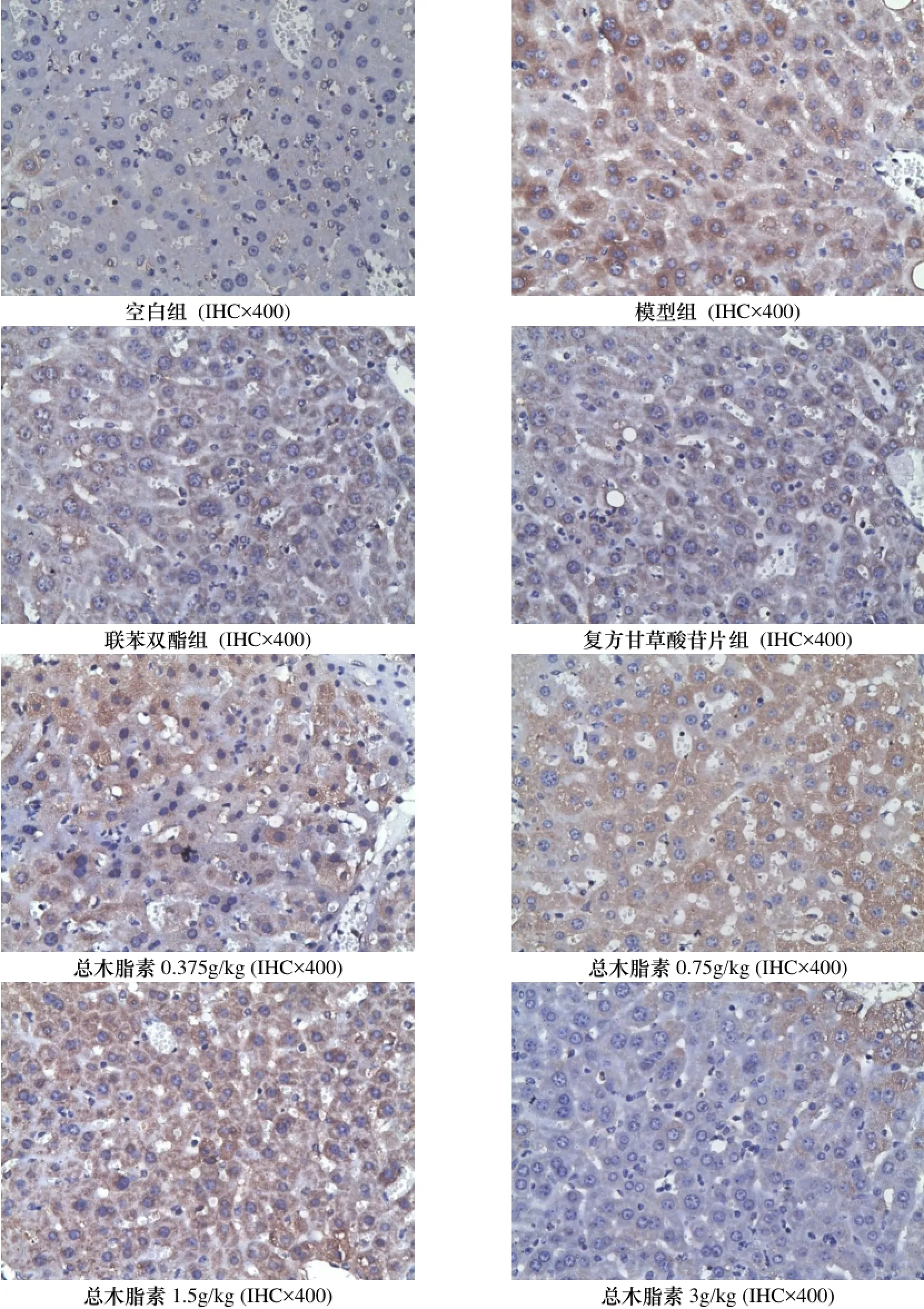
图3 对ConA致免疫性肝损伤小鼠肝组织干扰素-γ(IFN-γ)的影响Figure 3 The effects on the liverIFN-γ of immunologic liver injury mice induced by ConA
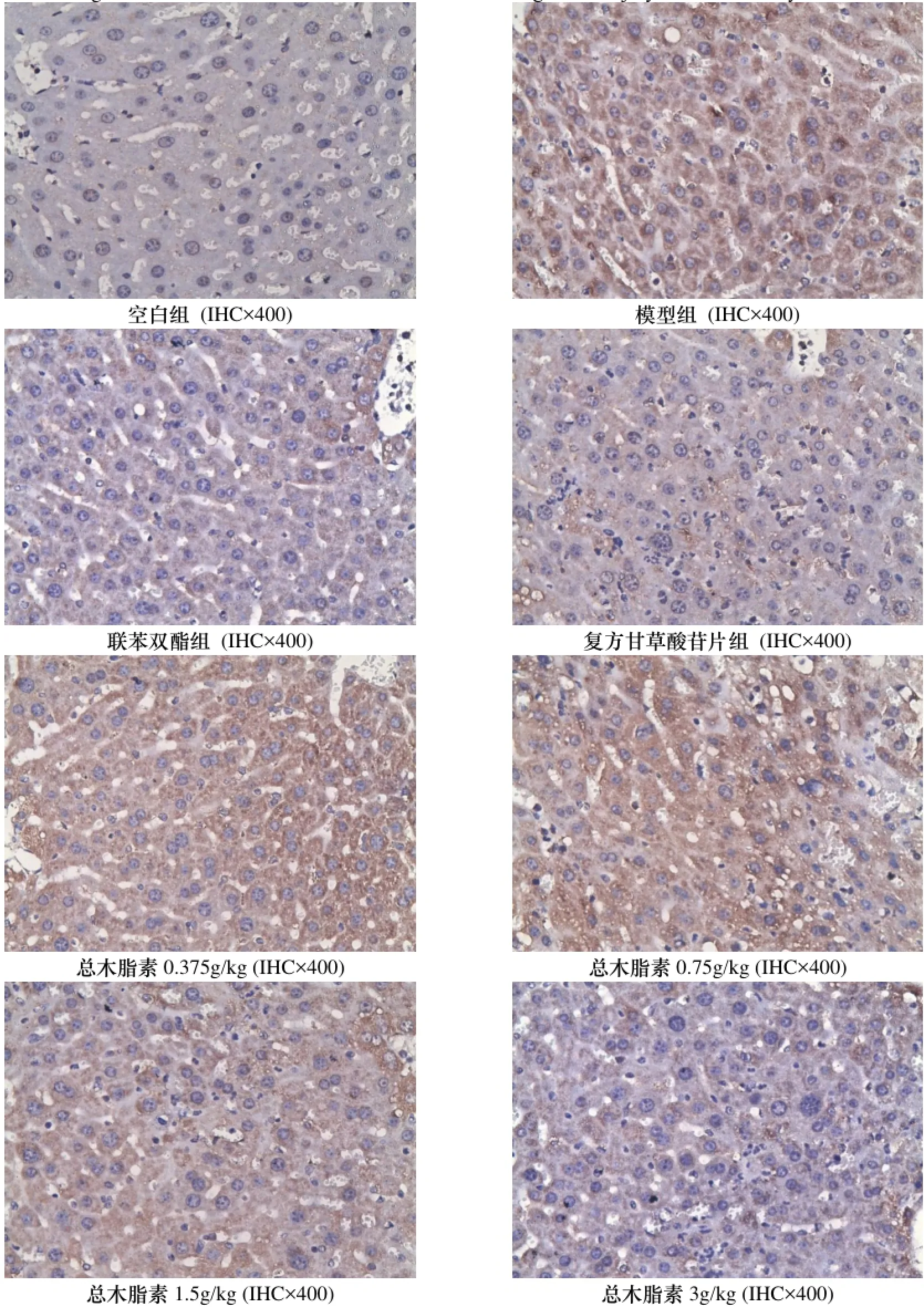
图4 对ConA致免疫性肝损伤小鼠肝组织细胞核转录因子(NF-κB)的影响Figure 4 The effects on the liver NF-κB of immunologic liver injury mice induced by ConA
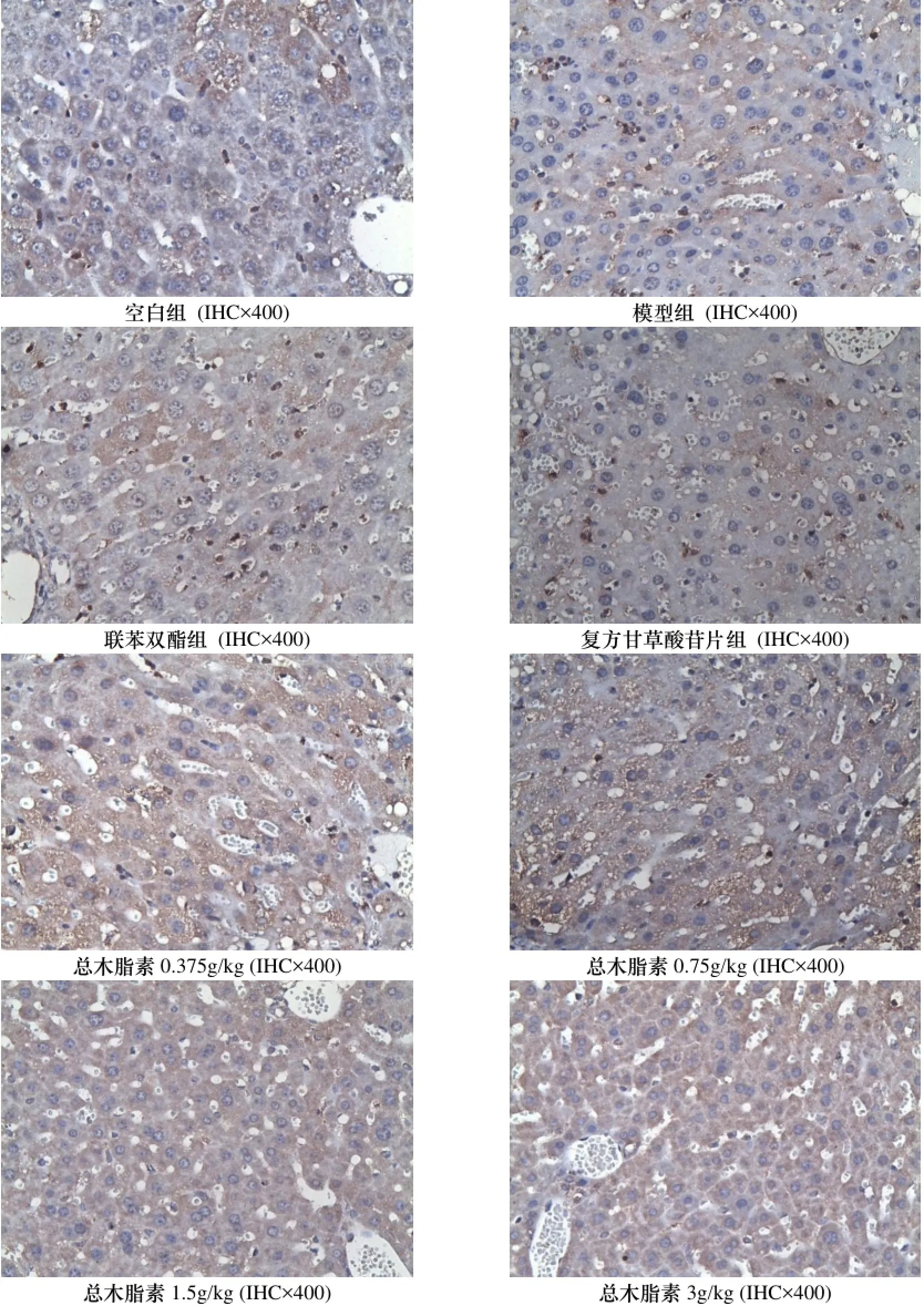
图5 对ConA致免疫性肝损伤小鼠肝组织白介素4(Il-4)的影响Figure 5 The effects on the liverIL-4 of immunologic liver injury mice induced by ConA

图6 对ConA致免疫性肝损伤小鼠肝组织白介素10(Il-10)的影响Figure 6 The effects on the liverIL-10 of immunologic liver injury mice induced by ConA
R28; R29
: A
: 1003-4271(2014)03-0375-13
10.3969/j.issn.1003-4271.2014.03.10
2014-04-04
顾健(1967-), 男, 汉族, 浙江武义人, 教授, 博士, 研究生导师, 研究方向: 民族药物及中药研究与开发. E-mail:gujiancd@163.com.
国家自然科学基金(81674168); 四川省科学技术厅科技攻关项目(2011 FZ0053); 四川省应用基础研究项目(2012JY0027)资助.
Results:The total Lignans could reduce serum activities of ALT, AST, ALP, NOS, MPO and serum levels of NO. Meanwhile, lower serum levels of MDA and elevated activities of SOD and GSH-Px were observed in total Lignans treated liver injury mice. Furthermore, total Lignans significantly reduced the expressions of TNF-α, IFN-γ, IL-4 and NF-κB, and increased the expressions of IL-10. Pathological results also showed that the total Lignans could attenuate ConA-induced liver damage.Conclusion:The total Lignans from Tibetan MedicinalHerpetospermumSeeds have a certain Hepatoprotective effect on ConA-induced immunological liver injury in mice, which may be related its anti-oxidant and anti-inflammatory effects.
