贵州白香猪γ-干扰素真核表达质粒的构建
2014-02-15王伟丞梁海英曾智勇汤德元
王伟丞,梁海英,曾智勇*,汤德元,刘 钊
(1.贵州大学动物科学学院,贵阳 550025;2.贵州大学教学实验场,贵阳 550025)
γ-干 扰 素 (interferon-gamma,IFN-γ)是由激活的T细胞和NK细胞产生的具有抗病毒、抗肿瘤、调节细胞生长和免疫功能的分泌型细胞因子[1-2]。IFN-γ具有激活NK细胞Th 1系列的辅助性T细胞以及CD8+T细胞等功能,因而也称为“免疫干扰素”。许多研究表明IFN-γ不仅能有效抑制病毒增殖且在细胞免疫中也起到重要的作用,具有较好的临床应用前景[3]。随着对IFN-γ功能研究的深入,目前国内也有对猪的γ-干扰素基因研究,但是对纯种猪特别是地方纯种猪γ-干扰素的研究还比较少。本研究在已构建好的含有贵州白香猪γ-干扰素基因的pMD-GZ-IFN-γ质粒基础上,构建其真核表达质粒,为研发新型抗病毒制剂和疫苗佐剂,以及贵州白香猪的疾病防控奠定基础。
1 材料与方法
1.1 质粒与菌株
pMD-GZ-IFN-γ(由贵州省动物疫病研究室构建保存);pMD19-T Simple Vector〔购自宝生物工程(大连)有限公司〕;真核表达载体pcDNA3.1(+)(购自Invitrogen公司);大肠杆菌感受态TOP10(贵州省动物疫病研究室制备和保存)。
1.2 主要试剂
限制性内切酶BamHⅠ和EcoRⅠ购自宝生物工程(大连)有限公司;E.Z.N.A.TM Gel Extraction Kit(50)胶回收试剂盒购自OMEGA公司;普通质粒小提试剂盒为TIANGEN公司产品;其他化学试剂均为国产分析纯。
1.3 引物的设计与合成
根据阳性质粒pMD-GZ-IFN-γ设计一对特异性引物P1和P2,分别在其两端引入BamHⅠ和EcoRⅠ酶切位点,扩增用于表达的IFN-γ基因片段。
P1:5-CGGGATCCATGAGTTA TACAACTT-3;
P2:5-CGGAATTCTTATTTTG ATGCTCT-3。
为了便于克隆,分别在其两端引入BamHⅠ和EcoRⅠ酶切位点(划线部分)预期扩增大小为520 bp。引物由宝生物工程(大连)有限公司合成。
1.4 IFN-γ基因PCR扩增
以pMD-GZ-IFN-γ质粒DNA为模版,用引物P1和P2进行IFN-γ基因扩增。PCR反应体系:pMD-GZIFN-γ1 μL,上下游引物各 2 μL,2×Taq PCR Mastermixture25 μL,ddH2O 0.5 μL。按以下条件进行反应:94 ℃ 5 min;94 ℃ 30 s,53 ℃ 30 s,72 ℃ 30 s,35cycles;72 ℃ 10 min。
扩增产物经1%琼脂糖凝胶电泳检测。
1.5 克隆质粒的构建
将回收纯化的PCR产物与pMD19-T Simple Vector载体按常规方法进行连接并转化感受态细胞TOP10。挑取白色菌落进行增菌培养,小剂量试剂盒提取质粒DNA,用质粒PCR和酶切分别进行鉴定,并将阳性克隆质粒送宝生物工程(大连)有限公司测序,命名为pMD19-IFN-γ。
1.6 真核表达质粒的构建
用限制性内切酶BamHⅠ和EcoRⅠ对pMD19-IFN-γ测序质粒及载体pcDNA3.1(+)分别进酶切,回收纯化目的片段,将二者用T4 DNA连接酶于16 ℃连接过夜,连接产物转化TOP10感受态细胞,提取重组质粒pcDNA3.1(+)-IFN-γ,分别进行双酶切及质粒PCR鉴定后,并送宝生物工程(大连)有限公司测序。
2 结果
2.1 目的基因的扩增
以pMD-GZ-IFN-γ阳性质粒为模板,用设计的特异性引物进行PCR扩增IFN-γ基因,所获得的PCR产物经1%琼脂糖凝胶电泳呈单一条带,大小与预期片段520 bp相符(图1)。
2.2 克隆质粒pMD19-IFN-γ的鉴定
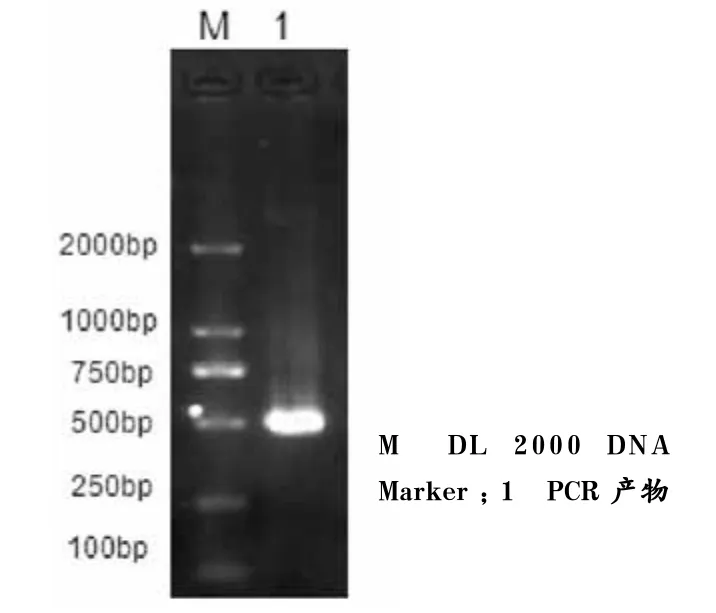
图1 IFN-γ的PCR扩增产物

图2 pMD19-IFN-γ的鉴定结果
重组质粒pMD19-IFN-γ经双酶切和PCR鉴定,均获得大小约520 bp的与预期片段大小一致的DNA片段(图2)。
2.3 真核表达质粒pcDNA3.1(+)-IFN-γ的鉴定
p c D N A 3.1(+)-I F N-γ经BamHⅠ和EcoRⅠ酶切后,在琼脂糖凝胶电泳中出现2条大小分别为5 400 bp和520 bp的目的DNA片段;以pcDNA3.1(+)-IFN-γ为模版,经PCR扩增,在琼脂糖凝胶电泳中出现一条大小约520 bp的条带(图3)。
由pcDNA3.1(+)-IFN-γ重组质粒DNA测序结果可知,IFN-γ基因已亚克隆至pcDNA3.1(+)真核表达载体中,其开放阅读框为501 bp,可编码166个氨基酸,该序列与pMD-GZIFN-γ中IFN-γ序列(GenBank登录号:JF906510)完全一致。

图3 pcDNA3.1(+)-IFN-γ的鉴定结果
3 讨论
干扰素是由细胞分泌的一类具有广谱抗病毒、免疫调节等多种生物学功能的新型药物,应用前景较为广泛,主要着重于调节机体免疫功能,且其副作用少,因而在多种疾病的治疗上具有传统药物所不可替代的作用。干扰素还具有疫苗佐剂的作用,其不仅能特异性的增强疫苗的免疫效果,而且还可增强机体抗感染的能力[4]。
近年来,国内不断有用基因工程技术表达γ-干扰素的报道。娄忠子等构建了IFN-γ原核表达系统并在大肠杆菌系统实现了高效表达[5]。姚清侠等运用腺病毒载体,通过同源重组,首次成功研制了携带猪γ-干扰素的重组腺病毒[6]。目前基因工程生产细胞因子主要有原核表达系统和真核表达系统2种,因真核表达系统可以实现目的蛋白的分泌表达,且表达的蛋白不需要修饰,具有生物活性,而原核表达系统表达的目的蛋白常以包涵体形式存在,且翻译后加工修饰不完善,影响蛋白生物活性,所以真核表达系统产生细胞因子越来越受到重视[7]。
本研究中采用的pcDNA3.1(+)真核表达载体,携带有CMV强启动子,能够携带外源基因在哺乳动物细胞中高效转录表达。对pcDNA3.1(+)-IFN-γ质粒的测序表明,γ-干扰素基因已亚克隆至pcDNA3.1(+)中,成功构建了γ-干扰素真核表达载体,为IFN-γ基因的真核表达研究奠定了基础。
[1] 曾智勇,周莉,刘志杰,等. 贵州白香猪γ干扰素基因的克隆与序列分析[J].贵 州 农 业 科 学, 2012,40 (08): 151-153.
[2] 杨生海,殷宏,刘永生,等. 干扰素-γ研究进展[J]. 生物技术通报 ,2010(08):29-34.
[3] 夏伦斌,王新华,连宏军,等. γ干扰素及其在动物疾病防控中的应用[J]. 动物医学进展 ,2007,28(05):74-78.
[4] 温纳相,陈瑞爱,裴仉福,等. 新兴猪γ-干扰素基因克隆及其真核表达质粒的构建 [J]. 动物医学进展, 2005, 26(09):74-77.
[5] 娄忠子,兰喜,李建强,等. 猪γ-干扰素的克隆表达及单抗的潜在应用[J].生物技术通报,2010(01): 173-179.
[6] 姚清侠,徐卓菲,何雁南,等. 表达猪γ干扰素的重组腺病毒的构建和活性鉴定 [J]. 病毒学报, 2007, 24(05): 394-398.
[7] 肖红冉,王大伟,贺志锐,等. 猪α干扰素在BHK-21细胞中的表达与生物活性分析[J]. 石河子大学学报:自然科学版 ,2013, 31(02):182-186.
