低温胁迫小麦苗在小麦苗汁冰淇淋中的应用
2014-02-13焦宇知翟玮玮
焦宇知,翟玮玮
(1.江苏食品药品职业技术学院,江苏 淮安 223003;2.普渡大学西拉法叶校区,美国 西拉法叶 47907)
冷冻是食品工业中广泛使用的食品加工和贮藏方式。在食品后续加工或运输过程中,由于环境变化,冷冻食品极易出现不可控的反复冻融和重结晶,从而导致食品发生不期望且不可逆变化,如细胞膜破坏和解冻后持水能力下降等[1]。而动植物活体在低温条件下会产生特殊蛋白,被称为抗冻蛋白、醣蛋白和冰结构蛋白,具有抑制冰晶生长和重结晶的功能[2-9]。麦苗作为一种营养价值高、廉价且资源丰富的植物,对其低温胁迫诱导产生具有抑制重结晶的蛋白质在国外已有较多公开报道[1,10-14],如冬麦苗经低温胁迫后产生能显著抑制果糖溶液重结晶。但由于麦种和生长环境的不同,低温胁迫下麦苗的性质变化差异性很大。本研究拟以淮麦19为麦种,对发芽后的麦苗低温胁迫,并用其制备小麦苗冰淇淋,考察了低温胁迫对小麦苗汁(cold-acclimated wheat seedlings extract,AWSE)抑制热休克冰淇淋重结晶能力的影响,为小麦苗的深度开发和应用提供参考。
1 材料与方法
1.1 材料与试剂
淮麦19 淮安市农科院;奶油、绵白糖、玉米糖浆、单甘酯、脱脂奶粉 上海光明乳业股份有限公司;链霉蛋白酶E(活性4 000 U/g) 美国Sigma公司;其他试剂均为分析纯。
1.2 仪器与设备
GTOP-158D光照培养箱 浙江托普仪器有限公司;DW-86L288超低温冰箱 海尔公司;CX41显微镜(配绿色滤光片)、DP20成像系统(配DP2-BSW图像分析软件)奥林巴斯株式会社;HCS410显微镜冷热台 美国Instec公司; GL-20G-II高速冷冻离心机 上海安亭科学仪器厂。
1.3 方法
1.3.1 小麦苗低温胁迫[15]
以淮麦19为实验材料,麦种经10%(V/V)的次氯酸钠溶液表面消毒10 min后,用灭菌蒸馏水清洗3 次,5 mmol/L的硝酸钙溶液中浸泡3 h后置于光照培养箱中,采用营养液培育,培养液由945 mg/L Ca(NO3)2·4H2O、506 mg/L KNO3、80 mg/L NH4NO3、136 mg/L KH2PO4、493 mg/L MgSO4、13.9 mg/L FeSO4·7H2O、18.65 mg/L Na2-EDTA、4.15 µg/L KI、31 µg/L H3BO3、111.5 µg/L MnSO4、0.125 µg/L CuSO4、43 µg/L ZnSO4、1.25 µg/L Na2MoO4、0.125 µg/L CoCl2和水组成[16],使用前稀释20 倍并调节培养液pH值至6.9。小麦发芽条件为:每天白天25 ℃,LED人工光源光照12 h,强度为5 000 lx,夜间22 ℃、12 h,湿度控制在65%左右。待发芽1~2 cm后,改变光照强度至30 000 lx,其他条件不变。长至一叶一心后,降低温度分别至10、8、6、4 ℃进行低温胁迫处理不同时间(24、48、72、96 h),昼夜温度一致,低温胁迫后立即取叶片(长度8~10 cm)。以未低温胁迫处理麦苗作为对照(除4 ℃低温胁迫后麦苗生长明显减缓外,其他胁迫温度条件下长势无明显变化)。
1.3.2 AWSE的制备
小麦苗清洗后,采用0.5%(V/V)的过氧乙酸浸泡5 min消毒,洗净后浸入1 g/100 mL食盐水,漂洗后投入0.2 g/100 mL的VC溶液中的比例30 min,再洗净,按每100 g小麦苗加入15 g左右水的比例打浆,打浆过程中加入0.5 g/100 mL的VC,4 ℃、13 000 r/min冷冻离心2 次,各5 min,得澄清小麦苗汁、4 ℃冷藏备用。麦苗汁中可溶性蛋白质含量采用考马斯亮蓝法检测[17]。
1.3.3 小麦苗汁冰淇淋制作工艺
冰淇淋的基本配方如表1所示。
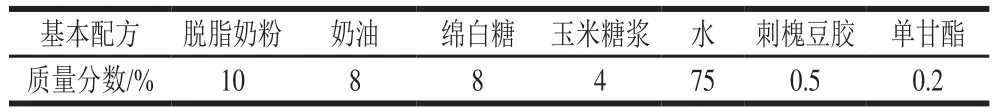
表1 冰淇淋基本配方Table 1 Ice cream formula
刺槐豆胶和5 倍质量的绵白糖混匀,加水溶解。将剩余绵白糖和玉米糖浆搅拌溶解后加入奶粉,溶解后加热至80 ℃,再加入刺槐豆胶稳定剂溶液、单甘酯和奶油,保温30 min后于高压均质机下80 ℃均质15 min,一级均质压力18 MPa, 二级均质压力4 MPa。均质后加入麦苗汁,冰淇淋浆料于4 ℃冰箱中老化4 h后,在冰淇淋机中-4~-2 ℃条件下冷凝14 min。-35 ℃硬化24 h以上[18]。
1.3.4 冰淇淋的热休克处理和冰晶大小的检测[14]
硬化后的冰淇淋放置于程序制冷器中,待冰淇淋升温至-20 ℃后进行热休克处理,冰淇淋在程序制冷器中以1.67 ℃/h速度加热升温至-10 ℃,保温42 h后,再以1.67 ℃/h速度冷却至-20 ℃,保温42 h,共计96 h,为一个周期,重复该周期共8 次。每周期始末采用带有照相机的显微镜检测冰晶块大小:将待测样品移至-24 ℃制冷器中,用已预冷的刀片从中心部位取一小片冰淇淋铺展于显微镜载玻片上,滴一滴已预冷至-24 ℃的异丁醇以遮盖脂肪相,盖上盖片。将载玻片迅速移至-18 ℃ 的显微镜冷热台,对不同热休克周期始末的实验组与对照组进行拍照,由奥林巴斯DP2-BSW软件分析图像冰晶大小,采集至少3 个区域的300 个冰晶。采用logistic剂量反应模型(SPSS 20.1)得到冰晶大小累积分布模型(以冰晶直径计),冰晶大小均值X50按该模型达到50%累积分布的理论拟合冰晶直径的中间值计。
冰晶大小增长百分比(ice crystal growth power,IGP)是指热休克处理周期末与周期始相比X50值增加百分比:
计算公式如下[18]:
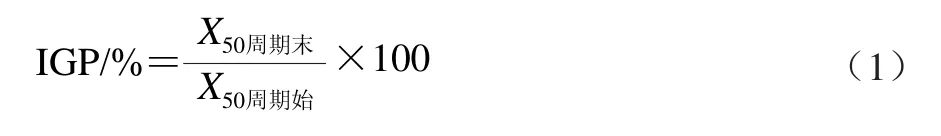
AWSE抑制冰晶重结晶能力(ice crystal inhibition power,ICP)是指与添加参照物质(水、NAWSE)相比,AWSE降低IGP的百分比,计算公式为[18]:
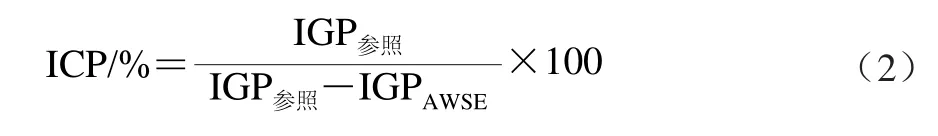
1.3.5 AWSE中可溶性蛋白对冰淇淋重结晶作用的影响
取6 ℃低温胁迫48 h后小麦苗,按1.3.2节方法制备得到的AWSE 50 mL,加入2.5 mg链霉菌蛋白酶用以水解AWSE中的蛋白,以考察蛋白水解后AWSE对冰淇淋重结晶作用的影响。37 ℃保温水解10 h后,4 ℃条件下,13 000 r/min离心10 min(两次),得到酶处理后小麦苗汁(pronase E treated cold-acclimated wheat seedings extract,ETAWSE)[19]。按照1.3.3节的方法制作小麦苗汁冰淇淋,小麦苗汁添加量为10%(m/m),混合液总体积不变。与未添加AWSE、添加未低温胁迫小麦苗提取液(non-cold-acclimated wheat seedlings extract,NAWSE)、ETAWSE所得冰淇淋比较,分析冰淇淋热休克处理始末冰晶大小的变化。改变AWSE添加量分别为2.5%、5%、10%、15%、20%、25%,考察AWSE添加量对冰淇淋重结晶抑制作用的影响。
1.3.6 温度胁迫下AWSE对冰淇淋重结晶的作用
按照1.3.1节的方法对小麦苗进行低温胁迫,胁迫温度分别为10、8、6、4 ℃。低温胁迫时间设定为24 h,其他同1.3.5节。
1.3.7 时间胁迫下AWSE对冰淇淋重结晶的作用
按照1.3.1节的方法对小麦苗进行低温胁迫,低温胁迫时间分别为24、48、72、96 h。胁迫温度设定为6 ℃,其他同1.3.5节。
1.3.8 热休克处理频率胁迫下AWSE对冰淇淋重结晶的作用
按照1.3.4节的方法进行热休克处理,频率为-20 ℃和-10 ℃各24、48 h和96、192 h,其他条件不变,总时间保持32 d,其他同1.3.5节。
1.4 数据处理
所有实验都重复3次,采用IBM SPSS 20和Origin Pro 8对数据进行数据差异显著性分析和作图。
2 结果与分析
2.1 低温胁迫处理对小麦苗汁蛋白质含量的影响

表2 不同低温胁迫处理温度和时间后小麦苗汁中可溶性蛋白质质量浓度Table 2 Changes in soluble protein contents in AWSE after chilling stress at different temperatures for different durations
由表2可知,与未胁迫组相比,低温胁迫处理后,AWSE中可溶性蛋白质的含量显著上升(P<0.05),且随着温度的下降和时间的延长,可溶性蛋白质含量上升明显。原因可能是,低温逆境条件下,蛋白质作为植物细胞的保护物质,可通过调节渗透浓度来启动脱落酸形成,从而诱发新的蛋白质合成用以增加抗寒性,胁迫温度越低和时间越长,逆境条件越恶劣,从而诱导合成的蛋白质越多[12]。
2.2 低温胁迫对AWSE抑制冰淇淋重结晶作用的影响

图1 冰淇淋热休克处理8 周期始末的均冰晶大小Fig.1 Comparison of mean ice crystal sizes of ice cream before and after 8 heat shock cycles
在食品混合体系中,冰晶生长受大分子逆向扩散和热能释放速率共同影响,加快逆向扩散和热移除,冰晶生长随之加快[20]。从图1可以看出,热休克处理开始前,添加AWSE、NAWSE和ETAWSE冰淇淋的冰晶明显小于未添加AWSE的冰淇淋(P<0.05),原因可能是:由于未添加小麦苗汁,冰淇淋冷冻前水分含量高于其他样品,导致冰淇淋冰相体积增加、黏度和离子强度降低,从而硬化时温度转换速率增加,热移除速度较快,从而加速了冰晶增长[21]。而其他3者中含有更多大分子,这些大分子需要先转移到冰晶表面,然后定向分散并吸附到冰晶溶液交界面,这使得大分子的扩散速度降低,从而降低了冰晶增长速率。
冰淇淋经8个周期的热休克处理后,添加AWSE的冰淇淋冰晶明显小于添加NAWSE组(P<0.05),说明冷胁迫产生的植物细胞保护物质能显著抑制冰淇淋的重结晶。AWSE冰淇淋冰晶也明显小于ETAWSE组(P<0.05),说明抑制冰淇淋重结晶的物质可能是AWSE中的蛋白质,这种蛋白质可能为冰结构蛋白(ice structuring protein,ISP)。关于AWSE中可能存在的ISP抑制冰晶生长和重结晶的学说中最广为接受的是吸附抑制假说[11,22-23],即冰晶的弧度表面诱蛋白质可吸附在冰晶-溶液交界面,从而抑制冰晶生长,使热休克过程中冰晶生长点温度低于熔点温度而产生非依数性热滞现象(达到相同浓度依数性热滞效应的300~500 倍)。热休克处理始,加热融化过程中出现重结晶和冰晶大小的增加,在高温保温过程中,冰晶大小的差异导致冰晶曲面半径的差异,由于奥斯瓦尔德效应,使得小冰晶逐渐消失并在大冰晶上重新析出[24],而AWSE中可能存在的ISP可通过吸附抑制机理就可以阻止冰晶增长,在重新冷却过程中,AWSE中可能存在的ISP在降温速率足够低的条件下从溶液区转移至到冰晶-溶液交界面,然后正确定向并扩散于冰晶表面周围,AWSE中可能存在的ISP蛋白结构中的特殊结合部位通过冰晶弯结内陷处嵌入冰格后被吸附,产生热滞效应而延缓冰晶重结晶[25]。AWSE中可能存在的ISP的特殊结合部分可与冰晶曲面结合后降低体系的自由能,因此使得水分子无法结合在冰晶上,冰晶增长被抑制[25]。NAWSE中由于不存在或量远少于AWSE中可能存在的ISP,因此不能抑制重结晶,ETAWSE中可能由于蛋白酶的作用而导致可能存在的ISP结构破坏,因此也不能抑制重结晶,这与NAWSE和ETAWSE冰淇淋的IGP无显著差别(表3,P>0.05)的实验结果一致。实验未对AWSE中可能存在的ISP进行提取、分离和鉴定,也未测定其热滞活性从而进一步印证AWSE中ISP的存在,这将是本实验的下一阶段研究内容。
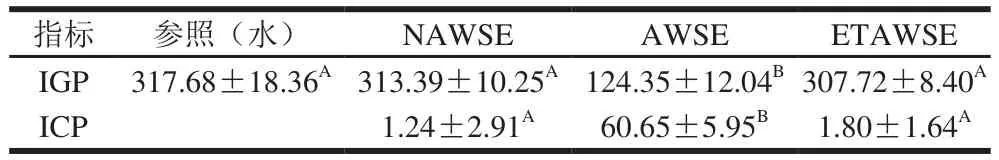
表3 冰淇淋热休克处理始末IGP和ICP实验结果Table 3 Results of IGP and IRI before and after heat-shock treatment %
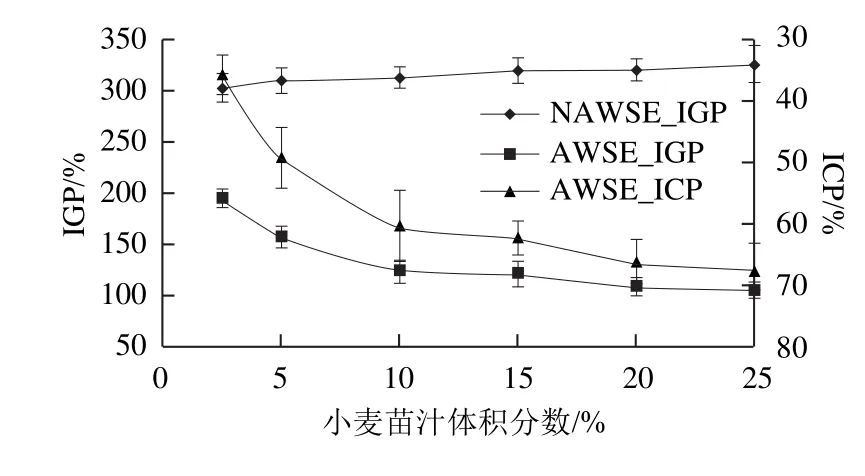
图2 不同AWSE添加量对冰淇淋重结晶抑制作用的影响Fig.2 In fluence of AWSE concentration on its IRI activity on ice cream
增加NAWSE添加量,冰淇淋IGP没有显著变化(图2,P>0.05),说明NAWSE无抑制冰晶重结晶作用。这与相关文献报道结果一致[14]。AWSE添加量与冰晶重结晶受到抑制作用相关。当冰淇淋中麦苗汁体积分数由2.5%增加至10%,AWSE对冰晶的抑制作用显著增加(P<0.05),IGP值由195.51%降至124.42%,AWSE的ICP由35.60%增至60.30%。继续增加AWSE,对冰晶增长的抑制作用不明显,这与相关文献报道结果一致[18]。AWSE中可能存在的ISP抑制冰晶增长存在饱和值的原因可能包括两方面,一是冰淇淋冰晶本身的表面积有限,二是不同来源的ISP由于结构差别和抑制机理的不同,与ISP分子的结合部分能结合的冰晶位置和表面积也有限。ISP可能不能达到100%覆盖率。因此,10%的AWSE对应可溶性蛋白质质量分数0.462%(包含普通蛋白质和可能存在的ISP)为抑制冰淇淋重结晶的饱和值。
2.3 胁迫时间对AWSE抑制冰淇淋重结晶作用的影响
6 ℃条件下改变低温胁迫时间,AWSE抑制冰晶重结晶作用随之变化(图3)。冷胁迫48 h后冰淇淋的IGP降至最低,AWSE的ICP则相应达到峰值。继续增加胁迫时间对冰晶的重结晶的抑制作用不显著(P>0.05)。原因可能是,随着低温胁迫时间的延长,AWSE中可能存在的ISP含量增加,冰晶抑制作用也随之提高,当胁迫时间延长至48 h后,AWSE中可溶性蛋白质质量分数达到0.462%,为AWSE抑制冰晶增长的饱和值,因此继续增加胁迫时间即使能增加AWSE中的蛋白质含量,但对冰晶增长的抑制作用已不显著,这与前面的实验结果一致。
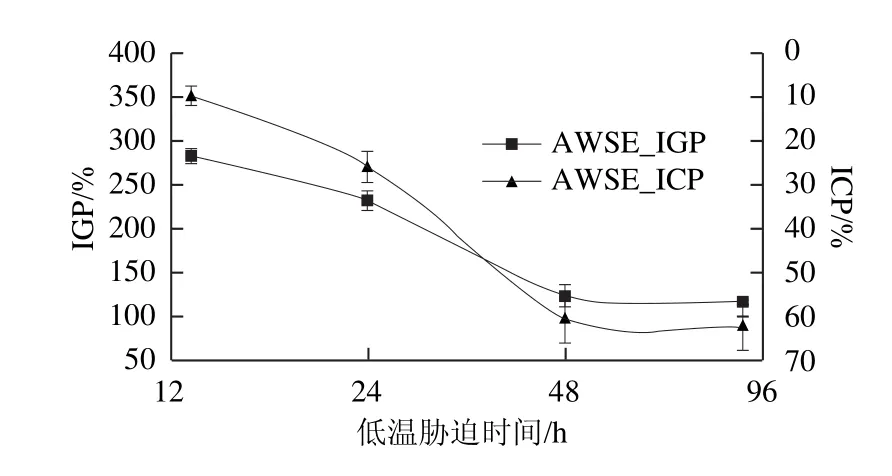
图3 冷胁迫时间变化对AWSE抑制冰淇淋重结晶作用的影响Fig.3 In fluence of cold acclimation duration on IRI activity of AWSE on ice cream
2.4 热休克处理频率对AWSE抑制冰淇淋重结晶作用的影响
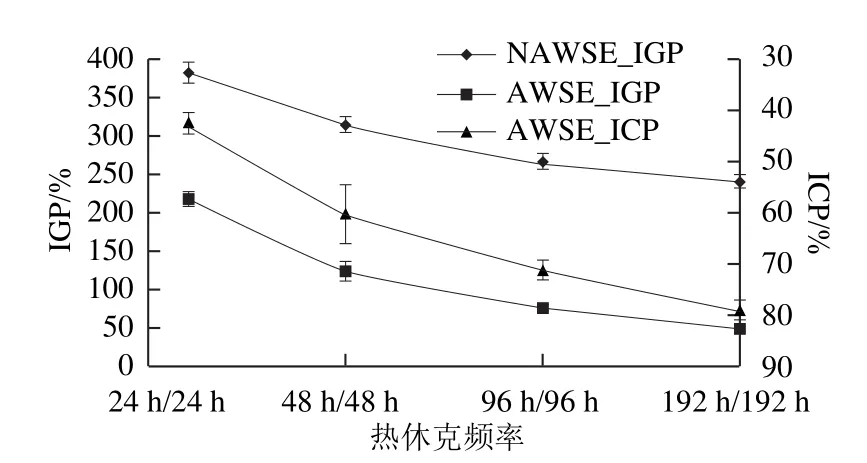
图4 热休克处理频率变化对AWSE抑制冰淇淋重结晶作用的影响Fig.4 In fluence of heat-shock frequency on IRI activity of AWSE on ice cream
改变热休克频率对AWSE抑制冰晶重结晶作用影响显著(图4,P<0.05)。随着热休克频率的下降,AWSE的作用显著上升。原因可能是,热休克频率高时,在冷却过程中,AWSE中的可能存在的ISP被快速冷却的冰晶困住而吞没,部分可能存在的ISP没有足够的时间由溶液区向冰晶-溶液界面迁移,因此冰晶增长抑制作用降低,随着热休克频率的下降,可能存在的ISP向溶液界面迁移增多,因此抑制重结晶能力上升。需要注意的是,添加NAWSE参照冰淇淋中的冰晶大小也有相同的变化趋势,这说明无论是否添加AWSE,重复溶解和冷冻会导致冰晶加速增长,从而影响冰淇淋的感官特性。
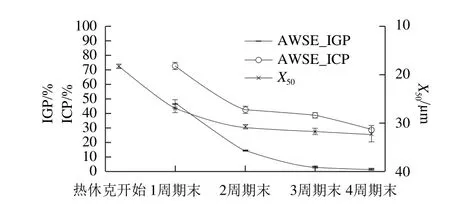
图5 热休克处理每周期AWSE抑制冰晶重结晶能力的变化Fig.5 Variations in IRI activity of AWSE during each cycle of heat shock
AWSE在热休克处理过程中抑制冰晶重结晶的能力随着周期数的增加而减少(图5),冰晶重结晶被抑制主要在热休克的第1周期过程中。第3周期后,X50、IGP和ICP趋于稳定。原因可能是:随着周期数的延长,热休克开始时冰晶增大,因此奥斯瓦尔德效应降低,AWSE中可能存在的ISP作用逐渐下降,冰晶大小趋于均匀和稳定。
3 结 论
AWSE对冰淇淋重结晶有显著的抑制作用,NAWSE和ETAWSE则没有,AWSE中起抑制重结晶作用的是冷胁迫过程中产生的可溶性蛋白质;AWSE对冰淇淋重结晶的抑制作用存在峰值。通过降低胁迫温度和延长胁迫时间可显著增加AWSE中可溶性蛋白质含量;AWSE对冰淇淋重结晶的抑制作用随热休克单周期时长增加而显著增加,随着周期数的延长而显著下降。
[1]周美玲, 邹奇波, 黄卫宁, 等.冰结构蛋白影响冷冻面团及面包体系发酵烘焙与热力学特性的研究[J].食品科学, 2008, 29(11): 125-129.
[2]樊凯凯, 刘爱国, 陈东, 等.冰结构蛋白及其应用研究[J].食品研究与开发, 2012, 33(9): 221-225.
[3]江勇, 贾士荣, 费云标, 等.冰结构蛋白及其在植物抗冻生理中的应用[J].植物学报, 1999, 41(7): 677-685.
[4]谢秀杰, 贾宗超, 魏群.抗冻蛋白结构与抗冻机制[J].细胞生物学杂志, 2005, 27(1): 5-8.
[5]田云, 卢向阳, 张海文, 等.抗冻蛋白研究进展[J].中国生物工程杂志, 2002, 22(6): 48-53.
[6]DEVIRES A L.Antifreeze glycopeptides and peptides: interactions with ice and water[J].Methods in Enzymology, 1986, 127: 293-303.
[7]GRIFFITH M, EWART K V.Antifreeze proteins and their potential use in frozen foods[J].Biotechnology Advances, 1995, 13(3): 375-402.
[8]CLARKE C L, BUCKLEY S L, LINDER N.Ice structuring proteins-a new name for antifreeze proteins[J].Cryo Letters, 2002, 23(2): 89-92.
[9]樊凯凯, 刘爱国, 陈东, 等.冰结构蛋白及其应用研究[J].食品研究与开发, 2012, 33(9): 221-225.
[10]APOSTOLOVA P, ANEVA I.Antioxidative defence in winter wheat plants during early cold acclimation[J].Plant Physiology, 2006(SI):101-108.
[11]MICHEL P, FATHEY S.Synthesis of freezing tolerance proteins in leaves, crown, and roots during cold acclimation of wheat[J].Plant Physiology, 1989, 89: 577-585.
[12]李春燕, 陈思思, 徐雯, 等.苗期低温胁迫对扬麦16叶片抗氧化酶和渗透调节物质的影响[J].作物学报, 2011, 37(12): 2293-2298.
[13]MARTIN D C, EDUARDO J Z, HORACIO G P, et al.Sucrose synthase expression during cold acclimation in wheat[J].Plant Physiology,1991, 96(3): 887-891.
[14]REGEND A, GOFF H D.Freezing and ice recrystallization properties of sucrose solutions containing ice structuring proteins from coldacclimated winter wheat grass extract[J].Journal of Food Science,2005, 70: 552-556.
[15]FRANCESCA S, LUCA S, CLAUDIO V.Changes in activity of anti oxidative enzymes in wheat (Triticum aestivum) seedlings under cold acclimation[J].Physiologia Plantarum, 1998, 104(4): 747-752.
[16]焦宇知, 候会绒, 翟玮玮.一种动态梯度富硒法制备富硒麦苗的方法: 中国, 201110063980.6[P].2012-07-25.
[17]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J].Analytical Biochemistry, 1976, 72: 248-254.
[18]REGEND A, GOFF H D.Ice recrystallization inhibition in ice cream as affected by ice structuring proteins from winter wheat grass[J].Journal of Dairy Science, 2006, 89(1): 49-57.
[19]KONTOGIORGOS V, REGAND A, YADA R Y, et al.Isolation and characterization of ice structuring proteins from cold-acclimated winter wheat grass extract for recrystallization inhibition in frozen foods[J].Journal of Food Biochemistry, 2007, 31(2): 139-160.
[20]BLANSHARD J M V, MUHR A H, GOUGH A.Water relationships in foods: crystallization from concentrated sucrose solutions[M].New York: Plenum Press, 1991: 639-655.
[21]HARTEL R W.The properties of water in foods : mechanisms and kinetics of recrystallization in ice cream[M].New York: Blackie Academic and Professional, 1998: 287-328.
[22]BROWN R A, YEH Y, BURCHAM T S, et al.Direct evidence for antifreeze glycoprotein adsorption onto an ice surface[J].Biopolymers,1985, 24: 1265-1270.
[23]YEH Y, FEENEY R E.Antifreeze proteins: structures and mechanisms of function[J].Chemical Reviews, 1996, 96(2): 601-617.
[24]FENNEMA O R.Low temperature preservation of foods and living matter: nature of the freezing process[M].New York: Marcel Dekker,1973: 151-227.
[25]KNIGHT C A, WIERZBICKI A. Adsorption of biomolecules to ice and their effects upon ice growth. 2. A discussion of the basic mechanism of “antifreeze” phenomena[J]. Crystal Growth and Design, 2001, 1(6): 439-446.
