三氯乙烯对小鼠肝脏PPARα和PPARγ表达的影响
2014-02-13侯菲菲朱启星
侯菲菲,沈 彤,王 进,房 魏,张 澄,朱启星
三氯乙烯对小鼠肝脏PPARα和PPARγ表达的影响
侯菲菲1,沈 彤1,王 进1,房 魏1,张 澄2,朱启星2
目的探讨饮水摄入三氯乙烯(TCE)对小鼠肝脏过氧化物酶体增殖物活化受体(PPAR)α和PPARγ的影响。方法雌性BALB/c小鼠随机分为空白对照组、溶剂对照组、2.5 g/L TCE组和5.0 g/L TCE组,TCE经饮水暴露。分别在第2、4、8、12周时,取外周血检测肝功能;处死小鼠取肝脏组织,HE染色进行病理观察;分别采用实时荧光定量RTPCR法和免疫组化法检测PPARα和PPARγ的mRNA水平和蛋白表达。结果与空白对照组及溶剂对照组比较,2.5、5.0 g/L TCE组小鼠谷丙转氨酶(ALT)水平在第2、4周明显升高(P<0.05);HE染色显示2.5、5.0 g/L TCE组小鼠肝脏组织有明显炎细胞浸润及肝细胞变性,肝损伤在4周时最明显;与空白对照组及溶剂对照组比较,2.5、5.0 g/L TCE组小鼠肝脏中PPARα和PPARγ mRNA表达量在4、8、12周时明显上升(P<0.05,P<0.01);2.5、5.0 g/L TCE组小鼠肝脏组织细胞核中均见PPARα和PPARγ的阳性表达,与空白对照组及溶剂对照组比较,各时期肝脏细胞核PPARα和PPARγ的阳性表达率显著上升(P<0.05)。结论饮水摄入TCE能上调小鼠肝脏PPARα和PPARγ表达。
三氯乙烯;PPARα;PPARγ;肝毒性
三氯乙烯(trichloroethylene,TCE)是工业上广泛应用的氯代类有机溶剂,除职业暴露外,由于大量应用加之处置不当,其已大量进入大气、土壤和地下水系统,成为一种重要的环境污染物[1]。职业环境中TCE暴露主要通过呼吸道和皮肤,而普通人群的TCE暴露主要是通过饮水摄入。TCE可引起机体多脏器损害,在TCE职业暴露人群中发生的TCE药疹样皮炎,患者在出现严重皮肤损害的同时还表现出明显的肝脏损害[2]。研究[3]显示长期TCE摄入主要引起肝脏毒性,目前TCE长期暴露引起肝脏毒性的具体机制还不清楚。研究[4]表明许多环境毒物所致肝脏毒性与其诱导核受体超家族转录因子过氧化物酶体增殖物活化受体(peroxisome proliferator activated receptors,PPARs)表达相关。该研究通过检测经饮水摄入TCE小鼠肝脏损伤和肝脏中PPARα和PPARγ的表达情况,探讨TCE暴露对小鼠肝脏PPARs表达的影响及其与肝脏毒性的关系,为防治TCE危害提供理论依据。
1 材料与方法
1.1 主要试剂与仪器TCE和二甲基亚砜(DMSO)为分析纯(美国Sigma公司);RNA抽提试剂盒(美国QIAGEN公司);反转录试剂盒和RT-PCR试剂盒[宝生物工程(大连)有限公司];兔抗小鼠PPARα单克隆抗体和兔抗小鼠PPARγ单克隆抗体(北京博奥森生物技术有限公司);正常山羊血清封闭液(武汉博士德生物工程有限公司);快捷性酶标羊抗兔IgG(福州迈新生物技术开发有限公司);DAB显色剂(北京中杉金桥生物技术有限公司);Applied Biosystems 7500实时PCR仪(美国AB公司);Universal 320/320R型台式低温高速离心机(德国Hettich公司);罗氏P800全自动生化仪(美国Bio-Tek公司)。
1.2 实验动物及处理80只6周龄雌性BALB/c小鼠,SPF级,体重16~18 g,购自北京维通利华实验动物中心,饲养于清洁动物房,维持12h光照/黑暗昼夜节律,自由进食;适应性饲养1周后随机分为空白对照组、溶剂对照组、2.5 g/L TCE组和5.0 g/L TCE组。TCE用DMSO溶解(终浓度不超过1%)后经饮水摄入,每天记录动物饮水量,为保持饮水中TCE浓度,每2 d换水1次;小鼠每周称重1次;分别在第2、4、8、12周时摘眼球取血,处死小鼠无菌取肝脏,称重,计算肝脏系数(肝脏重量/体重)。
1.3 肝功能检测外周血4℃静置1h后3 000 r/min离心10 min,取血清,全自动生化仪检测肝功能指标谷丙转氨酶(ALT)。
1.4 肝脏组织病理学检查取新鲜肝脏组织固定于4%多聚甲醛,石蜡包埋制备组织蜡块,连续切片,常规HE染色,显微镜观察组织病理学改变。
1.5 实时荧光定量RT-PCR法检测肝脏PPARα和PPARγ mRNA水平取新鲜肝脏制备匀浆,用RNA抽提试剂盒提取总RNA,用逆转录试剂盒逆转录成cDNA,按如下程序进行RT-PCR反应:94℃预变性5 min,35个循环,循环参数为94℃20 s,60℃20 s,72℃20 s,87℃10 s。以GAPDH为内参,用2-ΔΔCt法分析基因的相对表达量。引物序列为:PPARα:5′-GGGTACCACTACGGAGTTCACG-3′(上游),5′-CAGACAGGCACTTGTGAAAACG-3′(下游);PPARγ:5′-TGACCACTCCCATTCCTTT-3′(上游),5′-GCTCTACTTTGATCGCACTTT-3′(下游);GAPDH:5′-AGCAATGCCTCCTGCACCACCAAC-3′(上游),5′-CCGGAGGGGCCATCCACAGTCT-3′(下游)。
1.6 免疫组化法检测肝脏PPARα和PPARγ蛋白表达取新鲜肝脏组织固定于4%多聚甲醛,石蜡包埋制备组织蜡块。切片后常规脱蜡水化,Triton X-100细胞通透,双氧水消除内源性过氧化物酶,枸橼酸钠抗原修复,正常山羊血清封闭,滴加一抗(1∶500),4℃过夜,第2天取出洗净后滴加二抗,PBS充分冲洗后DAB显色,苏木精复染,干燥,封片。阴性对照以等量PBS代替一抗,其他步骤同上。PPARα和PPARγ细胞核阳性表达率计算:400倍镜下选取5个具有代表性的视野,计算阳性细胞所占百分比,并求其平均数。
1.7 统计学处理采用SPSS 17.0统计软件进行分析,数据以±s表示,符合正态分布的资料用单因素方差分析(ANOVA)进行多组间的比较,用t检验进行两组间的比较,非正态分布资料采用非参数检验。
2 结果
2.1 一般情况实验期间各组小鼠一般情况良好,未出现个体因TCE摄入而死亡,各组小鼠平均饮水量和体重增长差异无统计学意义,各时间点小鼠肝脏系数组间差异无统计学意义(P>0.05)。
2.2 饮水摄入TCE对小鼠肝功能的影响在2、4、8、12周,溶剂对照组小鼠肝脏ALT水平与空白对照组比较差异无统计学意义(P>0.05);在2、4周,2.5、5.0 g/L TCE组ALT水平较对照组有所升高,并且5.0 g/L TCE组的升高趋势比2.5 g/L TCE组更加明显(P<0.05,P<0.01);在8、12周,2.5、5.0 g/L TCE组ALT水平有所下降,但仍高于对照组,只有5.0 g/L TCE组ALT水平显著高于对照组(P<0.05,P<0.01),其他组间比较差异无统计学意义(P>0.05),见图1。
2.3 饮水摄入TCE对小鼠肝脏组织病理学影响组织病理检查显示,空白对照组和溶剂对照组小鼠肝细胞排列整齐,胞核大而圆,核仁明显,胞质均匀,无炎性改变(图2A、B);TCE暴露组小鼠肝脏组织汇管周围见明显炎细胞浸润,部分肝细胞轻度水肿,少许细胞变性或坏死,4周时最明显(图2F),且5.0 g/L组(图2F)较2.5 g/L组(图2E)显著,在8周(图2G、H)和12周时损伤程度有所减轻。
2.4 饮水摄入TCE对小鼠肝脏PPARα、PPARγmRNA水平的影响在2、4、8、12周,溶剂对照组小鼠肝脏PPARα和PPARγ mRNA水平与空白对照组比较差异无统计学意义;在4、8、12周,TCE暴露组PPARα mRNA水平高于空白对照组和溶剂对照组,且5.0 g/L TCE组上升趋势高于2.5 g/L TCE组(P<0.05,P<0.01);在4周时,2.5、5.0 g/L TCE组PPARγ mRNA水平均高于空白对照组和溶剂对照组(P<0.05);在8、12周,5.0 g/L TCE组PPARγ mRNA水平高于空白对照组和溶剂对照组(P<0.05,P<0.01),2.5 g/L TCE组PPARγ mRNA水平显著高于空白对照组(P<0.01),与溶剂对照组比较差异无统计学意义。在2周时,除5.0 g/L TCE组PPARγ mRNA水平高于空白对照组外(P<0.05),其他组间比较差异均无统计学意义,见图3。
2.5 饮水摄入TCE对小鼠肝脏PPARα、PPARγ蛋白表达影响免疫组化检测显示PPARα和PPARγ阳性表达细胞呈棕褐色,主要位于细胞核内,偶有胞质表达,阴性表达细胞呈淡蓝紫色。空白对照组和溶剂对照组肝组织少见PPARα和PPARγ阳性表达,TCE暴露组小鼠肝脏组织各时期均显示PPARα和PPARγ阳性表达,见图4、5。统计显示TCE暴露组肝组织胞核PPARα、PPARγ阳性表达率显著高于空白对照组和溶剂对照组(P<0.05),见表1。
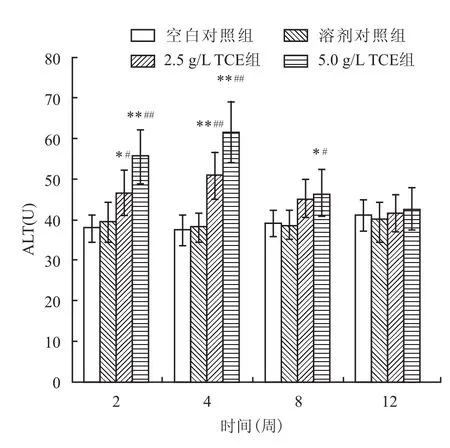
图1 饮水摄入TCE对小鼠ALT的影响(n=5)
表1 肝脏PPARα、PPARγ细胞核阳性表达率(n=3,±s)
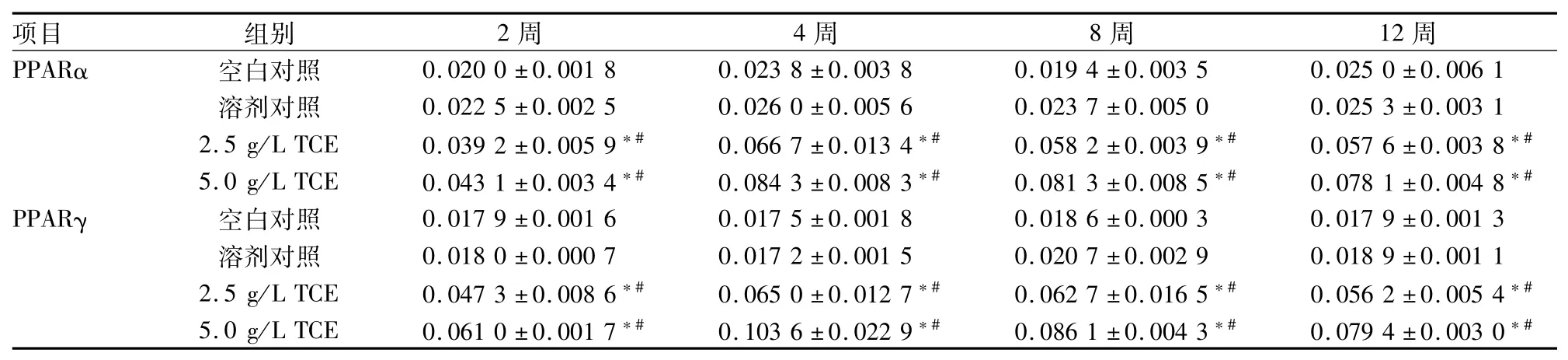
表1 肝脏PPARα、PPARγ细胞核阳性表达率(n=3,±s)
与空白对照组比较:*P<0.05;与溶剂对照组比较:#P<0.05
项目组别2周4周8周12周PPARα空白对照0.020 0±0.001 80.023 8±0.003 80.019 4±0.003 50.025 0±0.006 1溶剂对照0.022 5±0.002 50.026 0±0.005 60.023 7±0.005 00.025 3±0.003 1 2.5 g/L TCE0.039 2±0.005 9*#0.066 7±0.013 4*#0.058 2±0.003 9*#0.057 6±0.003 8*#5.0 g/L TCE0.043 1±0.003 4*#0.084 3±0.008 3*#0.081 3±0.008 5*#0.078 1±0.004 8*#PPARγ空白对照0.017 9±0.001 60.017 5±0.001 80.018 6±0.000 30.017 9±0.001 3溶剂对照0.018 0±0.000 70.017 2±0.001 50.020 7±0.002 90.018 9±0.001 1 2.5 g/L TCE0.047 3±0.008 6*#0.065 0±0.012 7*#0.062 7±0.016 5*#0.056 2±0.005 4*#5.0 g/L TCE0.061 0±0.001 7*#0.103 6±0.022 9*#0.086 1±0.004 3*#0.079 4±0.003 0*#
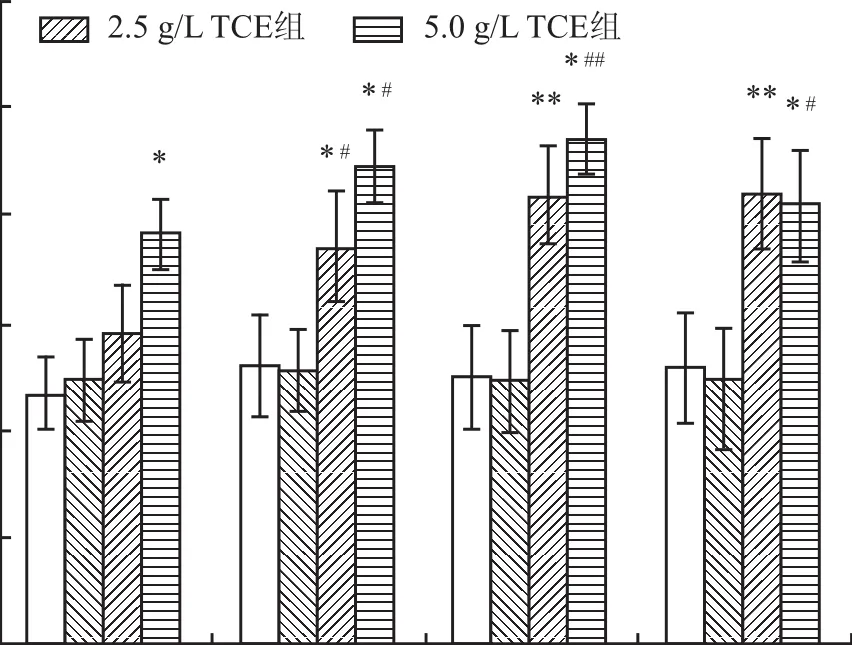
图3 TCE饮水暴露小鼠肝脏PPARα、PPARγ mRNA表达情况(n=5)
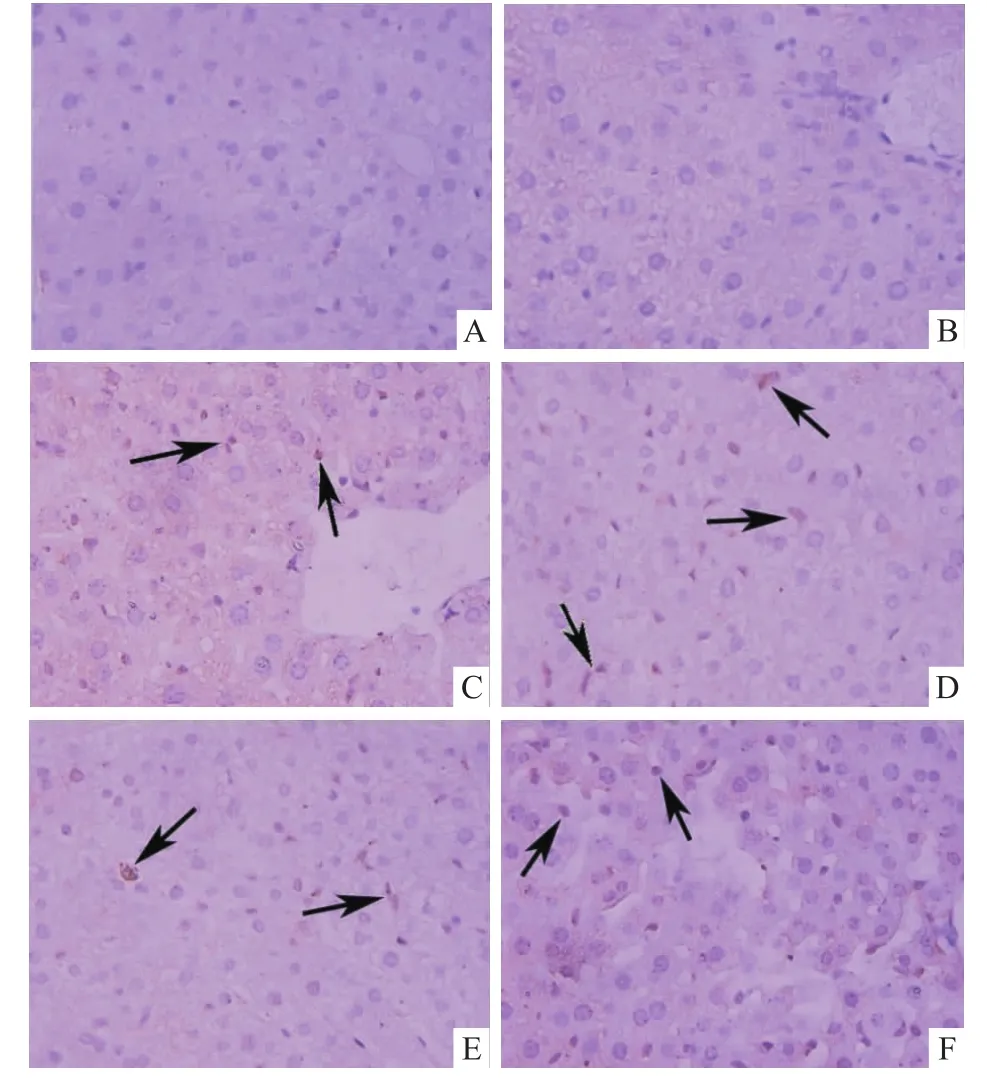
图4 小鼠肝脏组织PPARα表达 PV×400
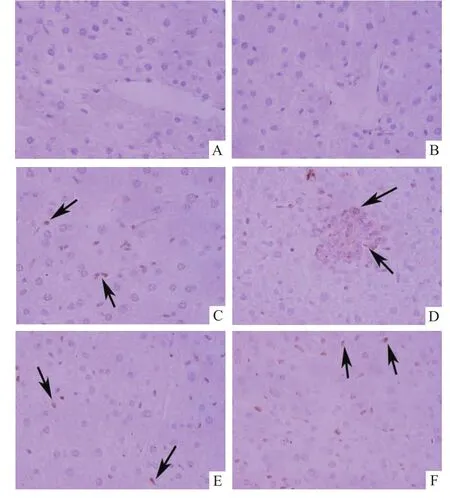
图5 小鼠肝脏组织PPARγ表达 PV×400
3 讨论
研究[5]显示长期暴露于TCE可致肝毒性,诱发肝脏炎症、肝脏肿瘤等肝脏损伤,但具体机制目前仍不清楚。本研究在经饮水给予小鼠不同剂量[3]TCE后于不同时段进行肝功能检测显示,长期饮水摄入TCE可引起小鼠肝功能ALT上升,并在4周时达到最高,表明长期暴露于TCE可引起肝功能的损害;组织病理学检查进一步显示TCE染毒小鼠肝脏胞水肿变性、炎细胞浸润等不同程度的肝损伤改变,而且也是4周时最为明显。
研究[6-7]显示TCE在肝脏细胞色素P450酶作用下生成的三氯乙酸(TCA)、二氯乙酸(DCA)具有过氧化物酶体增殖物(PP)的特性,从而激活PP的受体PPARs。激活的PPARs主要与靶基因启动子区的PPAR反应元件(PPRE)的特定核苷酸序列结合,调节靶基因的转录;PPARs还可通过配体依赖的转录调控抑制核因子-κB(NF-κB)等表达调节炎症细胞因子的表达[8]。PPARs有PPARα、PPARβ/δ和PPARγ 3种亚型,Corton[9]认为PPARα在TCE诱发肝脏肿瘤中扮演着重要角色。本研究显示,饮水给予TCE引起小鼠肝脏PPARα和PPARγ mRNA水平上调,与文献[10]报道的TCE暴露引起PPARα mRNA表达量出现显著增加一致;免疫组化检测显示TCE染毒动物肝脏细胞核PPARα和PPARγ的阳性表达较对照高,表明饮水摄入TCE后PPARα和PPARγ可能被激活;PPARα和PPARγ的表达在摄入TCE高剂量时较低剂量时明显,且在TCE暴露4周时达最高与肝脏毒性的剂量和时间效应表现一致,由此推测,饮水摄入TCE导致的肝脏毒性可能与PPARα和PPARγ的激活有关。但本研究中并未观察到染毒小鼠肝脏出现增殖肿大现象,肝脏系数变化也没有明显差异,这可能与样本数量和小鼠的种属与品系有关。本研究未对PPARα和PPARγ蛋白表达进行定量分析,因此不能对PPARα和PPARγ表达与TCE暴露所致肝损害进行相关性分析。
[1] Agency for Toxic Substances and Disease Registry(ATSDR).ToxFAQsTM for Trichloroethylene(TCE)[DB/OL].http://www.atsdr.cdc.gov/toxfaqs/tf.asp?id=172&tid=30.2003
[2] Jollow D J,Bruckner J V,McMillan D C,et al.Trichloroethylene risk assessment:A review and commentary[J].Crit Rev Toxicol,2009,39(9):782-97.
[3] Griffin J M,Gilbert K M,Lamps L W,et al.CD4(+)T-cell activation and induction of autoimmunehepatitis following trichloroethylene treatment in MRL+/+mice[J].Toxicol Sci,2000,57(2):345-52.
[4] Maloney E K,Waxman D J.Trans-activation of PPARα and PPARγ by structurally diverse environmental chemicals[J].Toxicol Appl Pharmacol,1999,161(2):209-18.
[5] Chiu W A.Trichloroacetic acid:Updated estimates of its bioavailability and its contribution to trichloroethylene-induced mousehepatomegaly[J].Toxicology,2011,285(3):114-25.
[6] Ramdhan D H,Kamijima M,Yamada N,et al.Molecular mechanism oftrichloroethylene-inducedhepatotoxicitymediatedby CYP2E1[J].Toxicol Appl Pharmacol,2008,231(3):300-7.
[7] Laughter A R,Dunn C S,Swanson C L,et al.Role of the peroxisome proliferator-activated receptor α(PPARα)in responses to trichloroethylene and metabolites,trichloroacetate and dichloroacetate in mouse liver[J].Toxicology,2004,203(1-3):83-98.
[8] Straus D S,Glass C K.Anti-inflammatory actions of PPAR ligands:new insights on cellular and molecular mechanisms[J].Trends Immunol,2007,28(12):551-8.
[9] Corton J C.Evaluation of the role of peroxisome proliferator-activated receptor α(PPARα)in mouse liver tumor induction by trichloroethylene and metabolites[J].Toxicology,2008,38(10):857-75.
[10]Ramdhan D H,Kamijima M,Wang D,et al.Differential response to trichloroethylene-inducedhepatosteatosisinwild-typeand PPARα-humanized mice[J].Environ Health Perspect,2010,118(11):1557-63.
Effects of trichloroethylene on the expression of liver PPARα and PPARγ in mice
Hou Feifei,Shen Tong,Wang Jin,et al
(Dept of Toxicology,School of Public Health,Anhui Medical University,Hefei 230032)
ObjectiveTo investigate the effects of trichloroethylene(TCE)intake via drinking water on liver peroxisome proliferator activated receptor(PPAR)α and PPARγ in mice.MethodsThe female BALB/c mice were randomly divided into blank control group,vehicle control group,2.5 g/L TCE group and 5.0 g/L TCE group,and were exposed to TCE via drinking water.On the 2nd,4th,8th,12th week,blood was collected for liver function examination,liver tissues were taken for HE staining.The PPARα and PPARγ expression in liver were measured by RT-PCR and immunohistochemical staining.ResultsThe levels of ALT in 2.5,5.0 g/L TCE treated groups increased significantly compared with control groups on the 2nd,4th week(P<0.05);HE staining showed inflammatory cell infiltration and liver cell degeneration in 2.5,5.0 g/L TCE treated groups,the damage was most obvious on the 4th week;compared with control groups,PPARα and PPARγ mRNA expression in liver of TCE treated groups increased significantly on the 4th,8th,12th week(P<0.05,P<0.01);in the nuclei of liver cells,the expression of PPARα and PPARγ was positive in 2.5,5.0 g/L TCE treated groups,and the levels of PPARα and PPARγ expression in nuclei increased significantly compared with control groups on the 2nd,4th,8th,12th week(P<0.05).ConclusionThe results suggest that TCE intake via drinking water can upregulate the expression of liver PPARα and PPARγ in mice.
trichloroethylene;PPARα;PPARγ;hepatotoxicity
R 114
A
1000-1492(2014)04-0467-05
2013-11-25接收
安徽省自然科学基金项目(编号:11040606M213);教育部科学技术研究重点项目(编号:210100)
安徽医科大学公共卫生学院1卫生毒理学系、2劳动卫生与环境卫生系,合肥 230032
侯菲菲,女,硕士研究生;沈 彤,男,博士,副教授,硕士生导师,责任作者,E-mail:ahmusht@163.com
