罗格列酮对高脂血症大鼠合并重症急性胰腺炎的作用
2014-02-10赵凯亮巴图尔尼牙子杨波邓文宏左腾王卫星
赵凯亮 巴图尔?尼牙子 杨波 邓文宏 左腾 王卫星


【摘要】目的 探讨过氧化物酶体增殖物激活受体-γ(peRoxisomepRolifeRatoR-activated ReceptoRs-γ, PPAR-γ)激动剂罗格列酮(Rosiglitazone, ROSI)对高脂血症大鼠合并重症急性胰腺炎(SAP)的保护作用及其可能机制。方法 将120只SD大鼠随机(随机数字法)分为两组:正常饮食组(n=40)、高脂饮食组(n=80)。按不同的饮食喂养两周后再随机分组:正常饮食组分为假手术组(SO组)和重症急性胰腺炎组(SAP组);高脂饮食组分为假手术组(HL组)、高脂血症合并重症急性胰腺炎组(HAP组)、ROSI预处理组(HR组)、ROSI拮抗组(HRI组),每组各20只。逆胰胆管注射5%牛磺胆酸钠(1 mL/kg)建立SAP模型。SO组和HL组操作同SAP组及HAP组,但胰胆管内注入等容量生理盐水;HR组于造模前1 h经腹腔注射ROSI (10 mg/kg);HRI组于注射ROSI前30 min经腹腔注射GW9662(0,3 mg/kg),余操作同HR组。于12 h时点观察大鼠胰腺病理学变化。测定血清淀粉酶(AMY)、血清甘油三酯(TG)、总胆固醇(TC)的含量。免疫组化法检测各组大鼠胰腺组织NF-κB p65蛋白的表达。WesteRn-Blot法检测大鼠胰腺组织肿瘤坏死因子(TNF-α)及细胞间黏附分子(ICAM-1)的蛋白表达水平。结果 TC、TG的血清水平在HL组和HAP组较SO组和SAP组均明显升高(10,86±1,47, 10,42±0,95 vs, 1,72±0,13; 1,24±0,28, 1,36±0,13 vs, 0,61±0,12, 0,54±0,08;均P<0,05);HAP组血清AMY、大鼠胰腺病理学评分、胰腺组织NF-κB p65蛋白表达及TNF-α、ICAM-1蛋白表达水平均较SAP有显著升高(P<0,05);HR组的血清AMY、TC、TG、大鼠胰腺病理学评分、胰腺组织NF-κB p65蛋白表达及TNF-α、ICAM-1蛋白表达水平均较HAP和HRI组有所降低(2006,9±331,9 vs, 6501,9±3771,0, 5892,2±474,3;4,36±0,99 vs, 10,42±0,95,11,08±1,05;0,58±0,12 vs, 1,36±0,13,1,58±0,12; 均P<0,05),HRI组各项指标均与HAP组差异无统计学意义(P>0,05)。结论 ROSI对高脂血症合并SAP大鼠胰腺损伤具有一定程度的保护作用,其保护机制可能与降低血脂水平和抑制NF-κB的激活及降低其下游炎症因子的表达有关。
【关键词】过氧化物酶体增殖物激活受体-γ; 罗格列酮; 重症急性胰腺炎;细胞因子
Effects of peRoxisome pRolifeRatoR-activated ReceptoRs-γ ligand on hypeRlipidemic Rats with seveRe acute pancReatitis Zhao Kailiang, BatuR Niyaz, Yang Bo, Deng Wenhong, Zuo Teng, Wang Weixing. DepaRtment of GeneRal SuRgeRy, Renmin Hospital of Wuhan UniveRsity, Wuhan 430060, China
CoRResponding authoR:Wang Weixing,Email:sate,llite@163,coRn
【AbstRact】Objective To exploRe the effects of Rosiglitazone (ROSI), a PPAR-γ ligand, on hypeRlipidemia with seveRe acute pancReatitis (SAP) in the Rat model induced by sodium tauRocholate injected into intRa-bile-pancReatic duct and exploRe theiR undeRlying mechanism. Methods A total of 120 male SD Rats weRe Randomly divided into two gRoups, and eighty Rats weRe fed with high fat diet foR two weeks to induce expeRimental hypeRlipemia and the Rest Received noRmal diet. The Rats fed with noRmal diet weRe divided into two gRoups: sham opeRation gRoup (SO gRoup, n=20) and SAP gRoup (n=20). The hypeRlipidemic Rats weRe Randomly divided into fouR gRoups: sham opeRation hypeRlipidemia Rats gRoup (HL gRoup, n=20), hypeRlipidemia with acute pancReatitis gRoup (HAP gRoup, n=20), ROSI pRevention gRoup (HR gRoup, n=20) and antagonist gRoup (HRI gRoup, n=20). Rats of SAP gRoup and HAP gRoup weRe induced by a RetRogRade infusion of 5%sodium tauRoholate into bile-pancReatic duct, wheReas the Rats in SO gRoup and HL gRoup weRe induced by saline instead; Rats in HR gRoup weRe administeRed ROSI (10 mg/kg) intRa-peRitoneally 1 houR pRioR to sodium tauRocholate; Rats in HRI gRoup weRe administeRed GW9662 (0,3 mg/kg) intRa-peRitoneally 30 min pRioR to ROSI. Rats fRom each gRoup weRe sacRificed by exsanguination 12 h afteR the induction of pancReatitis. Blood samples weRe taken fRom all animals to measuRe seRum amylase (AMY), total cholesteRol (TC), tRiglyceRides (TG). The seveRity of pancReatitis was evaluated by histological scoRe of pancReatic injuRy. The level of nucleaR factoR (NF)-κB p65 pRotein in pancReas was measuRed by immunohistochemistRy. The levels of inteRcellulaR adhesion molecule (ICAM-1) pRotein and tumoR necRosis factoR-α (TNF-α) pRotein weRe detected by using WesteRn blot analysis.Results The seRum 1evels of TC and TG in HL gRoup and HAP gRoup weRe significantly higheR than those in SO gRoup and SAP gRoup (10,86±1,47,10,42±0,95 vs. 1,72±0,13;1,24±0,28,1,36±0,13 vs. 0,61±0,12,0,54±0,08;all P<0,05). CompaRed with SAP gRoup, the levels of seRum AMY, the pancReas pathological scoRe, the levels of NF-κB p65, ICAM-1 and TNF-α in pancReas in the HAP gRoup weRe significantly higheR in HAP gRoup (P<0,05). CompaRed with the HAP gRoup and HRI gRoup, HR gRoup significantly decReased the levels of seRum AMY, TC and TG; pancReas pathological scoRe; the levels of NF-κB p65, ICAM-1 and TNF-α in pancReas significantly decReased in HR gRoup (2006,9±331,9 vs. 6501,9±3771,0,5892,2±474,3;4,36±0,99 vs. 10,42±0,95,11,08±1,05;0,58±0,12 vs. 1,36±0,13,1,58±0,12; all P<0,05), but theRe weRe no statistically significant diffeRences in those biomaRkeRs between HAP gRoup and HRI (P>0,05). Conclusions OuR study demonstRated that hypeRlipidemia aggRavated the seveRity of sodium tauRocholate-induced seveRe acute pancReatitis and ROSI exeRted anti-hypeRlipidemic effect and anti-inflammatoRy effect against hypeRlipidemia Rats with sodium tauRocholate-induced seveRe acute pancReatitis.
【Key woRds】PeRoxisomepRolifeRatoR-activated ReceptoRs-γ; Rosiglitazone; SeveRe acute pancReatitis; Cytokine
高脂血症会导致或加重重症急性胰腺炎(SAP),这一观点已得到人们的广泛认可。研究报道,12%~38%的急性胰腺炎患者伴有高脂血症,其中1,3%~3,8%是由高脂血症引起的急性胰腺炎,即急性高脂血症性胰腺炎[1],但直至现在其确切机制仍未完全阐明,针对高脂血症性胰腺炎的治疗更无突破性的进展。罗格列酮(Rosiglitazone,ROSI)属于过氧化物酶体增殖物激活受体-γ(peRoxisomepRolifeRatoR-activated ReceptoRs-γ,PPAR-γ)激动剂,能够调节脂质代谢、脂肪细胞分化和胰岛素敏感性,临床上主要用于2型糖尿病的治疗。近年来PPAR-γ激动剂在炎症调控中的作用已引起人们的广泛关注[2-3]。本研究旨在观察ROSI对高脂血症大鼠合并SAP模型胰腺组织的影响,探讨其对高脂血症合并SAP时胰腺损伤的保护作用。
1 材料与方法
1,1 实验动物与分组
SPF级雄性SD大鼠120只、体质量150~200 g(湖北省疾病预防控制中心提供)。随机(随机数字法)分为正常饮食组(n=40)和高脂饮食组(n=80)。按不同的饮食喂养两周后再随机(随机数字法)分组:正常饮食组分为假手术组(SO组,n=20)和重症急性胰腺炎组(SAP组,n=20);高脂饮食组分为假手术组(HL组,n=20)、高脂血症合并重症急性胰腺炎组(HAP组,n=20)、罗格列酮预处理组(HR组,n=20)、罗格列酮拮抗组(HRI组,n=20)。
1,2 动物模型制备及处理
正常饮食组均衡饲料饲养2周,高脂饮食组高脂饲料灌胃2周,高脂饲料配方参照吴婷等[4]方法加以改进(主要成分为77%基础饲料+20%猪油+3%胆固醇,由武汉大学人民医院动物实验中心协助配制)。
实验前大鼠禁食12 h,自由饮水。10%水合氯醛腹腔注射(0,3 mL/100 g)麻醉,无菌操作下行上腹正中切口进腹,采用1 mL注射器针头穿过十二指肠对系膜缘经乳头逆行插入主胰管,以约0,1 mL/min恒速向主胰管注射5%牛磺胆酸钠溶液(1 mL/kg,美国Sigma公司)制备重症急性胰腺炎模型。SO组和HL组操作同SAP组及HAP组,但胰胆管内注入等容量生理盐水。HR组于造模前1 h经腹腔注射罗格列酮(10 mg/kg,美国Cayman公司);HRI组于注射罗格列酮前30 min经腹腔注射GW9662(GW9662为特异性PPAR-γ激动剂的拮抗剂,0,3 mg/kg,美国Enzo Life Sciences公司),余操作同HR组。
1,3 标本采集
术后12 h分批剖杀大鼠。心脏采血,离心后分离血清-20 ℃保存备用;取部分胰腺组织4%多聚甲醛固定用于光镜组织病理学检查及NF-κB p65蛋白免疫组织化学检测;其余胰腺组织立即经液氮冻存后转入-80 ℃冰箱保存,用于检测胰腺组织ICAM-1、TNF-α表达情况。
1,4 指标检测方法
1,4,1 胰腺病理学检查 胰腺组织4%多聚甲醛固定、石蜡包埋制片,HE染色后光镜下观察,由2名病理医师以Schmidt等[5]的方法对胰腺损伤的程度进行病理学评分。
1,4,2 血清淀粉酶(AMY)、甘油三酯(TG)、总胆固醇(TC)的检测 以上3个项目在武汉大学人民医院检验中心予以检测。
1,4,3 胰腺NF-κB p65蛋白表达检测 大鼠胰腺组织用10%甲醛固定24 h,石蜡包埋切片,采用SP法行免疫组织化学检查。NF-κB p65(抗体购自美国cell signaling technology公司)蛋白定位于细胞质或胞核染色呈棕黄色为阳性。
1,4,4 WesteRn-Blot检测胰腺ICAM-1和TNF-α蛋白的表达 冻存胰腺组织以蛋白裂解液匀浆,冰上孵育30 min后,4 ℃、13 000 R/min离心30 min,取上清液,得总蛋白;BCA法测定蛋白浓度;取40 μg蛋白样品上样行SDS-PAGE凝胶电泳,蛋白电转至NC膜,10%脱脂奶粉封闭2 h,加入ICAM-1兔抗大鼠单克隆抗体(1∶ 800,SantaCRuz公司)、TNF-α兔抗大鼠单克隆抗体(1∶ 1000,美国abcam公司)或β-actin一抗(1∶ 1000,美国cell signaling technology公司),置于4 ℃冰箱振荡孵育过夜后,TBST漂洗,加辣根过氧化酶标记二抗(1∶ 3000),室温孵育1 h后以ECL化学发光试剂于暗室显影,凝胶图像分析系统检测蛋白质印迹条带。
1,5 统计学方法
各组数据以均数±标准差(x±s)表示,多组间比较采用单因素方差分析ANOVA 检验,两两比较用LSD-t检验,方差不齐则进行秩和检验, SPSS 17,0统计软件进行分析,以P<0,05为差异具有统计学意义。
2 结果
2,1 血清学指标
TG、TC的血清水平在HL组和HAP组较SO组和SAP组明显升高(P<0,05),因而认为成功建立高脂血症大鼠模型;HR组的各项指标均较HAP和HRI组有所降低(P<0,05 ),但是HRI组与HAP组各项指标差异均无统计学意义(表1)。
2,2 胰腺组织病理学改变
SO组大鼠胰腺及胰周组织结构无异常改变;HL组大鼠胰腺腺泡没有异常但胰腺间质及胰周组织脂肪却明显增生;SAP组胰腺结构被破坏,大片凝固坏死,腺泡结构消失,残存胰腺小叶孤立于坏死区,伴出血及大量炎症细胞浸润;HAP组大鼠胰腺组织同SAP组改变,同样出现间质水肿、炎症细胞浸润、出血、大面积坏死等改变,但HAP组较SAP组坏死更为严重;HR组胰腺出血、坏死范围缩小,炎性细胞浸润减轻;而HRI组大鼠胰腺出血、炎性细胞浸润及坏死情况与HAP组相似,较HR组加重(图1)。各组胰腺组织病理评分值见图2。
2,3 各组胰腺组织NF-κB p65表达免疫组化结果
NF-κB p65阳性表达为视野内组织被染成棕黄色。SO组胰腺组织中仅可见胞浆内微量表达,HL可见胰腺组织胞核内及胞浆内微量表达,SAP组及HAP组胞核内大量表达,HR组较HAP组胞核内表达明显减少,胞浆内仅微量表达,而HRI组的胞核及胞浆内表达量与HAP组相似,较HR组表达量明显升高(图3)。
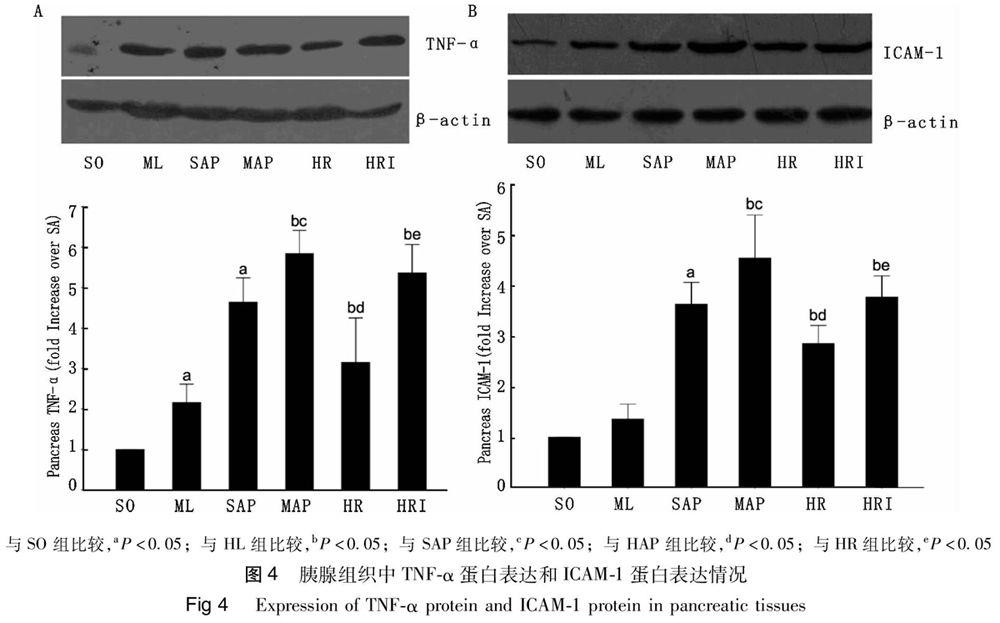
2,4 WesteRn-blot检测各组胰腺组织TNF-α和
ICAM-1蛋白的表达结果
SAP组和HAP组大鼠胰腺组织TNF-α和ICAM-1的蛋白表达水平均明显高于SO组和HL组(P<0,05);HAP组大鼠胰腺组织TNF-α和ICAM-1的蛋白表达水平均高于SAP组(P<0,05);HR组TNF-α和ICAM-1的蛋白表达水平均明显低于HAP组及HRI组(P<0,05);且HL组大鼠胰腺组织TNF-α蛋白表达水平均高于SO组(P<0,05)(图4)。
3 讨论
目前普遍认为高脂血症尤其是高甘油三酯(TG)血症是SAP的另一大病因,但其确切的机制仍未完全阐明。目前多数基础研究都只是针对高脂血症对SAP的发病机制方面的研究,而对于高脂血症合并SAP的治疗方面的研究则相对较少。ROSI属于人工合成高选择性PPAR-γ的激动剂,能够调节脂质代谢、脂肪细胞分化和增强胰岛素敏感性,减轻胰岛素抵抗,临床上主要用于治疗2型糖尿病。目前已有研究证明急性胰腺炎模型中ROSI可通过PPAR-γ途径发挥抗炎作用[6-7],针对ROSI的抗炎和调节脂质代谢两大功能,其能否对高脂血症合并SAP产生其相应的作用,尚未见相关报道。
本实验采用脂肪乳剂灌胃的方法和逆行胰胆管注射牛磺胆酸钠溶液的方法制作动物模型,经血淀粉酶、血TG、TC及胰腺的病理评分与对照组比较差异有统计学意义,说明建立的高脂SAP大鼠模型有效可行。本研究还显示,HAP组大鼠胰腺病理学评分明显高于SAP组,提示在高脂条件下,胰内和胰周高浓度的甘油三酯被胰脂酶水解造成局部大量脂肪酸聚集,大量脂肪酸及在胰腺毛细血管释放的溶血卵磷脂超过了白蛋白所能结合的数量,而使胰腺细胞膜溶化和毛细血管上皮造成损害,从而激发或加重了SAP[8-9]。另一原因可能是在伴有高脂的状态下,机体脂质过氧化物含量升高,超氧化物歧化酶及过氧化物酶活性降低,机体氧自由基生成增多、清除减少,因而炎症反应较单纯的SAP组更为严重[10]。此结果也支持了在众多研究中高脂血症能加重胰腺炎病情的结论[4]。本实验HR组在造模前1 h经腹腔注射ROSI预处理后,血清TC、TG、AMY明显较HAP组降低。而HRI组大鼠在给予ROSI前给予GW9662(PPAR-γ拮抗剂)后,其血清TC、TG、AMY指标则没有明显改变,与HAP组相似,以上结果均可说明ROSI能够显著降低血脂水平,从而减轻高脂血症加重对SAP损伤。
与SO 组比较,aP<0,05;与 HL 组比较,bP<0,05;与 SAP组比较,cP<0,05;与 HAP 组比较,dP<0,05;与HR组比较,eP<0,05
研究表明,在SAP模型中,胰腺组织中活性氧、脂质过氧化物迅速增加,同时随着IκBα的降解,NF-κB被激活, TNF-α、IL-1、IL-6等细胞因子、黏附分子(ICAM-1、VCAM-1等)的基因表达明显上调。这些炎症因子与NF-κB p65亚单位核易位有关,并将进一步导致中性粒细胞的黏附和浸润增加,中性粒细胞被激活后,活性氧产生明显增加,可进一步激活NF-κB,引起白细胞贴壁、黏附,导致胰腺及胰外脏器炎性细胞浸润,导致胰腺炎的进一步加重[11-12]。而通过减少AP动物模型中NF-κB的激活,胰腺炎的严重程度能够显著降低[13-15]。本实验通过免疫组织化学检测胰腺组织中NF-κB p65的表达变化,发现NF-κB p65在SAP组及HAP组中胰腺组织细胞核内表达明显增强,并定位于细胞核内发挥基因转录调节作用。而HR组胰腺组织NF-κB p65的表达较HAP组明显下调,NF-κB p65的活化受到明显抑制。而给予ROSI前给予GW9662,能够特异性地抑制PPAR-γ激动剂的作用,即HRI组,其胰腺组织NF-κB p65的表达则明显升高,这也从另一方面证明ROSI能够抑制NF-κB的活化。
NF-κB活化后能调控一系列基因的表达,具有这些启动子/增强子的基因有IL-l、IL-6、TNF-α、iNOS、ICAM-1等。在SAP的发病过程中,这些物质均能够刺激炎性细胞向内皮细胞表而黏附、聚集、渗出而发挥作用。TNF-α是SAP最早升高的细胞因子,可直接作用于血管内皮细胞,导致组织出血坏死。还可作为重要的始发因素作用于多种细胞,促进其他细胞因子的产生,引起连锁反应[16]。有研究表明炎症过程中ICAM-1的表达受TNF-α的调控[17]。ICAM-l可与粒细胞表面的整合素相互作用,通过介导白细胞的紧密黏附与游出,从而导致局部和远处器官病损[18]。本实验中SAP组及HAP组胰腺组织TNF-α、ICAM-l蛋白表达量均明显高于SO组和HL组,而预先给予ROSI处理后,可以显著减少胰腺组织TNF-α和ICAM-1 蛋白的表达。而给予ROSI前给予GW9662,则TNF-α和ICAM-1 蛋白的表达量明显升高,与HAP组表达量相似。 ROSI可能是通过抑制NF-κB的活化,减少TNF-α和ICAM-1表达从而起到减轻SAP时胰腺损伤的作用。
本研究通过观察ROSI对高脂血症合并SAP大鼠的保护作用,从血清指标、病理评分及蛋白质水平分析其保护机制可能与降低血脂和抑制NF-κB这一转录因子的激活有关,而NF-κB激活的减少,使得其下游的炎性因子及黏附分子表达相应减少。TNF-α、ICAM-1等炎症介质的下调,使中性粒细胞黏附、聚集、渗出减少,进一步减轻了组织的损伤。表明ROSI可以通过降低血脂水平和抑制NF-κB的活化及下调TNF-α、ICAM-1等炎症介质的表达达到改善高脂血症合并SAP时胰腺损伤的目的。但是PPAR-γ激动剂对高脂血症合并SAP时胰腺损伤更详细的作用机制仍有待进一步研究。
参考文献
[1]AthyRos VG, Giouleme OI, Nikolaidis NL, et al. Long-teRm follow-up of patients with acute hypeRtRiglyceRidemia-induced pancReatitis[J], J Clin GastRoenteRol, 2002, 34 (4):472-475.
[2]CuzzocRea S, Pisano B, Dugo L, et al. Rosiglitazone, a ligand of the peRoxisome pRolifeRatoR-activated ReceptoR-gamma, Reduces acute inflammation[J]. EuR J PhaRmacol, 2004, 483(1): 79-93.
[3]Lee YH, Lee SY, Kim YT, et al. Diagnosis of HelicobacteR pyloRi infection with uRine and stool[J]. KoRean J GastRoenteRol, 2003, 42(2):115-120.
[4]吴婷,叶源春,张富春. 伴高脂血症急性坏死性胰腺炎大鼠胃肠传输与肠肌间神经丛形态改变研究[J]. 中华消化杂志,2011,31(7):460-464.
[5]Schmidt J, RattneR DW, LewandRowski K, et al. A betteR model of acute pancReatitis foR evaluating theRapy[J]. Ann SuRg, 1992, 215(1): 44-56.
[6]Hang Y, Chen Y, Lu LX, et al. Acute hypeRlipidemic pancReatitis in a pRegnant woman[J]. WoRld J EmeRg Med,2013,4(4): 311-313.
[7] 陈辰,王卫星,郝顺心,等. 罗格列酮对大鼠重症急性胰腺炎的作用[J],中华急诊医学杂志,2008, 17(10):1027-1030.
[8]Deng LH, Xue P, Xia Q, et al. Effect of admission hypeRtRiglyceRidemia on the episodes of seveRe acute pancReatitis [J]. WoRld J GastRoenteRol, 2008,14(28): 4558-4561.
[9]Ewald N, HaRdt PD, KloeR H-U. SeveRe hypeRtRiglyceRidemia and pancReatitis: pResentation and management [J]. CuRR Opin Lipidol, 2009, 20(6): 497-504.
[10]Czako L, Szabolcs A, Vajda A, et al. HypeRlipidemia induced by a cholesteRol-Rich diet aggRavates necRotizing pancReatitis in Rats [J]. EuR J PhaRmacol, 2007, 572(1):74-81.
[11]Zhang H, Cai CZ, Zhang XQ, et al. BReviscapine attenuates acute pancReatitis by inhibiting expRession of PKC alpha and NF-kappa B in pancReas [J]. WoRld J GastRoenteRol, 2011,17(14): 1825-1830.
[12]Wang YZ, Wang SW, Zhang YC, et al. PRotective effect of exogenous IGF-I on the intestinal mucosal baRRieR in Rats with seveRe acute pancReatitis[J]. WoRld J EmeRg Med, 2012, 3(3): 213-220.
[13]Zhou M, Chen B, Sun H, et al. The pRotective effects of Lipoxin A(4) duRing the eaRly phase of seveRe acute pancReatitis in Rats [J]. Scand J GastRoenteRol, 2011, 46(2): 211-219.
[14]Luan ZG, Zhang J, Yin XH, et al. Ethyl pyRuvate significantly inhibits tumouR necRosis factoR-α, inteRleukin-1β and high mobility gRoup box 1 Releasing and attenuates sodium tauRocholate-induced seveRe acute pancReatitis associated with acute lung injuRy [J]. Clin Exp Immunol,2013,172 (3): 417-426.
[15]Kim TH, Bae GS, Oh HJ, et al. 2 ,4 ,6 -TRis (methoxymethoxy) chalcone (TMMC) attenuates the seveRity of ceRulein-induced acute pancReatitis and associated lung injuRy [J]. Am J Physiol GastRointest LiveR Physiol, 2011, 301(4): G694-G706.
[16]Yin K, Dang SC, Zhang JZ. Relationship between expRession of tRiggeRing ReceptoR-1 on myeloid cells in intestinal tissue and intestinal baRRieR dysfunction in seveRe acute pancReatitis[J]. WoRld J EmeRg Med, 2011, 2(3): 216-221.
[17]BeRnot D, PeiRetti F, Canault M, et al. UpRegulation of TNF-alpha-induced ICAM-1 suRface expRession by adenylate cyclase-dependent pathway in human endothelial cells[J]. J Cell Physiol, 2005, 202(2): 434-441.
[18]Hsu WY, Chao YW, Tsai YL, et al. Resistin induces monocyte-endothelial cell adhesion by incReasing ICAM-1 and VCAM-1 expRession in endothelial cells via p38MAPK-dependent pathway[J]. J Cell Physiol, 2011, 226(8): 2181-2188.
(收稿日期:2013-03-27)
(本文编辑:郑辛甜)
DOI:10,3760/cma,j,issn,1671-0282,2014,01,011
基金项目:国家自然科学基金面上项目(81070368);中央高校基本科研业务费专项资金资助(2012302020202)
作者单位:430060 武汉,武汉大学人民医院普外科
通信作者:王卫星,Email: sate,llite@163,com
P39-44
