胃肠道癌Parafibromin蛋白的表达及其与临床病理特征和预后的关系研究
2014-02-10郑华川赵恩宏肖丽君高野康雄
赵 爽,郑华川,赵恩宏,郑 鑫,肖丽君,高野康雄
胃肠道癌是发病率和病死率均较高的恶性肿瘤。虽然最新统计数据表明,世界范围内胃癌的发病率呈降低趋势,但我国胃癌的发病总数占世界胃癌发病总数的47%,在世界范围内结直肠癌的发病率居第三位[1-2]。在胃肠道癌的发生发展过程中,抑癌基因的失活,内环境的改变,凋亡受阻等因素可能起到重要作用。HRPT2基因是一种抑癌基因,其编码的Parafibromin蛋白可与PAF1形成复合体,再通过蛋白-DNA相互作用调控基因转录和翻译,进而诱导细胞凋亡或抑制细胞增殖[3-5]。在人体多种恶性肿瘤中,均发现Parafibromin蛋白表达异常,且与肿瘤的预后密切相关。
本研究采用大样本量,以免疫组化的方法观察Parafibromin蛋白在胃肠道癌中的表达,旨在探讨Parafibromin蛋白在胃肠道癌发生发展中的作用及与胃肠道癌临床病理特征的相关性,为胃肠道癌预后的判断及临床治疗提供理论和参考依据。
1 资料与方法
1.1 一般资料 选取1997年12月—2008年12月日本富山大学医学部手术切除并经病理证实为胃肠道癌的患者814例,其中男523例,女291例;年龄18~99岁,平均66.3岁;312例伴有淋巴结转移。术前患者均未接受放疗、化疗或生物治疗,均获得患者及其家属知情同意和日本富山大学伦理委员会批准。
1.2 材料收集 收集所有胃肠道癌患者癌组织标本814份,同时收集胃肠道癌患者癌旁组织标本328份及腺瘤组织标本129份。标本均取自首次切除病灶的患者。
1.3 主要试剂 Parafibromin鼠抗人多克隆抗体(购自美国Santa Cruz公司),羊抗鼠单克隆HRP抗体(购自DaKo公司),抗原修复液、牛血清清蛋白(购自美国Sigma公司),二氨基联苯胺(DAB)(购自北京中杉金桥生物技术公司),其余试剂均为国产分析纯。
1.4 病理学鉴定 组织标本经10%甲醛溶液固定,常规石蜡包埋后切片,切片厚4 μm。HE染色确定其组织学特征;Lauren分型确定肿瘤分化特征;弹性纤维染色和D2-40染色鉴别静脉和淋巴管浸润、UICC分期。同时收集患者肿瘤直径和其余一般临床资料。
1.5 组织芯片构建 肿瘤组织常规石蜡包埋,HE染色进行形态学观察,核对组织及有关病理诊断,并在组织切片和相应标本蜡块上进行标记。在标记的相应位置用组织芯片取样器(KIN-1,日本AZUMAYA公司)取样,将钻取的组织块放入标记好的24阵列固定塑料框架中注蜡包埋。切取4 μm切片,-20 ℃保存备用。
1.6 免疫组织化学法 采用免疫组化染色(SP)法检测Parafibromin蛋白表达,石蜡切片脱蜡脱水,微波修复抗原15 min,滴加5%牛血清清蛋白到切片上,室温孵育15 min;Parafibromin一抗工作液按1∶100稀释后使用,以不加一抗的样品作为阴性对照,一抗4 ℃保湿过夜;羊抗鼠单克隆抗体工作液按1∶100稀释后使用,二抗室温保湿孵育1 h;DAB显色,在显微镜下控制染色时间,水洗终止反应;苏木精染色1 min后水洗,80 ℃温水去除苏木精非特异染色;无水乙醇脱水2次,15~30 min/次;二甲苯透明2次,30 min/次;中性树胶封片。
1.7 免疫组织化学检测结果判定 200倍光学显微镜下随机选取5个视野,以细胞质或细胞核中出现棕黄色颗粒为阳性细胞。阳性细胞占视野比例<5%为阴性(-);阳性细胞占视野比例5%~25%为弱阳性(+);阳性细胞占视野比例26%~50%为中等阳性(++);阳性细胞占视野比例>50%为强阳性(+++)。染色结果均由两位病理科医师分别阅片诊断核实。
1.8 统计学方法 采用SPSS 13.0统计学软件进行数据分析,计数资料以相对数表示,采用χ2检验;相关性分析采用Spearman等级相关分析;生存分析采用Kaplan-Meier法;危险因素分析采用Cox比例风险回归法。以P<0.05为差异有统计学意义。
2 结果
2.1 Parafibromin蛋白在胃肠道组织中的表达 棕黄色深染区或颗粒样深染区位于细胞核,Parafibromin蛋白表达阳性率在胃肠道癌组织、腺瘤组织及癌旁组织中分别为48.9%(398/814)、78.3%(101/129)和92.7%(304/328)。胃肠道癌组织中的Parafibromin蛋白表达阳性率低于腺瘤组织和癌旁组织,差异有统计学意义(χ2=189.20、47.50,P<0.05,见图1、表1)。
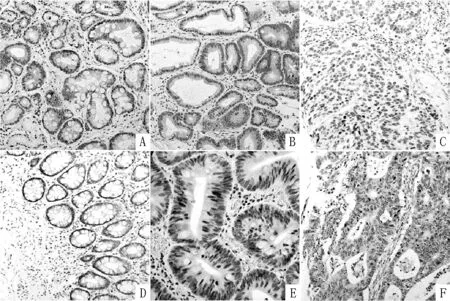
注:A为胃癌旁组织,B为胃腺瘤组织,C为胃癌组织,D为肠道癌旁组织,E为肠道腺瘤组织,F为肠道癌组织

图1 胃肠道组织中Parafibromin蛋白的表达(SP,×200)
2.2 Parafibromin蛋白表达阳性与临床病理特征的关系 Spearman等级相关分析显示,Parafibromin蛋白表达阳性与肿瘤直径、淋巴管侵袭、淋巴结转移、UICC分期呈负相关(P<0.05),与性别、年龄、静脉侵袭无相关性(P>0.05,见表2)。
2.3 Parafibromin蛋白表达与临床预后的关系 电话随访573例胃肠道癌患者,失访241例。生存时间为0.2~146.4个月,平均42.1个月。Kaplan-Meier法建立生存曲线显示,Parafibromin蛋白表达阴性患者累积生存率低于Parafibromin蛋白表达阳性患者(χ2=32.60,P<0.05,见图2)。利用Cox回归法建立多因素生存分析模型显示,年龄≥60岁、肿瘤直径≥4.5 cm、有淋巴管侵袭 、有淋巴结转移、UICC分期Ⅲ~Ⅳ期是胃肠道癌死亡的独立危险因素(P<0.05),而Parafibromin蛋白表达阳性是胃肠道癌死亡的保护因素(P<0.05,见表3)。
表2 Parafibromin蛋白表达阳性与临床病理特征的关系
Table2 Correlation between Parafibromin expression positive and clinicopathological features
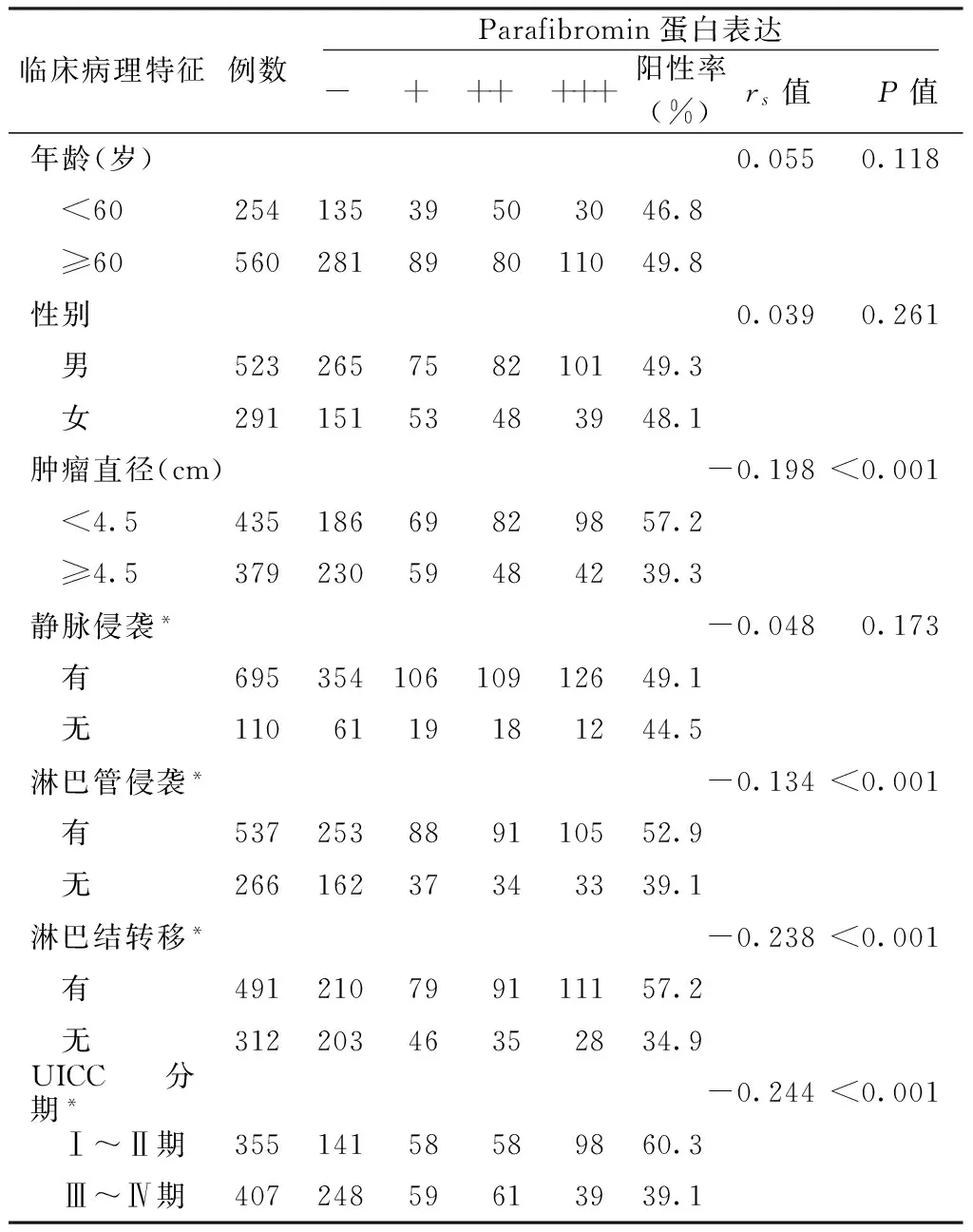
临床病理特征例数Parafibromin蛋白表达- + ++ +++阳性率(%)rs值 P值年龄(岁)0.0550.118 <6025413539503046.8 ≥60560281898011049.8性别0.0390.261 男523265758210149.3 女29115153483948.1肿瘤直径(cm)-0.198<0.001 <4.543518669829857.2 ≥4.537923059484239.3静脉侵袭*-0.0480.173 有69535410610912649.1 无1106119181244.5淋巴管侵袭*-0.134<0.001 有537253889110552.9 无26616237343339.1淋巴结转移*-0.238<0.001 有491210799111157.2 无31220346352834.9UICC分期*-0.244<0.001 Ⅰ~Ⅱ期35514158589860.3 Ⅲ~Ⅳ期40724859613939.1
注:*表示病例资料有缺失

图2 胃肠道癌Parafibromin蛋白表达阳性和阴性患者生存曲线
Figure2 Survival curves of Parafibromin expression positive and negative in gastrointestinal cancer patients
3 讨论
Parafibromin是一种核内表达的蛋白,由抑癌基因HRPT2编码合成。HRPT2位于人染色体1q31.2,由17个外显子构成,全长18.5 kb。Parafibromin蛋白包含531个氨基酸,分子量为60 kD[3-4]。Parafibromin蛋白调节的靶基因在癌症的增殖、凋亡及分化等方面起着重要作用,因此Parafibromin蛋白在恶性肿瘤中的表达及临床意义引起了学者的广泛关注,其在肿瘤发生发展中的作用也成为研究的热点问题之一。多个学者研究发现,Parafibromin蛋白在人体正常组织中具有较高的表达水平,而在甲状旁腺癌、肾细胞癌及乳腺癌中均表达下降[5-12]。研究证实,Parafibromin蛋白在胃癌及结肠癌组织中表达下降,参与了胃肠道癌的发生[13-14]。本研究进一步发现,Parafibromin蛋白的表达在胃肠道癌组织中低于癌旁组织和腺瘤组织,且其表达阳性与肿瘤直径、淋巴管侵袭、淋巴结转移及UICC分期呈负相关,与患者性别、年龄及静脉侵袭无关。以上结果均提示Parafibromin蛋白与胃肠道癌的发生发展具有密切关系。
表3 影响胃肠道癌患者预后的多因素Cox回归分析
Table3 Multivariate Cox regression analysis on influencing factors for gastrointestinal cancer patients
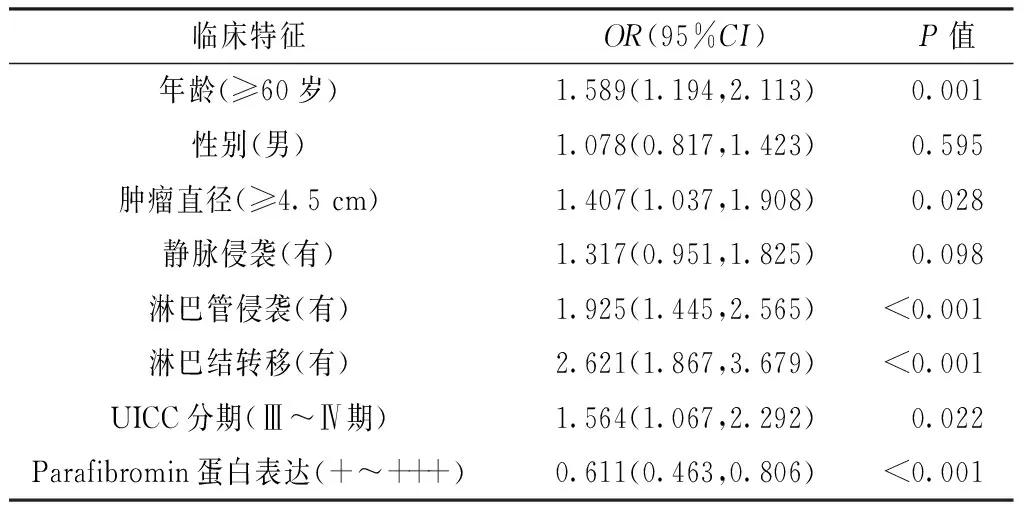
临床特征OR(95%CI)P值年龄(≥60岁)1.589(1.194,2.113)0.001性别(男)1.078(0.817,1.423)0.595肿瘤直径(≥4.5cm)1.407(1.037,1.908)0.028静脉侵袭(有)1.317(0.951,1.825)0.098淋巴管侵袭(有)1.925(1.445,2.565)<0.001淋巴结转移(有)2.621(1.867,3.679)<0.001UICC分期(Ⅲ~Ⅳ期)1.564(1.067,2.292)0.022Parafibromin蛋白表达(+~+++)0.611(0.463,0.806)<0.001
Rozenblatt-Rosen等[3]研究发现,Parafibromin蛋白可与剪切多聚腺苷酸化特异性因子(CPSF)、剪切刺激因子(CstF)以偶对蛋白(symplekin)形成复合物后启动mRNA前体断裂和多聚腺苷酸(polyA)聚合进而诱导mRNA成熟,增强整合体复合物亚基6蛋白(INTS6)表达后促进细胞周期G1阻滞。近年研究表明,Parafibromin蛋白与组蛋白甲基转移酶(HAT)形成复合物后将其甲基化组蛋白H3K4召集至细胞周期调控因子(Cyclin D1)启动子,复合物再与Cyclin D1的启动和编码区结合抑制Cyclin D1蛋白表达,导致细胞周期阻滞和细胞克隆形成降低[15]。有文献报道,Parafibromin蛋白可抑制c-myc 启动子活性且降低其蛋白稳定性,c-myc蛋白表达降低导致细胞增殖抑制[16]。c-myc蛋白表达升高不但促进细胞增殖,而且可提高细胞凋亡敏感性。c-myc蛋白还可通过提高Cyclin D1-Cdk4/Cdk6的亲和性促进细胞G1/S期转换[17]。Zheng等[13]研究发现,在结肠癌细胞中,过表达Parafibromin蛋白可导致细胞周期阻滞,抑制细胞增殖。本研究结果显示,随着肿瘤直径的增大,Parafibromin蛋白的表达呈下降趋势,提示在胃肠道癌发生发展过程中,Parafibromin蛋白抑制细胞增殖作用可能在逐渐减弱。Selvarajan 等[11]研究发现,乳腺癌Parafibromin蛋白表达下调与淋巴管侵袭、淋巴结转移及UICC分期相关。Zheng等[14]在胃癌中也发现Parafibromin蛋白表达与淋巴管侵袭、淋巴结转移及UICC分期密切相关。本研究发现,Parafibromin蛋白表达与患者性别、年龄及静脉侵袭无关,而与UICC分期、淋巴管侵袭、淋巴结转移有关,Parafibromin蛋白表达阳性率在有淋巴管侵袭或淋巴结转移的胃肠道癌组织低于无淋巴管侵袭或淋巴结转移的胃肠道癌组织,提示Parafibromin蛋白表达下降可能是促进癌症侵袭和转移的一个重要因素。Cox回归分析显示,年龄≥60岁、肿瘤直径≥4.5 cm、有淋巴管侵袭 、有淋巴结转移、UICC分期Ⅲ~Ⅳ期是胃肠道癌死亡的独立危险因素,而Parafibromin蛋白表达阳性是胃肠道癌死亡的保护因素。本研究随访573例胃肠道癌患者,发现Parafibromin蛋白表达阴性患者累积生存率低于Parafibromin蛋白表达阳性患者,进一步证实Parafibromin蛋白表达与胃肠道癌的预后密切相关。 综上所述,Parafibromin蛋白表达下调参与了胃肠道癌的发生,且与癌细胞的增殖、侵袭和转移密切相关,Parafibromin蛋白表达阳性可作为独立的良好预后指标。相信随着研究的不断深入,Parafibromin蛋白将在肿瘤的诊断、预防和治疗等方面成为重要的靶标分子。
1 de Martel C,Forman D,Plummer M.Gastric cancer:epidemiology and risk factors[J].Gastroenterol Clin North Am,2013,42(2):219-240.
2 Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008[J].International Journal of Cancer,2010,127(12):2893-2917.
3 Rozenblatt-Rosen O,Hughes CM,Nannepaga SJ,et al.The parafibromin tumor suppressor protein is part of a human Paf1 complex[J].Molecular and Cellular Biology,2005,25(2):612-620.
4 Chaudhary K,Deb S,Moniaux N,et al.Human RNA polymerase Ⅱ-associated factor complex:dysregulation in cancer[J].Oncogene,2007,26(54):7499-7507.
5 Aldred MJ,Talacko AA,Savarirayan R,et al.Dental findings in a family with hyperparathyroidism-jaw tumour syndrome and a novel HRPT2 gene mutation[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2006,101(2):212-218.
6 Masi G,Barzon L,Iacobone M,et al.Clinical,genetic,and histopathologic investigation of CDC73-related familial hyperparathyroidism[J].Endocrine-related Cancer,2008,15(4):1115-1126.
7 Pimenta FJ,Gontijo Silveira LF,Tavares GC,et al.HRPT2 gene alterations in ossifying fibroma of the jaws [J].Oral Oncology,2006,42(7):735-739.
8 Wang O,Wang C,Nie M,et al.Novel HRPT2/CDC73 gene mutations and loss of expression of parafibromin in Chinese patients with clinically sporadic parathyroid carcinomas[J].PLoS One,2012,7(9):e45567.
9 Witteveen JE,Hamdy NA,Dekkers OM,et al.Downregulation of CASR expression and global loss of parafibromin staining are strong negative determinants of prognosis in parathyroid carcinoma[J].Modern Pathology,2011,24(5):688-697.
10 Kim HK,Oh YL,Kim SH,et al.Parafibromin immunohistochemical staining to differentiate parathyroid carcinoma from parathyroid adenoma[J].Head Neck,2012,34(2):201-206.
11 Selvarajan S,Sii LH,Lee A,et al.Parafibromin expression in breast cancer:a novel marker for prognostication?[J].J Clin Pathol,2008,61(1):64-67.
12 Cui C,Lal P,Master S,et al.Expression of parafibromin in major renal cell tumors[J].Eur J Histochem,2012,56(4):e39.
13 Zheng HC,Takahashi H,Li XH,et al.Downregulated parafibromin expression is a promising marker for pathogenesis,invasion,metastasis and prognosis of gastric carcinomas[J].Virchows Arch,2008,452(2):147-155.
14 Zheng HC,Wei ZL,Xu XY,et al.Parafibromin expression is an independent prognostic factor for colorectal carcinomas[J].Human Pathology,2011,42(8):1089-1102.
15 Woodard GE,Lin L,Zhang JH,et al.Parafibromin,product of the hyperparathyroidism-jaw tumor syndrome gene HRPT2,regulates cyclin D1/PRAD1 expression[J].Oncogene,2005,24(7):1272-1276.
16 Lin L,Zhang JH,Panicker LM,et al.The parafibromin tumor suppressor protein inhibits cell proliferation by repression of the c-myc proto-oncogene[J].Proceedings of the National Academy of Sciences,2008,105(45):17420-17425.
17 Mateyak MK,Obaya AJ,Sedivy JM.c-Myc regulates cyclin D-Cdk4 and-Cdk6 activity but affects cell cycle progression at multiple independent points[J].Molecular and Cellular Biology,1999,19(7):4672-4683.
