互花米草入侵盐沼湿地CH4和N2O排放日变化特征研究
2014-02-09袁俊吉项剑刘德燕林永新丁维新
袁俊吉,项剑,刘德燕,林永新,丁维新*
1. 土壤与农业可持续发展国家重点实验室,中国科学院南京土壤研究所,江苏 南京 210008;2. 中国科学院大学,北京 100049
互花米草入侵盐沼湿地CH4和N2O排放日变化特征研究
袁俊吉1,2,项剑1,2,刘德燕1,林永新1,2,丁维新1*
1. 土壤与农业可持续发展国家重点实验室,中国科学院南京土壤研究所,江苏 南京 210008;2. 中国科学院大学,北京 100049
甲烷(CH4)和氧化亚氮(N2O)是导致全球气候变暖的2种重要温室气体,探索其源汇及地域排放特征一直是全球变化研究领域的核心内容。CH4和N2O通量的日变化研究是正确估算大时间尺度下CH4和N2O排放量的基础。利用静态箱法原位观测了江苏沿海芦苇(Phragmites australis)、盐蒿(Suada salsa)、光滩、水面以及互花米草(Spartina alterniflora)入侵湿地CH4和N2O排放的日变化特征。结果表明,1)互花米草湿地地上部生物量为1.70 kg·m-2,土壤有机碳质量分数为13.55 g·kg-1;分别是芦苇和盐蒿湿地的2.50~3.43和2.15~4.15倍。2)互花米草和芦苇湿地土壤10 cm处氧化还原电位(Eh)有明显日变化,最低值出现在3:00,最高值出现在12:00;光滩和盐蒿湿地没有明显的日变化。3)互花米草湿地CH4日平均排放通量为0.52 mg·m-2·h-1,是其他湿地的2.12~6.40倍;N2O日平均通量为-3.24 µg·m-2·h-1,显著低于盐蒿湿地、光滩和水面(P<0.05)。互花米草和芦苇湿地CH4排放通量最高值(0.73 mg·m-2·h-1和0.30 mg·m-2·h-1)出现在15:00,最低值(0.37 mg·m-2·h-1和0.17 mg·m-2·h-1)出现在3:00,均与土壤孔隙水中CH4浓度呈显著负相关(P<0.05)。互花米草湿地CH4排放通量与10 cm土温、Eh和生态系统CO2净交换量(NEE)显著正相关(P<0.05)。互花米草和芦苇湿地N2O通量9:00-18:00为负值,21:00—6:00为正值,均与NEE呈显著负相关(P<0.05)。盐蒿湿地、光滩和水面CH4和N2O排放通量没有明显日变化特征。互花米草入侵提高了沿海湿地CH4排放,但降低了N2O排放,植物对CH4传输作用以及向根际传输O2和易分解有机物是导致互花米草和芦苇湿地CH4和N2O排放表现出日变化特征的原因。
温室气体;日变化;互花米草;入侵;沿海湿地
最近一个半世纪以来地球表面平均气温的快速增长引发了国际间对温室气体排放及其潜在风险的广泛关注。二氧化碳(CO2)、甲烷(CH4)和氧化亚氮(N2O)是导致全球气候变暖的3种最重要的长生命期温室气体,探索其源汇及地域排放特征一直是全球变化研究领域的核心内容。自工业革命以来,大气中CO2、CH4和N2O浓度分别增长了141%、260%和120%(WMO, 2013),这种增长与人类活动密不可分(IPCC, 2007)。尽管CH4和N2O在大气层中的浓度远低于CO2,但是百年尺度全球增温潜势分别是CO2的25和298倍,导致大气层中CH4和N2O的辐照强度分别占温室气体总辐照强度的18%和6%。因此,土壤CH4和N2O排放的变化引起高度关注。
湿地CH4和N2O通量的日变化研究是正确估算大时间尺度下CH4和N2O排放量(如平均年排放量和季节排放量)的基础(叶勇等, 2000)。CH4和 N2O排放日变化特征受到多种生物和非生物因素的影响,包括温度(Mikkela等, 1995)、光照强度(Whiting和 Chanton, 1996)、植物生长状况(Jørgensen等, 2012)和气体传输机理等(Cheng等, 2007)。湿地植物根系分泌物为产甲烷菌提供底物,但是植物向根际传输O2也促进了CH4氧化;湿地植物对氮素的吸收和对土壤氧化还原状况的改变影响着硝化-反硝化过程。此外,植物通气组织为气体排放提供“通道”(Schutz等, 1991)。因此,湿地植被的结构组成以及植物的光合特性在很大程度上影响着CH4和N2O通量的日变化特征。
北美土著植物互花米草(Spartina alterniflora)于 1979年引入我国东海岸,由于极强的环境适应性和繁殖力,迅速侵占了土著植物盐蒿(Suaeda Salsa)和芦苇(Phragmites australis)等的生存空间,成为优势物种。C4植物互花米草其光合速率和初级生产力高于土著植物,显著提高了沿海湿地土壤有机碳(SOC)含量(Zhang等, 2010)。Cheng等(2006)发现互花米草入侵长江九段沙湿地后显著增加了土壤总碳氮库、有机碳氮库、易分解碳氮库等。盆栽试验表明,互花米草湿地较高的生物量和SOC促进了CH4和N2O排放(Cheng等, 2012; Zhang等, 2010; 项剑等, 2012)。本文选取江苏省大丰市沿海互花米草入侵湿地等为研究对象,通过比较不同类型湿地CH4和N2O通量的日变化特征,以期为准确估算沿海湿地温室气体排放和评估互花米草入侵的环境效应提供科学依据。
1 研究地区和研究方法
1.1 样地概况
研究样地设于江苏省盐城市国家级珍禽自然保护区的缓冲区(33°22'N,120°42'E)。该区域地处暖温带,主要受海洋性和大陆性气候影响,年均气温为12.6 ℃,年均降水量1040 mm。研究区域受黄海潮汐影响,为正规半日潮,潮汐振幅2~3 m,潮水盐度为30.0‰~32.0‰。本文选取5种典型的湿地类型(图 1),分别为开放水面、光滩、互花米草湿地、盐蒿湿地和芦苇湿地,5种湿地海拔依次升高。开放水面位于潮下带,为采样方便本文选择一常年淹水的潮汐沟,光滩位于潮间带的下部,互花米草湿地位于潮间带的中下部,盐蒿湿地位于潮间带的中上部,芦苇湿地位于潮上带。不同湿地随着海拔的升高,其被潮汐淹没的频率依次降低。
1.2 气体样品采集和分析
CH4和 N2O排放通量用静态箱-气相色谱法测定。2011年11月,在各湿地分别设立了3个固定采样位点,每个采样位点间隔3 m。采样箱底座采用下沿带孔的PVC槽架(50 cm×50 cm×20 cm,槽深5 cm)。在光滩、互花米草、盐蒿和芦苇湿地,将底座插入土壤20 cm使槽底与土壤表面齐平;开放水面设置可调节高度的支架,采样前1 d调节支架使槽底与水面齐平。采样箱为透明有机玻璃箱(50 cm×50 cm×50 cm),互花米草和芦苇湿地植被较高,采样时另加一个带槽透明中段(50 cm×50 cm×50 cm,槽深5 cm)。在每个固定采样地点(开放水面除外),距离采样箱底座20 cm处分别埋设氧化还原电位参比电极和Rhizon MOM土壤水样采集器。
于2012年8月16、17日进行CH4和N2O排放通量的日变化研究,采样日为晴天。采气时,预先向采样箱底座和中段的凹槽内注水2~3 cm,然后轻轻盖上采样箱。在盖箱后0、10、20和30 min,分别用50 mL注射器采集样品,注入已抽真空的钢化玻璃瓶(22 mL)中,同时记录箱内温度,每隔3 h采样一次,全天共采样8次。样品中CH4、N2O和CO2浓度用安捷伦气相色谱仪分析,生态系统CO2净交换量(NEE)为CO2通量的负值(Yu等, 2012)。每次气体采集结束后,立刻测定土壤10 cm处温度和氧化还原电位,同时采集土壤孔隙水。采样时,把已抽真空并装有一半体积 N2的玻璃瓶连接到Rhizon MOM水样采集器,通过瓶内负压让土壤孔隙水自动流入,采集的水样保存于4 ℃保温箱中,立即带回实验室测定气体浓度。
CH4、N2O和CO2的通量计算公式为:
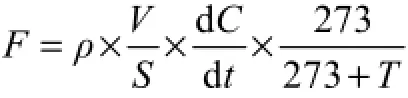
式中F为气体通量,即FCH(4以CH4计,mg·m-2·h-1)、FN2O(以N2O计,µg·m-2·h-1)和FCO2(以CO2计,mg·m-2·h-1),ρ为标准状态下 CH4、N2O和 CO2的密度(kg·m-3),V是密闭箱有效体积(m3),S为底座面积(m2),dC dt表示单位时间内密闭箱内CH4、N2O和CO2浓度变化量,T为密闭箱内平均气温(℃)。
水中CH4浓度计算方法如下:

式中 C为水中 CH4浓度(µmol·L-1),Ch为瓶中CH4体积分数(µL·L-1),β为水中CH4的Bunsen溶解系数(0.2742~0.3096 L·L-1,由盐度决定)(Wiesenburg和Guinasso, 1979),R为气体常数(0.0814),T为测定时室内温度(℃),Vh和Vp分别代表玻璃瓶上部空气体积和瓶内水的体积(mL)。
1.3 土壤和植株样品采集

图1 江苏沿海湿地断面结构Fig. 1 Transect of coastal salt marsh in Jiangsu province, China
用不锈钢采样器在每种湿地采集0~20 cm土壤样品,去除植物根系和枯落物后保存在4 ℃保温箱中带回实验室。新鲜土样中溶解态有机碳(DOC)提取时,以1∶2土水比25 ℃恒温震荡30 min,然后4 ℃下以4000 r·min-1离心25 min,上清液过0.45μm滤膜后用岛津碳氮分析仪测定。土壤NH4+-N和NO3–-N由2 mol·L-1KCl提取后用SAN++流动注射分析仪测定。风干样品中 SOC用重铬酸钾容量法测定。在芦苇、盐蒿和互花米草湿地临近采样点各划定3个50 cm×50 cm样方,分别测定样方内植株高度和密度,齐根割断植物地上部带回实验室,纯水清洗后70 ℃烘干至恒质量测定地上部生物量。
1.4 数据分析
数据的显著性检验采用SPSS 13.0软件中的单因素方差分析(ANOVA)方法分析,不同处理之间多重比较采用LSD(Least Significant Different)方法,然后进行t检验。CH4和N2O排放通量与环境因子的关系由线性回归和t检验判断。
2 结果与分析
2.1 不同湿地类型的土壤性质及地上生物量
互花米草入侵显著提高了沿海湿地0~20 cm土层SOC浓度。互花米草湿地SOC浓度是其他湿地的2.50~10.19倍,芦苇和盐蒿湿地SOC浓度也显著高于光滩和开放水面。互花米草入侵显著提高了土壤中DOC浓度,达到1.07 g·kg-1。互花米草湿地土壤 NH4+-N浓度显著高于其他类型湿地,但是NO3–-N浓度则显著低于光滩、盐蒿和芦苇湿地。互花米草湿地地上部分生物量为1.70 kg·m-2,是芦苇和盐蒿湿地的2.15和4.15倍(表1)。
2.2 10 cm处土温、水温和氧化还原电位日变化
光滩10 cm处土温的日平均值显著高于芦苇、盐蒿和互花米草湿地(表2)。所有湿地10 cm处土温、水温均表现出明显的日变化,最高值出现在12:00,水面和光滩最低值出现在3:00,互花米草、盐蒿和芦苇湿地最低值出现在6:00(图2)。
10 cm处氧化还原电位日平均值表现为:芦苇湿地>盐蒿湿地>光滩>互花米草湿地。互花米草和芦苇湿地土壤10 cm处氧化还原电位表现出明显的日变化,最低值出现在3:00,最高值出现在12:00;光滩和盐蒿湿地没有明显的日变化。

表1 沿海湿地土壤和植被性质Table 1 Soil and plant characteristics measured from the coastal salt marsh
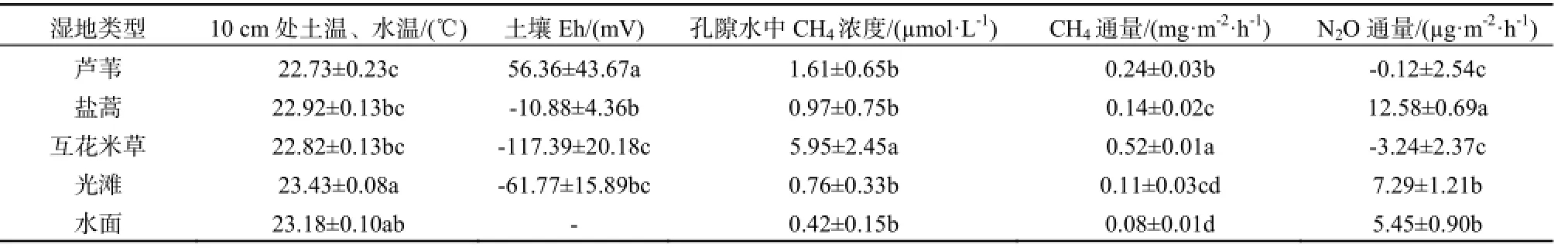
表2 湿地10 cm处土温、水温、土壤Eh、孔隙水中CH4浓度、CH4和N2O通量均值Table 2 Daily averages of soil and water temperature at 10 cm depth, soil Eh, porewater CH4concentration, CH4and N2O fluxes in the coastal salt marsh
2.3 土壤孔隙水中CH4浓度
土壤孔隙水中 CH4平均浓度为:互花米草湿地>芦苇湿地>盐蒿湿地>光滩>水面(表 2),互花米草湿地是其他湿地的3.71~14.02倍。回归分析表明,孔隙水中 CH4日平均浓度与 SOC(P=0.001, n=5)和DOC(P=0.003, n=5)呈极显著相关。互花米草和芦苇湿地土壤孔隙水中CH4浓度表现出明显的日变化,最高值出现在3:00,互花米草湿地15:00时浓度最低,芦苇湿地12:00时浓度最低(图3)。
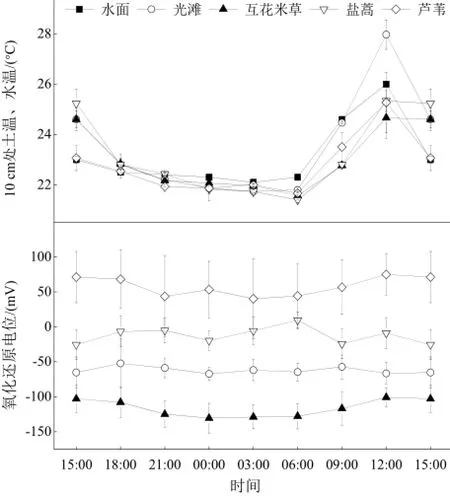
图2 湿地10 cm处土温、水温和氧化还原电位的日变化Fig. 2 Diel variation in soil and water temperature and redox potential at 10 cm depth in the coastal salt marsh

图3 沿海湿地土壤孔隙水中CH4浓度的日变化特征Fig. 3 Diel variation of CH4concentration in porewater in the coastal salt marsh
2.4 CH4和N2O排放通量
湿地CH4日平均排放通量为:互花米草湿地>芦苇湿地>盐蒿湿地>光滩>水面(表 2)。互花米草湿地是其他湿地的 2.12~6.40倍。芦苇湿地也显著高于盐蒿、光滩和水面(P<0.05)。回归分析表明,湿地CH4日平均排放通量与SOC(P<0.001, n=5)和DOC(P=0.013, n=5)呈显著正相关。
互花米草和芦苇湿地CH4排放呈现明显的日变化,最高值出现在15:00,最低值出现在3:00。CH4排放通量最大值与最小值的比值,互花米草和芦苇湿地分别为1.95和1.70。盐蒿、光滩和水面则没有明显的日变化(图4)。互花米草湿地CH4排放通量与土壤孔隙水中CH4浓度呈显著负相关(P<0.05),而与10 cm土温、土壤Eh和NEE呈显著正相关(P<0.05),芦苇湿地CH4排放通量与土壤孔隙水中CH4浓度呈显著负相关(表3)、与NEE呈正相关(P<0.05)。
互花米草和芦苇湿地 N2O日平均排放通量为负值,表明该两种湿地存在对大气中 N2O的净吸收。盐蒿、光滩和水面N2O日平均排放通量为正,是 N2O的排放源(表 2)。互花米草和芦苇湿地N2O通量呈现明显的日变化特征,表现为9:00~18:00时为负值,21:00~6:00时为正值(图4)。回归分析表明,互花米草和芦苇湿地N2O排放通量与NEE呈显著负相关(图5)(P<0.05)。
3 讨论
3.1 湿地CH4排放通量的日变化特征

图4 湿地CH4和N2O排放通量的日变化Fig. 4 Diel variation of CH4and N2O flux in the coastal salt marsh
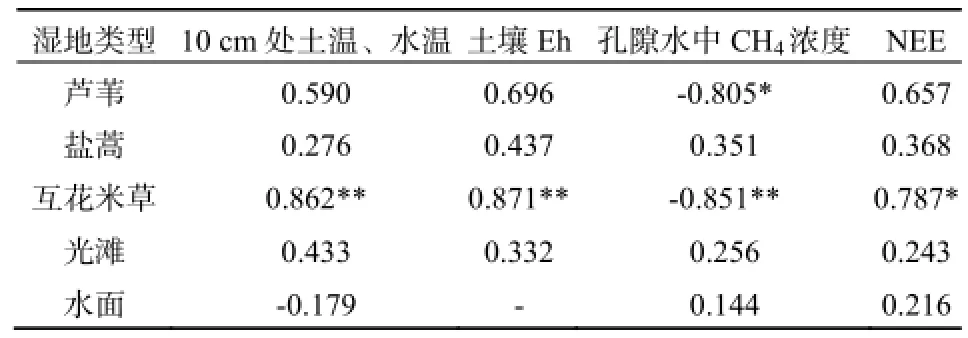
表3 CH4排放通量与10 cm处土温、水温、土壤Eh、孔隙水中CH4浓度和NEE的关系Table 3 Relationships between CH4flux and soil and water temperature at 10 cm depth, soil Eh, porewater CH4concentration and NEE in the coastal salt marsh

图5 互花米草和芦苇湿地N2O通量与NEE的关系Fig. 5 Relationship between N2O flux and NEE in S. alterniflora marsh and P. australis marsh
不同类型湿地CH4日平均排放通量存在着明显差异,互花米草湿地CH4日平均排放通量显著高于其他湿地。将不同类型湿地数据汇总分析,发现CH4排放通量与SOC和DOC呈显著正相关,表明互花米草入侵导致SOC积累显著提高了沿海湿地 CH4通量。CH4是湿地SOC厌氧分解的最后一步,SOC含量影响产甲烷底物的供应,从而影响CH4产生和排放。徐华等(2008)对我国 15种水稻土产甲烷潜力研究表明,无论在厌氧和好氧条件下,土壤产甲烷潜力与SOC含量显著相关。Shang等(2011)对双季稻区长期施肥试验田测定结果表明,不同施肥处理之间CH4排放量与SOC含量呈显著的线性关系。项剑等(2012)的研究表明,互花米草湿地CH4排放量的差异主要是由土壤 SOC含量不同引起。我们先前的研究发现(Yuan等, 2014),互花米草入侵导致 SOC积累提高了产甲烷底物三甲胺的含量,从而提高了产甲烷潜力。在本研究中,土壤孔隙水中CH4浓度与SOC和DOC呈极显著正相关,表明互花米草入侵导致的 SOC累积促进了沿海湿地CH4产生和排放。
在互花米草和芦苇湿地中,CH4排放通量表现出明显的日变化,最高值出现在 15:00,最低值出现在3:00。维管植物可以通过两种机理传输CH4:分子扩散和对流传输。一般而言,对流传输的CH4排放量远高于扩散方式的排放量(Whiting和Chanton, 1996)。Van der Nat等(1998)和 Kaki等(2001)研究发现,黑暗条件下芦苇以扩散方式进行传输CH4,而在光照条件下则以对流传输方式,导致CH4排放通量出现较大的日变化。但是只以扩散方式传输CH4的植物,其日变化较小。Ding等(2004)发现,毛果苔草湿地 CH4排放通量日最高值与最低值之比仅为1.44~1.86。此外,对流传输为主的植物由于在黑暗条件下气体传输受限,所以在上午光照强度增强时出现一个CH4排放峰值,一般出现在上午 9:00左右。但是互花米草和芦苇湿地CH4排放最大值与最小值之比分别为1.95和1.70,显著低于淡水芦苇的比值 4~26(Van der Nat等, 1998),而且在上午也未出现CH4排放峰值,表明互花米草和芦苇湿地CH4传输以扩散为主(Zhang和Ding, 2011)。盐蒿湿地孔隙水中CH4浓度和CH4排放没有明显的日变化,表明盐蒿传输CH4能力较弱。盐蒿植株缺少发达的通气组织且叶面长有蜡质层,可能会抑制CH4向大气中排放。植物光合过程中产生的O2子可以释放到根际,促进CH4氧化,降低 CH4排放量。但是互花米草和芦苇湿地 CH4排放通量与Eh呈正相关,我们推测植物光合作用对CH4传输的贡献远高于对CH4氧化的贡献。这与Ding等(2004)对毛果苔草湿地CH4排放日变化研究所发现的关键驱动因素不同。
前人研究认为,在无植物生长的湿地,土壤温度调控 CH4的产生,从而影响 CH4排放的日变化(Van der Nat等, 1998)。在本研究中,光滩和水面CH4排放没有明显的日变化且与10 cm处土温、水温无显著关系(表 3)。在无植物生长的湿地,扩散和冒泡是CH4传输的主要方式,尽管普遍认为冒泡排放的 CH4主要受土温影响(Fechner-Levy和Hemond, 1996),但是本试验中土温和水温的变化幅度很小,这可能导致无明显昼夜变化的原因。
3.2 湿地N2O排放通量的日变化特征
本试验中沿海湿地 N2O日平均通量为-3.14~12.58 µg·m-2·h-1,接近于Hirota等(2007)报道的日本潟湖盐沼湿地(-6~13 µg·m-2·h-1)以及Smith等(1983)报道美国的 Louisiana盐沼湿地(5.56 µg·m-2·h-1),但远低于 Bange(2006)获得的欧洲河口湿地(224.17~459.83 µg·m-2·h-1)。特别值得关注的是,互花米草和芦苇湿地N2O日平均通量为负值,表明存在对大气N2O吸收的现象。盐沼被认为是“氮限制”生态系统,湿地微生物和植被通常会受到低氮胁迫,有限的无机氮被高效利用而较少转化为N2O。当土壤中NO3–含量很低时,大气或土壤孔隙中的 N2O将成为反硝化过程中唯一的电子受体(Rosenkranz等, 2006)。Ryden(1983)认为当土壤中 NO3–浓度低于 1 mg·kg-1时就会产生N2O吸收现象。在本试验中沿海湿地土壤中 NH4+和NO3–含量很低。特别是互花米草和芦苇湿地由于生物量较大,其植物初级生产需要更多的氮素,可能会加剧这2种湿地中氮素的缺乏,从而导致N2O的吸收。
互花米草和芦苇湿地 N2O通量存在明显的日变化,表现为9:00—18:00时为净吸收,21:00—6:00为净排放。回归分析表明,N2O通量与NEE存在显著的负相关关系(图5)。Yu等(2012)认为,植物生长对氮素的需求加剧了根际氮素的缺乏,从而导致N2O吸收。植物向根际传输O2和分泌易分解有机物也可能促进N2O的吸收。由于氮素缺乏,硝化耦合反硝化是沿海湿地氮循环的主要形式,因此湿地中硝化过程在很大程度上控制着反硝化的进行(Rivera-Monroy和Twilley, 1996)。植物通气组织传输到根际的 O2促进了硝化反应,从而为反硝化细菌提供NO3–,促进反硝化。反硝化细菌被激活后,NO3–的缺乏会刺激消耗土壤中的N2O,从而导致大气N2O向土壤扩散。植物光合作用产生并释放到根际的分泌物,可以促进反硝化细菌生长,促进硝化耦合反硝化过程,导致N2O吸收。Jørgensen等(2012)报道,Phalaris arundinacea湿地根际土壤吸收的N2O量是非根际土壤的5~6倍。
4 结论
(1)互花米草入侵显著提高了沿海湿地CH4排放,但降低了N2O排放。
(2)互花米草和芦苇湿地CH4和N2O排放表现出明显的日变化特征,CH4排放通量白天大于夜间,N2O在白天为净吸收,夜间为净排放。盐蒿、光滩和水面均为CH4和N2O排放源,通量无明显日变化。
(3)植物对 CH4传输作用以及向根际传输 O2和易分解有机物是导致互花米草和芦苇湿地CH4和N2O排放表现出日变化特征的原因。
BANGE H W. 2006. Nitrous oxide and methane in European coastal waters[J]. Estuarine, Coastal and Shelf Science, 70: 361-374.
CHENG X L, LUO Y Q, CHEN J Q, et al. 2006. Short-term C4plant Spartina alterniflora invasions change the soil carbon in C3plant-dominated tidal wetlands on a growing estuarine island[J]. Soil Biology and Biochemistry, 38: 3380-3386.
CHENG X, PENG R, CHEN J et al. 2007. CH4and N2O emissions from Spartina alterniflora and Phragmites australis in experimental mesocosms[J]. Chemosphere, 68: 420-427.
DING W X, CAI Z C, TSURUTA H. 2004. Diel variation in methane emissions from the stands of Carex lasiocarpa and Deyeuxia angustifolia in a cool temperate freshwater marsh[J]. Atmospheric Environment, 38: 181-188.
FECHNER-LEVY E, HEMOND H F. 1996. Trapped methane volume and potential effects on methane ebullition in a northern peatland[J]. Limnology and Oceanography, 41: 1375-1383.
HIROTA M, SENGA Y, SEIKE Y, et al. 2007. Fluxes of carbon dioxide, methane and nitrous oxide in two contrastive fringing zones of coastal lagoon, Lake Nakaumi, Japan[J]. Chemosphere, 68: 597-603.
IPCC (Intergovernmental Panel on Climate Change). 2007. Climate change 2007: The physical science basis. In: Solomon S, Qin D, Manning M, et al. (Eds.), Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change[M]. Cambridge University Press, Cambrige, UK.
JØRGENSEN C J, STRUWE S, ELBERLING B. 2012.Temporal trends in N2O flux dynamics in a Danish wetland-effects of plant-mediated gas transport of N2O and O2following changes in water level and soil mineral-N availability[J]. Global Change Biology, 18: 210-222.
KAKI T, OJALA A, KANKAALA P. 2001. Diel variation in methane emissions from stands of Phragmites australis (Cav.) Trin. Ex steud. and Typha latifolia L. in a boreal lake[J]. Aquatic Botany, 71: 259-271. MIKKELA C, SUNDH I, SVENSSON B H, et al. 1995. Diurnal variation in methane emission in relation to the water table, soil temperature, climate and vegetation cover in a Swedish acid mire[J]. Biogeochemistry, 28: 93-114.
RIVERA-MONROY V H, TWILLEY R R. The relative role of denitrification and immobilization in the fate of inorganic nitrogen in mangrove sediments (Terminos Lagoon, Mexico) [J]. Limnology and Oceanography, 41: 284-296.
ROSENKRANZ P, BRÜGGEMANN N, PAPEN H, et al. 2006. N2O, NO and CH4exchange, and microbial N turnover over a Mediterranean pine forest soil[J]. Biogeosciences, 3: 121-133.
RYDEN J. 1983. Denitrification loss from a grassland soil in the field receiving different rates of nitrogen as ammonium nitrate[J]. Journal of Soil Science, 34: 355-365.
SCHUTZ H, SCHRUDER P, RENNENBERG H. 1991. Role of plants in regulating methane flux to the atmosphere. In: Sharkety T D, Holland E A, Mooney H A. (Eds.), Trace Gas Emissions by Plants[M]. Academic Press, New York, pp. 29-57.
SHANG Q Y, YANG X X, GAO C M, et al. 2011. Net annual global warming potential and greenhouse gas intensity in Chinese double rice cropping systems: A 3-year field measurement in long-term fertilizer experiments[J]. Global Change Biology, 17: 2196-2210.
SMITH C, DELAUNE R, PATRICK JR W. 1983. Nitrous oxide emission from Gulf Coast wetlands[J]. Geochimica et Cosmochimica Acta, 47: 1805-1814.
VAN DER NAT F J W A, MIDDELBURG J J, VAN METEREN D, et al. 1998. Diel methane emission patterns from Scirpus lacustris and Phragmites australis[J]. Biogeochemistry, 41: 1-22.
WHITING G J, CHANTON J P. 1996. Control of the diurnal pattern of methane emission from emergent aquatic macrophytes by gas transport mechanism[J]. Aquatic Botany, 54: 237-253.
WIESENBURG D A, GUINASSO N L. 1979 Equilibrium solubilities of methane, carbon monoxide, and hydrogen in water and sea water[J]. Journal of Chemical and Engineering Data, 24: 356-360.
WMO (Greenhouse Gas Bulletin). 2013. The state of greenhouse gases in the atmosphere using global observations through 2012[EB/OL]. http://www.wmo.int/pages/prog/arep/gaw/ghg/GHGbulletin.html.
YU Z J, LI Y J, DENG H G, et al. 2012. Effect of Scirpus mariqueteron nitrous oxide emissions from a subtropical monsoon estuarine wetland[J]. Journal of Geophysical Research, 117: G02017.
YUAN J J, DING W X, LIU D Y, et al. 2014. Methane production potential and methanogenic archaea community dynamics along the Spartina alterniflora invasion chronosequence in a coastal salt marsh[J]. Applied Microbiology and Biotechnology, 98: 1817-1829.
ZHANG Y H, DING W X, CAI Z C, et al. 2010. Response of methane emission to invasion of Spartina alterniflora and exogenous N deposition in the coastal salt marsh[J]. Atmospheric Environment, 44: 4588-4594.
ZHANG Y H, DING W X, LUO J F, et al. 2010. Changes in soil organic carbon dynamics in an Eastern Chinese coastal wetland following invasion by a C4plant Spartina alterniflora[J]. Soil Biology and Biochemistry, 42: 1712-1720.
ZHANG Y H, DING W X. 2011. Diel methane emissions in stands of Spartina alterniflora and Suaeda salsa from a coastal salt marsh[J]. Aquatic Botany, 95: 262-267.
项剑, 刘德燕, 袁俊吉, 等. 2012. 互花米草入侵对沿海湿地甲烷排放的影响[J]. 生态学杂志, 31(6): 1361-1366.
徐华, 蔡祖聪, 八木一行. 2008. 水稻土CH4产生潜力及其影响因素[J].土壤学报, 45(1): 98-104.
叶勇, 卢昌义, 林鹏, 等. 2000. 河口红树林湿地CH4通量的日变化研究[J]. 海洋学报, 22(3): 103-109.
Diel Variation of CH4and N2O Emissions in the Salt Marsh with Spartina alterniflora Invasion
YUAN Junji1,2, XIANG Jian1,2, LIU Deyan1, LIN Yongxin1,2, DING Weixin1*
1. State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China
2. University of Chinese Academy of Sciences, Beijing 100049, China
Atmospheric CH4and N2O are two most potent long-lived greenhouse gases that contribution to global warming. Sources and sinks of CH4and N2O and the processes driving their spatio-temporal heterogeneity are critically important to global change. Understanding the diel variation in CH4and N2O emissions is of importance to estimating CH4and N2O budgets in large spatial and time scales. In this study, diel variations of CH4and N2O fluxes in coastal salt marsh that invaded by Spartina alterniflora and vegetated with or without native Phragmites australis and Suaeda salsa were measured in site by using static chamber technique. Our results showed that aboveground biomass in S. alterniflora marsh was 1.70 kg·m-2and SOC concentration was 13.55 g·kg-1, which were 2.50~3.43 and 2.15~4.15 times, respectively, those of P. australis and S. salsa marshes. Soil radox potential at 10-cm depth showed apparent diel variations in S. alterniflora and P. australis marshes, which were both highest at 12:00 am and lowest at 3:00 am. However, no significant diel variations of radox potential were found in S. salsa marsh, bare tidal flat and open water. Mean CH4flux was 0.52 mg·m-2·h-1in S. alterniflora marsh, which was 2.14~6.40 times those in other sites. Mean N2O flux was -3.24 µg·m-2·h-1in S. alterniflora marsh and was significantly lower than those in S. salsa marsh, tidal flat and open water. CH4fluxes peaked at 0.73 and 0.30 mg·m-2·h-1at 15:00 and showed the lowest of 0.37 and 0.17 mg·m-2·h-1at 3:00 in S. alterniflora and P. australis marshes, respectively. CH4fluxes were negatively (P<0.05) correlated with porewater CH4concentrations in S. alterniflora and P. australis marshes and it was positively (P<0.05) correlated with soil temperature and redox potential at 10 cm and net ecosystem CO2exchange (NEE) in S. alterniflora marsh. N2O fluxes were negative at 9:00-18:00 and positive at 21:00~6:00 and were negatively correlated with NEE in S. alterniflora and P. australis marshes. No discernible diel variations were observed in the CH4and N2O fluxes in S. salsa marsh, tidal flat and open water. Our results suggest that S. alternniflora invasion stimulates CH4emissions but decreases N2O emissions from Chinese coastal salt marsh, and the extent of diel variations in CH4flux depend on the gas transport capacity of plants, and capacity of transport O2and organic substrate supply down to the rhizosphere by plants may drive the diel variations in N2O exchanges.
greenhouse gas; diel variation; Spartina alterniflora; invasion; salt marsh
X144;S153.6+21
:A
:1674-5906(2014)08-1251-07
袁俊吉,项剑,刘德燕,林永新,丁维新. 互花米草入侵盐沼湿地CH4和N2O排放日变化特征研究[J]. 生态环境学报, 2014, 23(8): 1251-1257.
YUAN Junji, XIANG Jian, LIU Deyan, LIN Yongxin, DING Weixin. Diel Variation of CH4and N2O Emissions in the Salt Marsh with Spartina alterniflora Invasion [J]. Ecology and Environmental Sciences, 2014, 23(8): 1251-1257.
中国科学院战略性科技先导专项(XDA05020500);国家自然科学基金项目(41001045、41171190)
袁俊吉(1985年生),男,博士研究生,主要从事土壤碳氮循环和湿地温室气体排放研究。E-mail: jjyuan@issas.ac.cn *通讯作者:E-mail: wxding@issas.ac.cn
2014-06-19
