菌根真菌侵染对植物生物量累积的影响
2014-02-09唐旭利张倩媚
童 琳,唐旭利*,张 静,张倩媚
1. 中国科学院华南植物园,广东 广州 510650;2. 中国科学院大学,北京 100049;3. 中国科学院退化生态系统植被恢复与管理重点实验室,广东 广州 510650
菌根真菌侵染对植物生物量累积的影响
童 琳1,2,3,唐旭利1,3*,张 静1,2,3,张倩媚1
1. 中国科学院华南植物园,广东 广州 510650;2. 中国科学院大学,北京 100049;3. 中国科学院退化生态系统植被恢复与管理重点实验室,广东 广州 510650
为了从生态系统尺度探讨菌根资源与植物生物量累积的关系,调查了鼎湖山不同成熟度的三个森林群落主要优势树种的菌根侵染情况。综合分析各森林群落优势树种的个体数、生物量和菌根侵染率发现:1)菌根侵染率与径向生长速率相关,植物生长迅速的阶段菌根侵染率更高。中径级(胸径15~30 cm)的马尾松(Pinus massoniana)和锥(Castanopsis chinensis)的侵染率比小径级(胸径1~15 cm)个体的侵染率高,而大径级个体(胸径30 cm以上)的侵染率略低于中径级个体的侵染率。木荷(Schima superba)则表现出侵染率随着胸径增大而增高的趋势。2)树种在群落内的侵染率越高,其对群落生物量的贡献率越大。如马尾松在马尾松林和混交林的侵染率分别为(77.30±18.02)%和(40.50±14.42)%,其对马尾松林群落生物量的贡献率达到87.43%,是对混交林生物量贡献率(17.51%)的5倍。混交林和阔叶林的共有优势树种锥的侵染率和生物量贡献率也有存在相同规律。3)根系碳储量占群落总碳储量比例较高的群落其优势树种平均侵染率相对较高。马尾松林、混交林和季风常绿阔叶林中,根系碳储量占群落总碳储量的比例分别为55%、54%、42%,群落优势树种平均侵染率分别为(66.73±10.55)%、(46.97±27.28)%、(54.22±25.45)%,马尾松林的根系碳储量和平均侵染率均高于混交林和季风常绿阔叶林。以上结果表明,菌根真菌侵染对于植物个体生长速率以及群落水平的生物量累积具有一定的促进作用。
菌根;群落;侵染率;生物量;胸径;根系碳储量
丛枝菌根(arbuscular mycorrhiza,AM)和外生菌根(ectomycorrhiza,ECM)是森林生态系统中分布最为广泛的菌根类型,约80%的维管植物能形成这两种类型的菌根(Smith和Read,2008;Brundrett,2009)。在菌根共生体中,宿主植物将一部分光合作用固定的碳——己糖提供给真菌(Paul和Kucey,1981;Jakobsen和Rosendahl,1990;Nemec和Vu,1990;Shachar-Hill等,1995;Fitter,2006;Helgason和Fitter,2009;Smith和Smith,2012),菌根真菌则通过根外菌丝增大根系对土壤溶液的吸收面积,且能活化K+、Ca2+、Mg2+等土壤阳离子(Arocena和Glowa,2000;Jentschke等,2000),提高植物对氮、磷、钾、钙、镁等营养元素的吸收效率(Nemec和Vu,1990;Hodge,2001,2003;Fitter,2006;Helgason和Fitter,2009;Smith和Smith,2012)。菌根共生体对于植物群落的稳定性有重要意义。近年来,我国已经开展过一些关于森林生态系统菌根资源的研究。自然生境的菌根研究集中在ECM真菌和AM真菌的种属分类及生态分布等方面(石兆勇等,2003;Zhang和Guo,2005;房辉等,2006;贺学礼等,2010;何新华等,2012),对于生态系统尺度菌根的生态学功能研究较为缺乏。已有的菌根生态学方面的研究多以盆栽栽培实验为主要手段,研究对象多为草本植物(Martin和Stutz,2004;蔡晓布等,2005;于永光和赵斌,2008),研究内容侧重菌根真菌对宿主幼苗养分吸收和个体发育的影响(阎秀峰和王琴,2004;于永光和赵斌,2008)。目前,关于菌根对植物个体生长速率和群落水平的生物量累积的影响报道不多。
侵染率(侵染率=被侵染的根段数/观察的总根段数)是较为客观的菌根研究指标,能够反映某一时段生态系统的菌根侵染状况。土壤理化性质(如氮、磷元素形态)、降水、温度以及植物种类都直接影响真菌孢子的萌发、菌丝长度和菌丝分支,通过测定菌根真菌的侵染率,可以观测菌根真菌与环境条件的影响与适应特征。在群落生态学中,往往以相对多度、相对频度和相对显著度之和反映植物物种在群落中的相对重要值(Curtis和Mcintosh,1951),植物数量特征是群落生态学较为核心的研究指标。菌根真菌与植物根系共生在群落生态学中的重要作用较少被关注。
为了探讨菌根真菌侵染对群落中植物数量和生物量累积的影响,本研究以鼎湖山自然保护区的三个森林群落为研究对象,调查各群落中优势树种的菌根侵染率、优势树种数量和生物量特征,综合分析侵染率对树种径向生长速率、生物量和根系碳储量的可能影响。对于研究森林生态系统菌根资源和生物量累积受植物、真菌调控的影响具有重要意义。
1 研究地概况
研究地点位于广东省肇庆市的鼎湖山自然保护区(112°30′39″~112°33′41″E,23°09′21″~23°11′30″N),该区气候属于典型的南亚热带湿润季风气候,年均气温20.9 ℃,年均降雨量1929 mm,雨季(4—9月)降雨量高达年降雨量的80%。土壤为酸性赤红壤。保护区内具有三种典型的亚热带植被类型:马尾松林(PF)、针阔叶混交林(MF)和季风常绿阔叶林(BF),分别代表该区自然演替初期、中期和顶级阶段。
演替初期的PF分布在海拔50~200 m,由20世纪50年代人工种植的马尾松纯林发育而成。优势树种为马尾松(Pinus massoniana)、白楸(Mallotus paniculatus)和三桠苦(Evodia lepta)。演替中期的MF分布在海拔100~250 m,是阔叶树种入侵马尾松人工林后演替形成的群落类型,主要木本植物为马尾松、锥(Castanopsis chinensis)和木荷(Schima superba)。演替顶级的BF分布于海拔250~400 m,已有400年的保护历史,主要木本植物类群有锥、肖蒲桃(Acmena acuminatissima)、木荷、云南银柴(Aporusa yunnanensis)、橄榄(Olea europaea)、窄叶半枫荷(Pterospermum lanceaefolium)、厚壳桂(Cryptocarya chinensis)、白颜树(Gironniera subaequalis)以及臀果木(Pygeum topengii)等。其中,马尾松为PF与MF的共有优势树种,锥和木荷为MF与BF的共有优势树种。
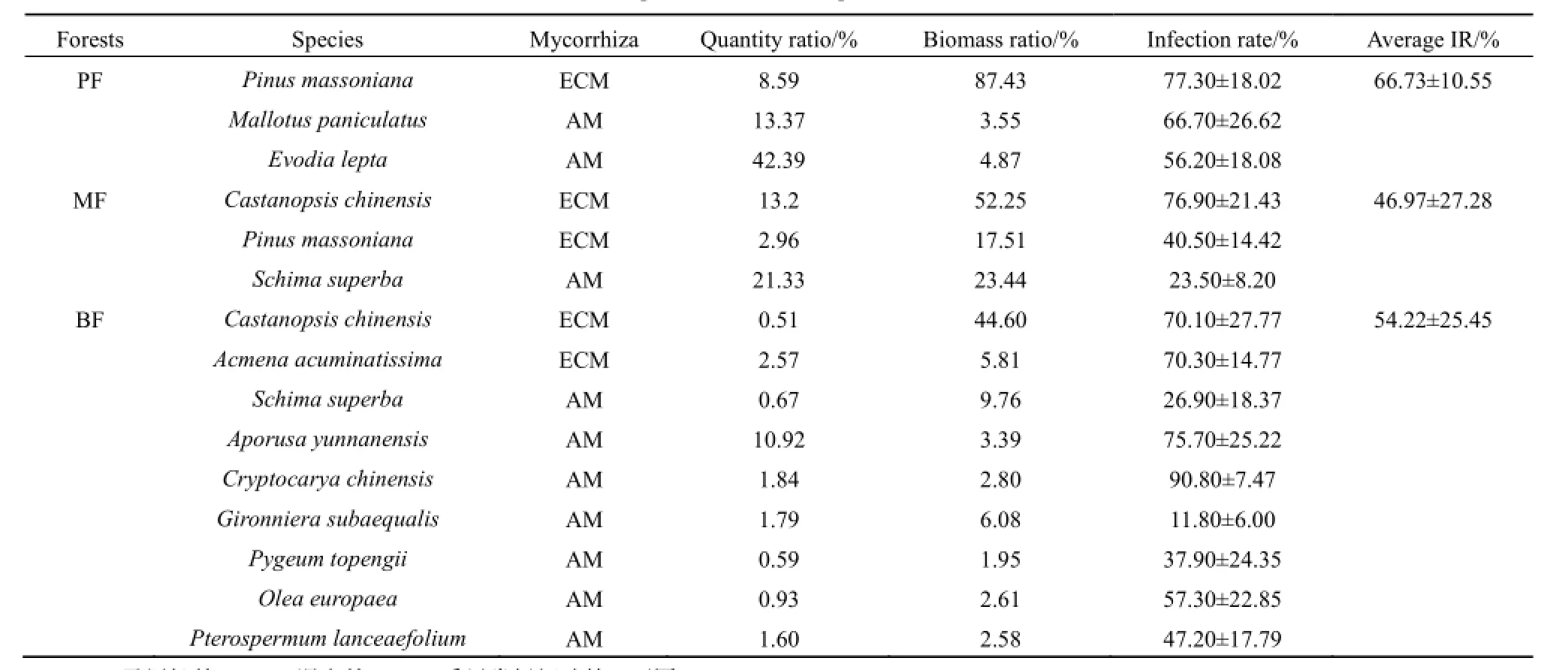
表1 三个森林群落的优势树种基本状况Table 1 Properties of dominant species in three forests
2 研究方法
2.1 样品采集
选取三个森林群落内生物量比重>2%和个体数比重>0.5%的优势树种为研究对象(表1),于2012年7月对各群落主要优势树种的代表性个体进行采样。三个森林群落之间的共有优势树种马尾松、锥和木荷的生物量随着胸径的分布特征为15~30 cm胸径的个体生物量占该树种总生物量的比重最大,胸径1~15 cm和胸径30 cm以上的个体生物量相对较低(图1)。采样时,选取1~15 cm(小径级),15~30 cm(中径级),>30 cm(大径级)三个胸径范围内的代表性个体(若树种缺失某一径级范围内个体,则该径级范围不作分析)。每个径级选取5株个体进行采样,个体间相距100 m以上,在样木树冠滴水线东、西、南、北各向采集根样(仝瑞建,2011)。采集根系样品时,先根据粗根辨识需采集的树种,再顺着侧根方向挖取直径2 mm以下的细根,同时用图文方式记录根系特征供鉴定。细根样品带回实验室,挑洗供测定侵染率使用。
优势树种的个体数和生物量数据来自鼎湖山站基础数据库。
2.2 室内分析
2.2.1 外生菌根(ECM)侵染率测定
细根用FAA(福尔马林-醋酸-酒精固定液,formalin–acetic acid–alcohol)固定24 h后取出,洗净,用解剖刀将末级根切下,每份样品取100个根段,用Stemi SV11体视显微镜进行镜检,根尖有菌套或根外皮层细胞间隙有哈蒂氏网者为外生菌根。外生菌根侵染率由ECM侵染根段数占镜检根段总数的百分比表示:
ECM侵染率=(ECM侵染根段数/镜检总根段数)×100%
2.2.2 内生菌根(AM)侵染率测定
采用Phillips和Hayman(Phillips和Hayman,1970)方法对细根染色,用解剖刀将末级根切下,每份样品取100个根段,压片,用AXIOPLAN 2 Iminage正立荧光显微镜进行镜检,根尖有泡囊、胞内或胞间有丛枝或菌丝者为丛枝菌根。丛枝菌根的侵染率由AM侵染根段数占镜检根段总数的百分比表示:
AM侵染率=(AM侵染根段数/镜检总根段数)×100%
2.3 数据处理
应用PASW Statistics 18.0进行统计分析和SigmaPlot 10.0作图。
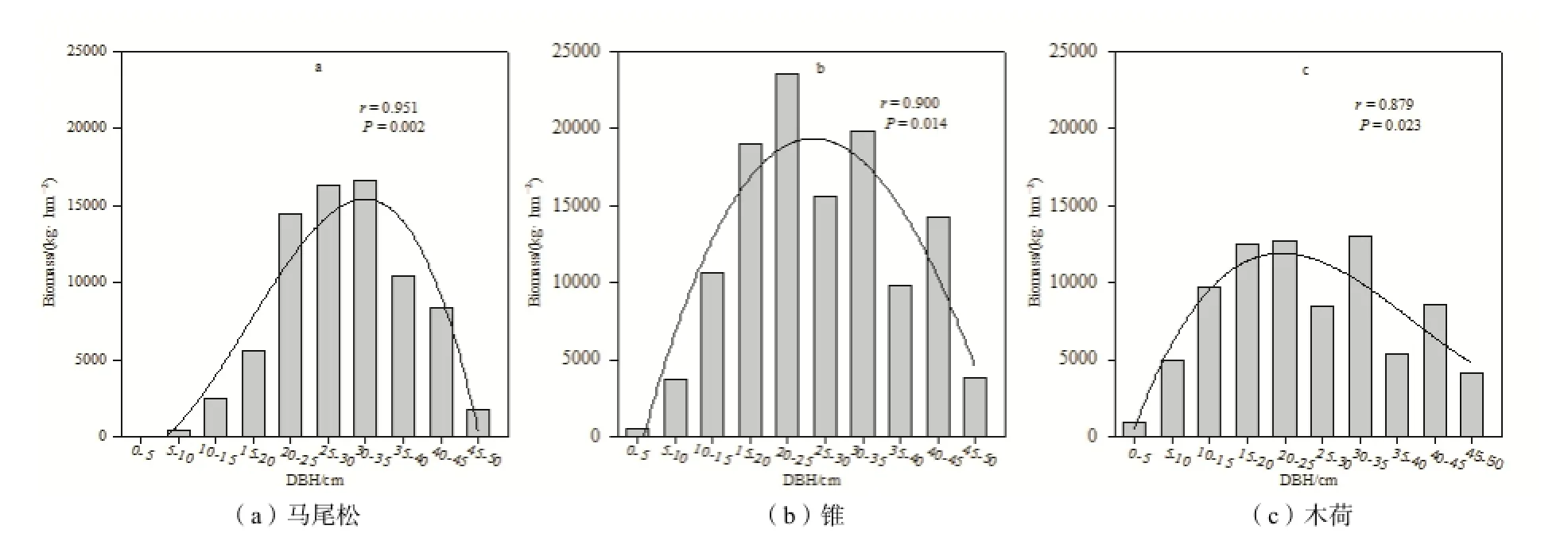
图1 群落之间的共有优势树种生物量随胸径的分布规律Fig. 1 Biomass of codominant species with different DBHs
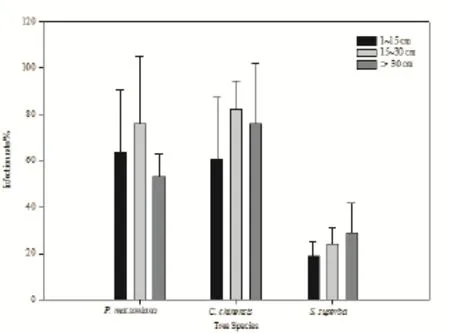
图2 不同胸径树种的菌根侵染率Fig. 2 Infection rate of codominant species with different DBHs
3 结果
3.1 生物量随胸径的分布规律
最近(2010年)的样地调查结果显示,三个森林群落之间的共有优势树种马尾松、锥和木荷的生物量随着胸径变化呈现一定规律性,15~30 cm胸径的个体生物量占该树种总生物量的比重较大,其中25~30 cm胸径的个体生物量达到峰值;胸径1~15 cm和胸径30 cm以上的个体生物量占该树种总生物量的比重明显低于15~30 cm胸径的个体(图1)。
3.2 不同径级优势树种菌根侵染率
按照群落之间的共有优势种马尾松、锥和木荷的生物量随胸径的变化规律将采样个体按照1~15、15~30和>30 cm划分为小、中、大3个胸径等级,比较侵染率随径级大小的变化趋势。如图2所示,马尾松和锥中径级(15~30 cm)的个体平均侵染率较小径级(1~15 cm)和大径级(>30 cm)的高,整体呈现侵染率随个体胸径的增大先升高后降低的趋势。木荷的侵染率则表现出随着胸径的增大而增高的趋势(图2),但各个树种侵染率在三个胸径范围之间的差异并未达到统计学上的显著水平(P>0.05)。
3.3 优势树种菌根侵染率与树种生物量
比较群落之间的共有优势树种发现,侵染率越高的共有优势树种对群落生物量的贡献比重往往越高。PF中马尾松生物量占总生物量的87.43%,马尾松在该群落的侵染率高达(77.30±18.02)%。MF中马尾松生物量仅占群落生物量的17.51%,相应的,马尾松在MF的侵染率也较低,为(40.50±14.42)%。锥对MF生物量的贡献高达52.25%,在MF中锥的侵染率相应较高,达到(76.90±21.43)%。锥对BF生物量的贡献率(44.60%)略低于对MF生物量的贡献率,在BF内锥的菌根侵染率(70.10±27.77)%也低于其在MF内的侵染率。MF和BF的共有优势树种木荷的侵染率与生物量百分比之间没有明显的规律性(表1、图3)。对群落之间共有优势树种的侵染率与生物量百分比作Pearson相关性分析发现,二者呈显著的正相关关系(P<0.05),树种侵染率高,则其生物量百分比也相对较高(表2)。
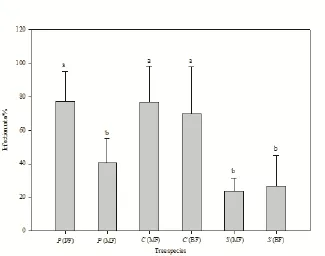
图3 三个森林群落之间的共有优势种的菌根侵染率Fig.3 Mycorrhizal infection rate of codominant species in three forests
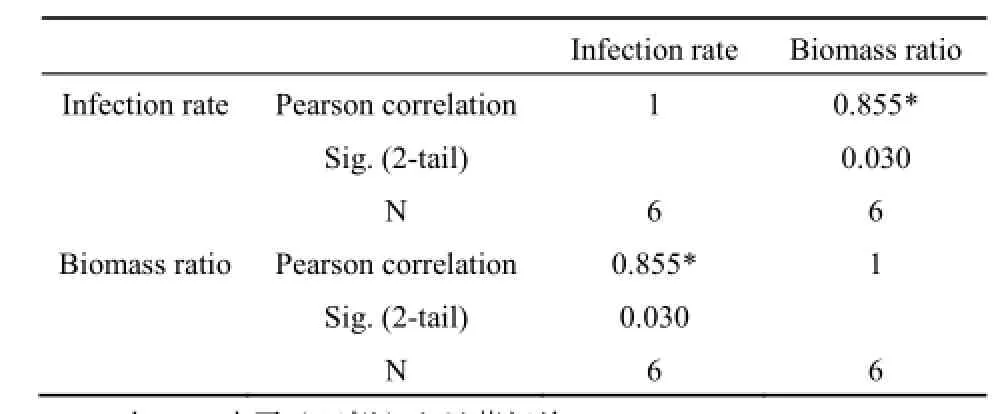
表2 群落间共有优势种菌根侵染率与生物量百分比的相关性Table 2 Correlation between infection rate and biomass ratio
3.4 三个森林群落的菌根侵染特征
马尾松林的马尾松(ECM)生物量(87.43%)比重占绝对优势地位,混交林中,锥(ECM)、马尾松(ECM)和木荷(AM)的生物量比重分别为52.25%、17.51%和23.44%,季风常绿阔叶林的锥(ECM)和木荷(AM)对群落生物量贡献的较大,分别为44.60%、9.76%。马尾松林、混交林和季风常绿阔叶林的平均侵染率分别为(66.73±10.55)%、(46.97±27.28)%、(54.22±25.45)%(表2)。马尾松林的平均侵染率相对高于混交林和季风常绿阔叶林。
4 讨论
4.1 真菌侵染率与植物个体生长速率
本研究表明,胸径从1~15 cm过渡到15~30 cm,马尾松和锥(ECM植物)的侵染率增高,胸径达到30 cm以上时,侵染率呈降低趋势。对油松幼苗的研究发现外生菌根真菌侵染率与油松幼苗生长成正相关(r=0.8924,P<0.05),植株生长越迅速,其侵染率越高(张茹琴等,2011)。已有研究表明南亚热带地区小于12龄的马尾松年均径向增长率(1.31 cm·a-1)高于12龄以上的年均径向增长率(1.03 cm·a-1)。30 cm胸径的马尾松树龄约为28 a(卢翠香等,2012),幼龄期的马尾松菌根侵染率较高,快速生长一定时间段(28 a左右,胸径达到30 cm以上)后,生长速率降低,生物量累积缓慢。因此,菌根侵染率与径向生长有关,植物生长迅速的时间段菌根侵染率也更高,从而提高植物根系的养分吸收效率,促进植物生长。对马尾松采伐年龄的模型预测值为30~45 a(李贤伟等,1996;丁贵杰等,1998;韦新良等,2001),与本研究推算的马尾松径向生长速率剧减阶段的树龄接近。木荷的侵染率随着胸径的增大逐渐增高,表明木荷的径向增长速率可能大于马尾松和锥,或径向生长剧减期晚于马尾松和锥,使得木荷的侵染率呈现出在所测胸径范围内随着胸径的增大而增高的趋势。然而,由于计算过程中将三个群落作为一个整体,而各群落演替程度不同,同一径级树种个体的年龄差异使分析结果的标准差较大,从而导致不同径级之间的侵染率差异不显著。
4.2 菌根侵染对群落养分积累的影响
对三个不同演替阶段森林群落侵染率的分析发现群落之间共有优势树种菌根侵染率和树种生物量随着森林群落的演替呈下降的趋势,侵染率高的共有优势树种对群落生物量的贡献率往往也较大。马尾松是演替初期的PF的建群树种,其生物量百分比和侵染率在演替初期的PF中皆高于演替中期的MF;锥是演替中期的MF的优势树种,其生物量百分比和侵染率在演替中期的MF中皆高于演替顶级的BF(表2、图3)。不同演替阶段森林群落的优势树种类型、个体数存在较大差异。PF树种类型比较单一,优势树种个体数较多,BF树种类型丰富,优势树种个体数较少,MF优势树种类型和数量在三个群落内属于中间位置。长期监测的结果表明,三个森林的根系碳储量分别为群落碳储量的55%(PF)、54%(MF)、42%(BF)(周国逸等,2005),优势树种平均侵染率分别为(66.73±10.55)%、(46.97±27.28)%、(54.22±25.45)%(表2)。马尾松林的平均侵染率相对高于混交林和季风常绿阔叶林。菌根真菌侵染对植物和群落的养分净积累有一定的积极影响,群落之间共有优势树种的侵染率较高的树种,其对群落养分净积累的贡献比重更大。在陆地生态系统中,菌根真菌通过菌丝体、土壤微生物、植物个体和群落影响生态系统的过程与功能(Rillig,2004)。因此,菌根真菌在植物生物量累积过程中意义重大。
5 结论
本研究表明,菌根真菌侵染对于植物个体生长速率以及群落水平的生物量累积具有一定的促进作用。同一树种的菌根侵染率随着胸径增大有增高的趋势,菌根侵染对植物生长的促进作用也表现在群落之间的共有优势树种侵染率和生物量的联系上,侵染率越高的共有优势树种对群落生物量的贡献率往往越大,在群落竞争中占优势地位。从群落水平看,根系碳储量高的森林群落中,群落优势树种平均侵染率相对较高。然而,真菌与植物相互调节和适应的具体机制还有待进一步探索。在真菌-植物的调节与适应机制的研究中,分子生物学原理与方法有必要作为群落生态学研究的辅助手段,如利用稳定同位素标记研究菌根与植物营养元素的转运,运用质谱成像技术研究菌根真菌的活动及其产物,以及从基因层面探索调控菌根真菌和植物发育的基因和信号物质等在未来群落生态学研究中至关重要。
致谢:感谢莫定升、向传银、邓民秀在野外采样和分析测试工作中给予的帮助;感谢李坤和徐伟强博士在论文修改方面的宝贵建议。
AROCENA J M, GLOWA K R. 2000. Mineral weathering in ectomycorrhizosphere of subalpine fir (Abies lasiocarpa (Hook.) Nutt.) as revealed by soil solution composition[J]. Forest Ecology and Management, 133(1/2): 61-70.
BRUNDRETT M C. 2009. Mycorrhizal associations and other means of nutrition of vascular plants: understanding the global diversity of host plants by resolving conflicting information and developing reliable means of diagnosis[J]. Plant Soil, 320(1/2): 37-77.
CURTIS J T, MCINTOSH R P. 1951. An upland forest continuum in the prairie-forest border region of Wisconsin[J]. Ecology, 32(3): 476-496.
FITTER A H. 2006. What is the link between carbon and phosphorus fluxes in arbuscular mycorrhizas? A null hypothesis for symbiotic function[J]. New Phytologist, 172(1): 3-6.
HE X H, DUAN Y H, CHEN Y L, et al. 2012. A 60-year journey of mycorrhizal research in China: Past, present and future directions[J]. Science China Ser. C Life Sciences, 53(12): 1374-1398.
HELGASON T, FITTER A H. 2009. Natural selection and the evolutionary ecology of the arbuscular mycorrhizal fungi (Phylum Glomeromycota) [J]. Experimental Botany, 60(9): 2465-2480.
HODGE A. 2001. Arbuscular mycorrhizal fungi infuence decomposition of, but not plant nutrient capture from, glycine patches in soil[J]. New Phytologist, 151(3): 725-734.
HODGE A. 2003. Plant nitrogen capture from organic matter as affected by spatial dispersion, interspecific competition and mycorrhizal colonization[J]. New Phytologist, 157(2): 303-314.
JAKOBSEN I, ROSENDAHL L. 1990. Carbon flow into soil and external hyphae from roots of mycorrhizal cucumber plants[J]. New Phytologist, 115(1): 77-83.
JENTSCHKE G, BANDES B, KUHN A J, et al. 2000. The mycorrhizal fungus Paxillus involutus transports magnesium to Norway spruce seedlings[J]. Evidence from stable isotope labeling. Plant and Soil, 220(1/2): 243-246.
MARTIN C A, STUTZ J C. 2004. Interactive effects of temperature and arbuscular mycorrhizal fungi on growth, P uptake and root respiration of Capsicum annuum L[J]. Mycorrhiza, 14(4): 241-244.
NEMEC S, VU J C V. 1990. Effects of soil phosphorus and Glomus intraradices on growth, nonstructural carbohydrates, and photosynthetic activity of Citrus aurantium[J]. Plant Soil, 128(2): 257-263.
PAUL E A, KUCEY RMN. 1981. Carbon flow in plant microbial associations[J]. Science, 213(4506): 473-474.
PHILLIPS J M, HAYMAN D S. 1970. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection[J]. Transactions of the British Mycological Society, 55(1): 157-160.
RILLIG M C. 2004. Arbuscular mycorrhizae and terrestrial ecosystem processes[J]. Ecology letters, 7(8): 740-754.
SHACHAR-HILL Y, PFEFFER PE, DOUDS D, et al., 1995. Partitioning of intermediary carbon metabolism in vesicular-arbuscular mycorrhizal leek[J]. Plant Physiology, 108(1): 7-15.
SMITH S E, READ D J. 2008. Mycorrhizal symbiosis[M]. 3rd edn. Academic Press, London.
SMITH S E, SMITH F A. 2012. Fresh perspectives on the roles of arbuscular mycorrhizal fungi in plant nutrition and growth[J]. Mycologia, 104(1): 1-13.
ZHANG Y, GUO L D. 2005. Two new records of arbuscular mycorrhizal fungi in China[J]. Mycosystema, 24(3): 465-467.
蔡晓布, 钱成, 彭岳林, 等, 2005. 环境因子对西藏高原草地植物丛枝菌根真菌的影响[J]. 应用生态学报, 16(5): 859-864.
丁贵杰. 1998. 贵州马尾松人工建筑材林合理采伐年龄研究[J]. 林业科学, 34(3): 40-46.
房辉, Damodaran PN, 曹敏. 2006. 西双版纳热带次生林中的从枝菌根调查[J]. 生态学报, 26(12): 4179-4185.
贺学礼, 刘雪伟, 李英鹏. 2010. 沙坡头地区沙冬青AM 真菌的时空分布[J]. 生态学报, 30(2): 370-376.
李贤伟, 胡庭兴, 杨祯禄. 1996. 马尾松天然林采伐年龄的研究[J]. 四川农业大学学报, 14(13): 437-439.
刘永俊, 石国玺, 毛琳, 等, 2011. 施肥对垂穗披碱草根系中丛枝菌根真菌的影响[J]. 应用生态学报, 22(12): 3131-3137.
刘永俊, 郑红, 何雷, 等, 2009. 柠条根系中丛枝菌根真菌的季节性变化及影响因素[J]. 应用生态学报, 20(5): 1085-1091.
卢翠香, 徐峰, 覃引鸾, 等, 2012. 人工林马尾松晚材率、年轮宽度和组织比量变异研究[J]. 广西林业科学, 41(2): 81-85.
石兆勇, 陈应龙, 刘润进. 2003. 西双版纳地区龙脑香科植物根围的AM真菌. 菌物学报, 22(3): 402-409.
孙玥, 全先奎, 贾淑霞, 等, 2007. 施用氮肥对落叶松人工林一级根外生菌根侵染及形态的影响[J]. 应用生态学报, 18(8): 1727-1732.
仝瑞建, 刘雪琴, 王发园, 等, 2011. 沙田柚根围AM真菌的生境适宜性和季节变化性[J]. 应用与环境生物学报, 17(5): 684-687.
韦新良, 郭仁鉴, 赵斌. 2001. 浙江省马尾松天然林生长模型及采伐年龄的确定[J]. 浙江林学院学报, 18(4): 333-336.
阎秀峰, 王琴. 2004. 两种外生菌根真菌在辽东栎幼苗上的混合接种效应[J]. 植物生态学报, 28(1): 17-23.
于永光, 赵斌. 2008. 不同pH水平下两种菌根真菌对紫云英生长的影响及其相互作用[J]. 菌物学报, 27(2): 209-216.
张茹琴, 唐明, 张海涵. 2011. 四种外生菌根真菌对油松幼苗的抗猝倒病和促生作用[J]. 菌物学报, 30(5): 812-816.
周国逸, 周存宇, LIU Shuguang, 等, 2005. 季风常绿阔叶林恢复演替系列地下部分碳平衡及累积速率[J]. 中国科学D: 地球科学, 35(6): 502-510.
Influence of mycorrhizal colonization on plant biomass accumulation.
TONG Lin1,2,3, TANG Xuli1,3*, ZHANG Jing1,2,3, ZHANG Qianmei1
1. South China Botanical Garden, Chinese Academy of Sciences, Guangzhou 510650, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Key Laboratory of Vegetation Restoration and Management of Degraded Ecosystem, Chinese Academy of Sciences, Guangzhou 510650, China
To reveal the relations between mycorrhizal resources and biomass accumulation at system scale, we analysed possible impact of mycorrhizal colonization on growth rate and biomass accumulation of dominant tree species in three forests at Dinghushan Nature Reserve. Mycorrhizal infection rate, quantity percentages and biomass of doiminant tree species in a given ecosystem were investigated in this study. Our research shows that: 1) Infection rate changed accordingly with growth rate. Trees that grow more rapidly might have higher infection rate. 2) Plant with higher infection rate turned to have lager biomass ratio in its community. e.g., infection rate of Pinus massoniana were (77.30±18.02)% and (40.50±14.42)% in PF and MF, respectively, its biomass ratio was 87.43% in PF, which was five times of that (17.51%) in MF. This tendency was the same for Castanopsis chinensis, a codominant species in MF and BF. 3) Infection rate and root carbon content were relatively higher in PF (pine forest, early successional stage) than that in MF (mixed coniferous and broadleaved forest, middle successional stage) and BF (monsoon evergreen broadleaved forest, late successional stage). In PF, MF and BF, root carbon storage ratio was 55%, 54% and 42%, mycorrhizal infection rate was (66.73±10.55)%, (46.97±27.28)% and (54.22±25.45)%, respectively. This study thus suggests that mycorrhizal colonization may promote plant growth and biomass accumulation of forest community.
mycorrhiza; community; infection rate; biomass; diameter at breast height; root carbon storage ratio
Q948
A
1674-5906(2014)09-1520-06
童琳,唐旭利,张静,张倩媚. 菌根真菌侵染对植物生物量累积的影响[J]. 生态环境学报, 2014, 23(9): 1520-1525.
TONG Lin, TANG Xuli, ZHANG Jing, ZHANG Qianmei. Influence of Mycorrhizal Colonization on Plant Biomass Accumulation [J]. Ecology and Environmental Sciences, 2014, 23(9): 1520-1525.
国家自然科学基金项目(31270499);中国科学院青年创新促进会资助
童琳(1990年生),女,硕士研究生,主要从事生态系统生态学和菌根共生学研究。E-mail: tonglin@scbg.ac.cn通信作者:E-mail: xltang@scib.ac.cn
2014-07-22
