模拟氮沉降对温带森林凋落物分解的影响
2014-02-09王春梅蔺照兰
韩 雪,王春梅,蔺照兰
1. 北京林业大学环境科学与工程学院,北京 100083
模拟氮沉降对温带森林凋落物分解的影响
韩 雪,王春梅*,蔺照兰
1. 北京林业大学环境科学与工程学院,北京 100083
森林凋落物的分解是生态系统养分循环的重要过程,以北京西山地带性植被栎树林(辽东栎:Quercus liaotungensis)为对象,主要研究温带森林植物凋落物分解对模拟氮沉降的响应,为更好地了解氮沉降对温带森林地区凋落物的分解过程提供参考。通过模拟氮沉降,研究不同形态氮(硝态氮、铵态氮和混合态氮)和不同水平氮沉降(对照0 kg·hm-2·a-1、低氮处理50 kg·hm-2·a-1和高氮处理150 kg·hm-2·a-1)对凋落物分解的影响,在2年的时间内调查分析了凋落物分解过程中质量损失动态和碳(C)、N含量及w(C)/w(N)比值的变化。研究结果表明,氮沉降均使凋落物分解速率减缓,且随氮沉降剂量增加,凋落物分解速率相比对照分别减慢了9.88%(硝态氮低氮)、15.02%(硝态氮高氮)、11.46%(铵态氮低氮)、14.62%(铵态氮高氮)、13.04%(混合态氮低氮)和16.20%(混合态氮高氮)。且不同氮沉降类型、不同氮沉降水平间差异显著。不同形态、不同水平的氮沉降显著地增加了凋落物N含量(P=0.061,P=0.087),其中混合态氮沉降对凋落物中N素含量增加最显著(P=0.044)。但在分解过程中,各处理均未对凋落物C含量产生显著影响。不同水平的氮沉降显著降低了凋落物的w(C)/w(N)比值,而且不同类型不同水平氮沉降对凋落物w(C)/w(N)比值具有显著的交互作用(P=0.011)。综上所述,通过对模拟氮沉降后凋落物残留率等的变化分析,得出氮沉降对温带森林凋落物的分解产生了抑制作用。
模拟氮沉降;凋落物分解;温带森林
近几十年来,由于矿物燃料燃烧、含氮化肥的生产和使用等原因,造成大气氮沉降量的不断增加(Bai等,2010)。研究表明,目前中欧及北美地区的森林大气氮输入为每年N 25~60 kg·hm-2,大大超过了森林的年需要量(Kazda,2010),造成严重的氮富集(Lovett等,1982;Parker,1983)。氮富集已经造成了加速土壤酸化,减少生物多样性、影响生态系统结构和功能等一系列生态问题。20世纪80年代初,欧洲和北美的生态学家就开展了氮沉降对温带森林系统结构和功能影响的研究(Wright和Rasmussen,1998;Emmett等,1998)。目前,氮沉降相关研究已成为环境学和生态学研究的热点内容之一(Jenkinson等,1999)。
氮沉降可以通过改变森林群落的组成和凋落物的化学成分等,来影响凋落物分解过程。而凋落物的分解对森林土壤转化和林内生物的养分循环起着重要作用(Berg和Matzner,1997)。无论是野外还是室内试验,外加氮源对森林凋落物的分解速率的影响并没有一致的结论,影响主要表现为促进作用(Hobbie和Gough,2004;Vestgarden,2001; Kuperman,1999;Limpens和Berendse,2003;Berg,1998;Anderson和Hetherington,1999)、抑制作用(Prescott,1995;Micks等,2004;Micks等,2004;Prescott和Levins,2004)或无影响(Berg和Ekbohm,1991;廖利平等,2000;Vitousek等,1994)。莫江明、樊后保等在中国南部氮沉降较显著的热点森林做过一些研究(莫江明等,2004;Fan等,2007),而温带森林地区的研究相对较少。
本研究主要是通过模拟氮沉降的方法,旨在研究不同形态、不同含量氮素沉降对温带森林凋落物分解速率和分解过程中养分释放动态的影响,为更好的了解温带森林地区植物叶片凋落物的分解过程及森林生态系统管理和氮沉降的深入研究提供参考依据。
1 研究方法
1.1 研究区概况
实验在北京市海淀区西山试验林场(31°54′N,110°68′E)进行。地属温带半湿润大陆型季风气候区,春季干旱多风,夏季炎热多雨,冬季寒冷干燥。样地海拔133 m,年均温度11.6 ℃,年均降水量638.8 mm,试验样地的主要林分特征和土壤基本理化性质见表1。样地土壤为褐土轻壤土,植被是地带性植被栎树(辽东栎:Quercus liaotungensis)。
1.2 材料与方法
1.2.1 实验设计
在林场植被和地形比较均一的地方建立14个10 m×10 m的样方,每个试验样地均设2个重复,样方间留有足够宽的缓冲带(约1.5 m)以防干扰。为了增加研究结果的可比性,根据北京地区的大气氮沉降量(平均为23.5 kg·hm-2·a-1)和参考国内国际同类的处理方法(Hall和Matson,2003),即选择3种不同形态的氮沉降铵态氮((NH4)2SO4)、硝态氮(NaNO3)和混合态氮(NH4NO3)。除了对照(CK,N 0 kg·hm-2·a-1)每种形态的氮又分2种不同的施氮水平:低氮(LN,N 50 kg·hm-2·a-1),高氮(HN,N 150 kg·hm-2·a-1)。从2011年3月开始,每年的施氮量从3月到10月份分8次平均喷施。为排除水分对试验的影响,对照样地喷洒同等剂量的清水。
1.2.2 凋落物的采集和处理
在开始施氮前,将每一样地的凋落物采集后混合均匀,测定其初始的C、N浓度。选用25 cm×25 cm(底面孔径、上面孔径均为1.0 mm)的尼龙网袋,每袋装入混合均匀的10 g风干叶片,每个试验样方中放入27个凋落物网袋,将这些网袋均匀的安置在阔叶林地的凋落物层下、土层之上。
自凋落物袋放入样地开始算起,每隔3个月分批取出凋落物袋,每次在每个样方中随机取出3个网袋,用手小心的去除上面附着的杂物。立即带回实验室分析。凋落物的残留量通过在105 ℃的烘箱烘至恒重获得。称重后的凋落物经过粉碎、过筛后用来测定全N和有机C等指标。
凋落物全N用凯氏定氮法(鲍士旦,2000),凋落物有机C测定同土壤有机C测定。凋落物质量残留率的计算公式见式(1):
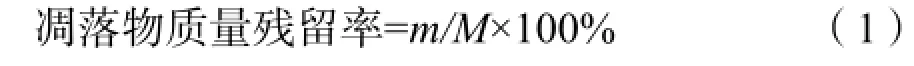
m为初次取回的凋落物质量,单位g;
M为最初装入网袋中凋落物的质量(10 g)。
1.2.3 统计分析
本研究的数据采用Origin 8.0作图分析和SPSS 18.0进行单因素方差分析和重复度量方差分析;多重比较法采用LSD多重检验,显著性水平设为α=0.1(Waldrop等,2004)。

表1 试验样地的主要林分特征和土壤基本理化性质Table 1 Test plot of main forest stand characteristics and basic physical chemical properties of soil
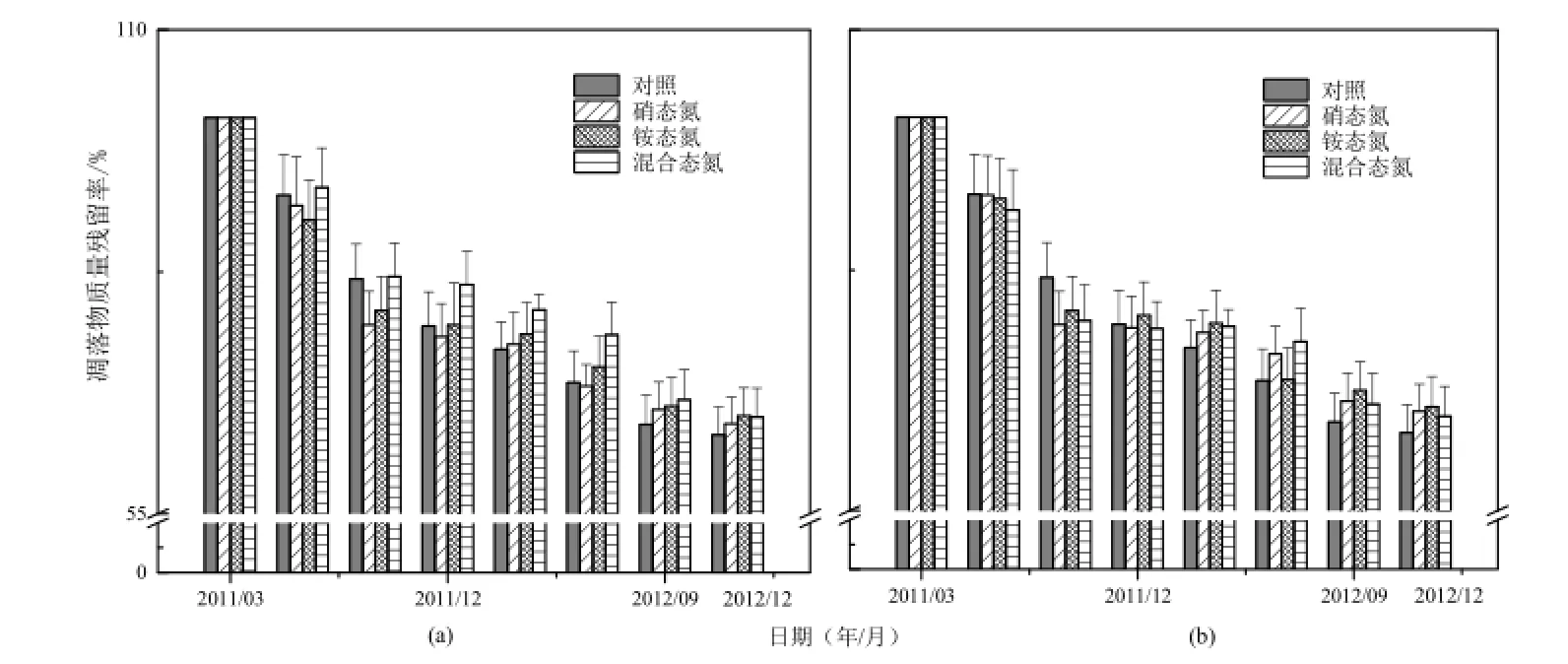
图1 不同氮沉降对凋落物质量残留率的影响(a-低氮添加(N50);b-高氮添加(N150))Fig. 1 Effect of nitrogen deposition on litter decomposition remains (N50, N150)
2 结果与分析
2.1 氮沉降对凋落物质量损失动态的影响
经过2年的凋落物分解实验,凋落物质量残留量逐渐下降,尤其是在分解的前期(前6个月),质量残留率降低较快。早期阶段,可溶性的和非木质化的全纤维素首先被分解,分解较为迅速。后期则进入纤维素木质素控制时期,凋落物质量残留率平稳减少,分解进入迟缓阶段(图1)。
为了说明不同氮沉降与凋落物质量残留率之间的关系,利用Olson指数衰减模型对凋落物失重数据进行拟合(表2),并以分解95%凋落物质量所需时间为凋落物的周转期(Hu等,1986)。结果显示,对照的分解系数是0.253,凋落物分解95%(t0.05)需要11.68年。各处理的分解系数和凋落物的周转期分别是硝酸钠低氮(0.228、12.83年)、硝酸钠高氮(0.215、13.62年)、硫酸铵低氮(0.224、13.11年)、硫酸铵高氮(0.216、13.58年)、硝酸铵低氮(0.22、13.46年)、硝酸铵高氮(0.212、13.8年)。相比对照,不同氮沉降样地凋落物的分解速率分别减慢了9.88%、15.02%、11.46%、14.62%、13.04%、和16.2%。可见,氮沉降对凋落物的分解均产生了一定的抑制作用。
不同氮沉降水平间凋落物的分解速率有显著性差异,随着氮沉降剂量的增加,凋落物的分解速率降低。除了铵态氮高氮处理与低氮处理间差异不显著外,硝态氮高氮和混合态氮高氮的分解速率均显著低于对应的低氮处理(t=-2.636, P=0.034; t=-3.234, P=0.014)。不同氮沉降形态处理间凋落物的分解速率也达到显著性差异(P<0.05),在高氮处理样地中,各处理凋落物分解速率的快慢顺序为混合态氮>铵态氮>硝态氮。
2.2 不同氮沉降对凋落物分解过程中C、N含量的影响
许多研究表明,凋落物的化学组成不同其分解速率不同(马川等,2012)。氮沉降通过改变森林地表氮的含量从而引起凋落物化学组成变化,进而影响了凋落物的分解速率(Makrov和Krasilnikova,1987;Pregitzer和Burton,1992)。
总体来看,凋落物C含量在凋落物分解过程中呈减少趋势(图2)。不同类型和不同水平的氮沉降均对凋落物C含量无显著性影响,重复测量方差显示,不同类型与不同水平交互效应也未对凋落物C含量产生显著性影响。
不同水平和不同形态的氮沉降均显著增加了凋落物N含量(F=2.980, P=0.061; F=2.713, P=0.087)(表3,图3)。相比对照而言,第一年低氮沉降处理中硝态氮、铵态氮、混合态氮的N含量分别增加了70%、155%、103%,对应高氮沉降处理也分别增加了81%、123%、和116%,但高氮和低氮沉降之间无显著性差异。混合态氮沉降处理下的N含量显著高于硝态氮(t=2.447, P=0.044),说明混合态氮沉降在凋落物分解过程中显著抑制了凋落物中N素的释放。
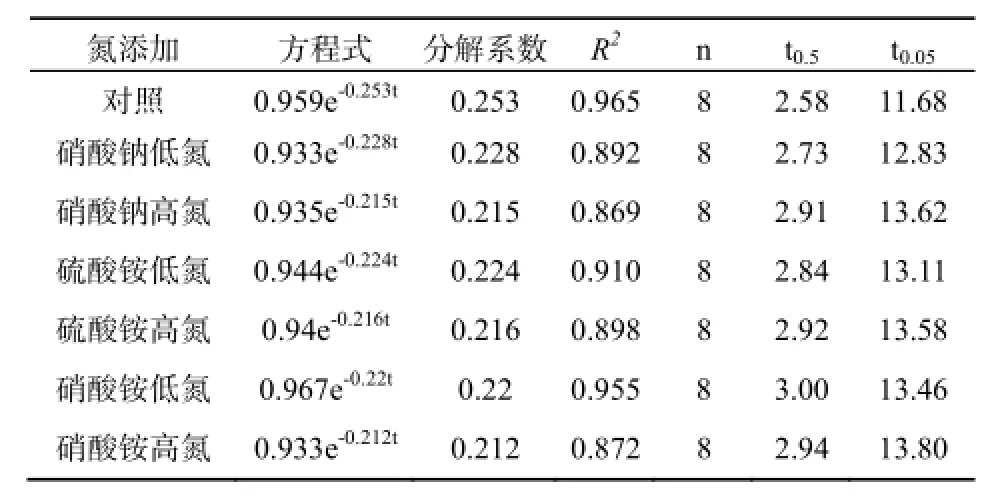
表2 不同氮沉降处理下凋落物残留率Olson模型的拟合Table 2 The Olson models for the litter residual rate in different N treatments
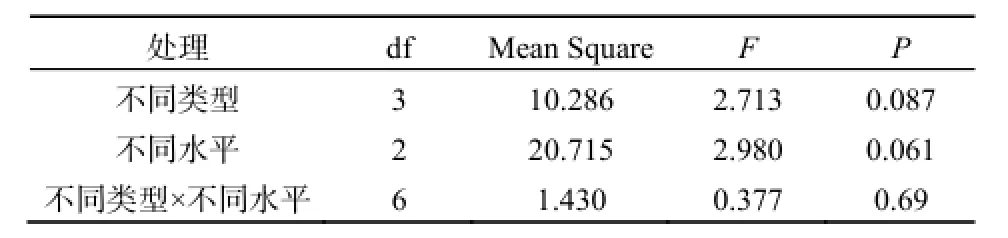
表3 不同氮沉降下凋落物N含量的重复测量方差分析Table 3 Results from a repeated measures analysis of variance of litter N concentration

图2 不同氮沉降对凋落物C含量的影响(a-低氮添加(N50);b-高氮添加(N150))Fig. 2 Effect of nitrogen deposition on litter C concentration(N50, N150)
2.3 不同氮沉降对凋落物分解过程中w(C)/w(N)的影响
凋落物分解过程中C含量变化波动较小,那么N含量的增加直接导致凋落物的w(C)/w(N)比值降低(图4)。经历第一年夏季,凋落物w(C)/w(N)比快速下降,之后下降缓慢。究其原因,氮沉降第一年凋落物N素含量增加明显,从而引起凋落物的w(C)/w(N)快速下降,随后凋落物N含量增加量减少,凋落物w(C)/w(N)也趋于平稳减少。这一点也符合凋落物分解过程中元素富集—释放模式。
重复测量方差显示(表4),不同水平的氮沉降均显著降低了凋落物的w(C)/w(N)比(F=2.906, P=0.065),不同类型氮沉降对其无显著性影响,而不同水平、不同类型氮沉降对其有显著的交互作用(F=5.49, P=0.011)。

图3 不同水平氮沉降对凋落物N含量的影响Fig. 3 Effect of nitrogen deposition level on litter N concentration
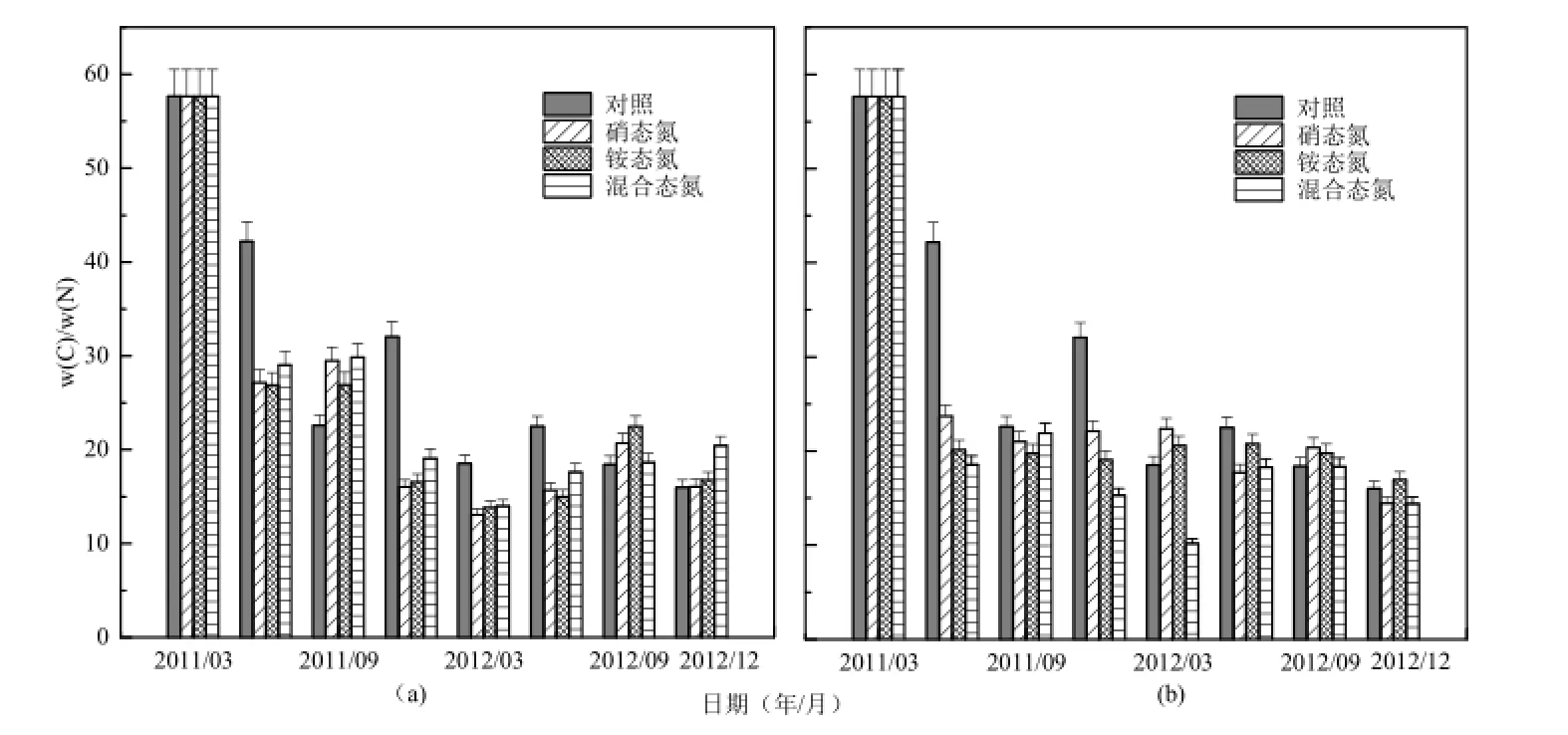
图4 不同氮沉降对凋落物w(C)/w(N)的影响(a-低氮添加(N50);b-高氮添加(N150))Fig. 4 Effect of nitrogen deposition on litter w(C)/w(N)(N50, N150)

表4 不同氮沉降下凋落物w(C)/w(N)的重复测量方差分析Table 4 Results from a repeated measures analysis of variance of litter w(C)/w(N)
3 讨论与结论
3.1 讨论
结果显示,不同类型、不同水平的氮沉降均降低了凋落物的分解速率,这与Micks(2004)和Prescott(2003)的研究结论相似。一般认为,氮沉降抑制凋落物分解速率的原因主要有以下几点:一是外加氮会促进凋落物中纤维素、角质等大量难分解的化合物积累(莫江明等,2004),促进这类物质发生聚合反应,形成难降解物质,从而降低了凋落物的分解速率(Kondo等,1990);二是氮沉降还改变了微生物的群落结构,使微生物多样性减少(Allison等,2007),降低了凋落物的分解速率。Micks(2004)在美国哈佛实验林研究表明,氮沉降延缓凋落物分解的一个可能原因是分解者群落组成向低效率转变。
但并非所有研究均表现一致的结果,也有研究显示,氮沉降促进了凋落物的分解,如Hobbie(2004)在美国进行北美白桦凋落物外加氮分解试验,Kuperman(1999)对长期处于不同氮沉降梯度下的叶片凋落物分解试验等。影响凋落物分解速率的因素有很多,主要为凋落物物种组成、所处环境、氮素可得性及试验进行的时间长度(廖利平等,2000;Hobbie,2000)等。导致这种结果不同是因为有多种因素对凋落物分解过程起作用,而不同的凋落物对其反应存在差异。
3.2 结论
1)不同形态、不同水平的氮沉降均抑制了凋落物的分解,且随氮沉降水平的增加凋落物分解速率降低。
2)氮沉降显著增加了凋落物的N含量,其中混合态氮沉降对凋落物中N素含量增加最显著。
3)在分解过程中,各处理均未对凋落物C含量产生显著影响。
4)不同水平的氮沉降显著降低了凋落物的w(C)/w(N)比值,而且不同类型不同水平氮沉降对凋落物w(C)/w(N)比值具有显著的交互作用。
ALLISON S D, HANSON C A, TRESEDER K K. 2007. Nitrogen fertilization reduces diversity and alters community structure of active fungi in boreal ecosystems[J]. Soil Biology and Biochemistry, 39, 1878-1887.
ANDERSON J M, HETHERINGTON S L. 1999. Temperature nitrogen availability and mixture effects on the decomposition of heather and bracken litters[J]. Functional Ecology, 13: 116-124.
BAI Y F, WU J G, CLARK C M, et al. 2010. Tradeoffs and thresholds in the effects of nitrogen addition on biodiversity and ecosystem functioning:evidence from Inner Mongolia Grasslands[J]. Global Change Biology, 16(1): 358-372.
BERG B, MATZNER E. 1997. Effect of N deposition on decomposition of plant litter and soil organic matter in forest systems[J]. Environmental Reviews, 5: 1-25.
BERG B, EKBOHM G. 1991. Litter massloss rates and decomposition patterns in some needle and leaf litter types Long-term decomposition in a Scots pine forest[J]. Ⅶ. Can J Bot, 69: 1449-1456.
BERG M P, KNIESE J P, ZOOMER R, et al. 1998. Long-term decomposition of successive organic strata in a nitrogen saturated Scots pine forest soil[J]. Forest Ecology and Management, 107: 159-172.
EMMETT B A, BOXMAN D, BREDEMEIER M, et al. 1998. Predicting the effect of atmospheric nitrogen deposition in conifer stands: evidence from the NITREX ecosystem scale experiments[J]. Ecosystems, 1: 352-360.
FAN H B, YUAN Y H, WANG Q, et al. 2007. Effects of increased nitrogen deposition on soil organic carbon and total nitrogen beneath Chinese fir plantations[J]. Journal of Fujian College of Forestry, 27(1): 1226.
HALL S J, MATSON P A. 2003. Nutrient status of tropical rain forests influences soil N dynamics after N additions[J]. Ecological Monographs, 73(1): 107-129.
HOBBIE S E, GOUGH L. 2004. Litter decomposition in moist acidic and non-acidic tundra with different glacial histories[J]. Oecologia, 140: 113-124.
HOBBIE S E. 2000. Interactions between litter lignin and soil nitrogen availability during leaf litter decomposition in a Hawaiian montane forest[J]. Ecosystems, 3: 484-494.
HU Y H, CHEN L Z, KONG F Z. 1986. Litter decomposition rates of two unique tree species of China[J]. Acta Phytoecological et Geobotanica Sinica, 10(1): 35-43.
JENKINSON D S, GOULDING K, POWLSON D S. 1999. Nitrogen deposition and carbon sequestration[J]. Nature, 400: 629.
KAZDA M. 1990. Indications of unbalanced nitrogen of Norway spruce status[J]. Plant and Soil, 128: 97-101.
KONDO R, IIMORI T, IMAMURA H, et al. 1990. Polymerization of DHP and depolymerization of DHP-glucoside by lignin oxidizing enzymes[J]. Biotechnology. 13: 181-188.
KUPERMAN R G. 1999. Litter decomposition and nutrient dynamics in oak-hickory forests along a historic gradient of nitrogen and sulfur deposition[J]. Soil Biology& Biochemistry, 31: 237-244.
LIMPENS J , BERENDSE F. 2003. How litter quality affects mass loss and N loss from decomposing Sphagnum[J]. Oikos, 103: 537-547.
LOVETT G, REINERS W A, OLSEN R K. 1982. Cloud droplet deposition in subalpine balsam fir forests: Hydrological and chemical inputs[J]. Science, 218: 1303-1304.
MAKROV M T, KRASILNIKOVA T L. 1987. Nitrogen and phosphorus contents in plants under conditions of industrial pollution of the atmosphere and the soil[J]. Moscow University Soil Science Bulletin, 42: 2-11.
MICKS P, ABER J D, BOONE R D, et al. 2004. Short-term soil respiration and nitrogen immobilization response to nitrogen applications in control and nitrogen-enriched temperate forests[J]. Forest Ecology and Management, 196(1): 57-70.
MICKS P, DOWNS M R, MAGILL A H. 2004. Decomposition litter as a sink for15N-enriched additions to an oak forest and a red pine plantation[J]. Forest Ecosystem and Management, 196: 71-87.
PARKER G G. 1983. Throughfall and stemflow in the forest nutrient cycle[J]. Advances in Ecological Research, 13: 57-133.
Pregitzer K S, Burton A. 1992. Foliar sulfur and nitrogen along an 800 km pollution gradient[J]. Canadian Journal of Forest Research, 22: 1761-1769.
PRESCOTT C E, BLEVINS L L. 2004. Litter decomposition in British Columbia forests influences of forestry activities[J]. Journal of Ecosystems and Management, 5(2): 30-43.
PRESCOTT C E. 1995. Dose nitrogen availability control rates of litter decomposition in forest[J]. Plant and Soil, 168: 83-88.
VESTGARDEN L S. 2001. Carbon and nitrogen turnover in the early stage of Scots pine (Pinus sylvestris L.) needle litter decomposition: effects of internal and external nitrogen[J]. Soil Biology &Biochemistry, 33: 465-474.
VITOUSEK P M, TURNER D R, PARTON W J, et al. 1994. Litter decomposition on the Mauna Loa environment matrix, Hawaii I: patterns, mechanisms, and models[J]. Ecology, 75(2): 418-429.
WALDROP, M P, ZAK D R, SINSABAUGH R L, et al. 2004. Nitrogen deposition modifies soil carbon storage through changes in microbial enzymatic activity[J]. Ecological Applications, 14: 1172-1177.
WRIGHT R F , RASMUSSEN L. 1998. Introduction to the NITREX and EXMAN Projects[J]. Forest Ecology and Management, 101: 1-7.
廖利平, 马越强, 汪思龙, 等. 2000. 杉木与主要阔叶造林树种凋落物的混合分解[J]. 植物生态学报, 24(1): 27-33.
莫江明, 薛璟花, 方运霆. 2004. 鼎湖山主要森林植物凋落物分解及其对N沉降的响应[J]. 生态学报, 24(7): 1413-1420.
马川, 董少锋, 莫江明. 2012. 鼎湖山马尾松林凋落物分解对凋落物输入变化的响应[J]. 生态环境学报, 21(4): 647-653.
Effects of Simulated Nitrogen Deposition on Temperate Forest Litter decomposition
HAN Xue, WANG Chunmei*, LIN Zhaolan
College of Environmental Science & Engineering, Beijing Forestry University, Beijing 100083, China
In the recent decades, human activities have more influence on the global ecological cycle, leading to the atmospheric change and the increases in N deposition. Litter decomposition is a crucial process in the cycling of ecosystem elements. Taking the Quercus liaotungensis in Beijing west-mountain area as the research object, a field experiment was conducted to investigate the responses of litter decomposition to simulated N deposition. This provides reference to get a better understanding of nitrogen deposition on litter decomposition process of temperate forest. This paper indicated how three different N forms (NO3--N, NH4+-N and mixed N) and three N input levels (Control N 0 kg·hm-2·a-1、low N 50 kg·hm-2·a-1and high N 150 kg·hm-2·a-1) effect on litter disposition. Within 2 years, we have investigated and analyzed the dynamic changes of mass loss, C&N content and w(C)/w(N) value during the litter decomposition process. The data suggested that, three different levels of N input all slowed the litter decomposition rate inordinately. With the increase of N addition, the litter decomposition rate, compared with the contrast, has slowed 9.88% (low nitrate N), 15.02% (high nitrate N), 11.46% (low ammonium N), 14.62% (high ammonium N), 13.04% (low mixed N) and 16.20% (high mixed N) respectively. There is significant difference among different forms or different levels of N addition. They all play a significant role in promoting the N content in litter (P=0.061, P=0.087), in which mixed N addition has the most significant effect on the N content in the litter (P=0.044). But in the process of decomposition, the treatments had no significant effect on the C content in litter. Different levels of N addition significantly reduced the w(C)/w(N)ratio in litter. The different levels and types of N addition have significant interaction effect on the litter w(C)/w(N) values (P=0.011). After simulated nitrogen deposition, the analysis of the litter residual rate and property lead to the conclusion that nitrogen deposition inhibits temperate forest litter decomposition.
simulated nitrogen deposition; litter decomposition; temperate forest
Q948.1
A
1674-5906(2014)09-1503-06
韩雪,王春梅,蔺照兰. 模拟氮沉降对温带森林凋落物分解的影响[J]. 生态环境学报, 2014, 23(9): 1503-1508.
HAN Xue, WANG Chunmei, LIN Zhaolan. Effects of Simulated Nitrogen Deposition on Temperate Forest Litter Decomposition [J]. Ecology and Environmental Sciences, 2014, 23(9): 1503-1508.
中央高校基本科研业务费专项资金资助(200-1243511);国家自然科学基金项目(41373069)
韩雪(1989年生),女(满族),硕士研究生。主要研究方向为全球气候变化及生物地球化学循环。E-mail: hanxue891205@126.com
2014-08-20
