镁离子在高磷诱导慢性肾衰竭大鼠胸主动脉血管钙化中的作用及机制研究
2014-02-09张俊霞徐金升王双宇白亚玲张胜雷崔立文张慧然
张俊霞,徐金升,王双宇,白亚玲,张胜雷,崔立文,张慧然
心血管疾病(cardiovascular disease,CVD)是慢性肾脏病(chronic kidney disease,CKD)患者的主要并发症之一[1-2],血管、心脏瓣膜和心肌钙化是导致CKD患者发生CVD的重要原因。流行病学调查显示,40%的CKD患者发生血管钙化[3-4]。血管钙化是由多种细胞、分子参与的类似于骨形成和骨质疏松发生的主动调节过程,是预测CVD病死率的一个独立危险因素[5],但其发生机制迄今尚未完全阐明。血管平滑肌细胞是血管中膜最主要的细胞成分,其发生类成骨/成软骨样的表型转化是血管钙化的关键环节,其特点是出现骨源性基因的表达上调,尤其是核心结合因子α1(core binding factor α1,Cbfα1)被视为表型转化的标志物。随着对血管钙化研究的逐渐深入,发现镁离子对血管钙化有保护性作用[6-8],但目前尚不清楚镁离子对CKD患者的血管钙化是否有保护作用。为此,本研究建立了慢性肾衰竭大鼠血管钙化模型,通过外源性补充镁离子,观察其对血管钙化及弹性功能的影响,并对其机制进行探讨。
1 材料与方法
1.1 实验动物 SD大鼠,32只,雄性,5周龄,购自河北医科大学实验动物中心,合格证号:1210076。
1.2 主要仪器和试剂 甲基纤维素、硫酸腺嘌呤(美国sigma公司);动物饲料(北京华阜康生物有限公司);RNA提取试剂盒、RNA反转录试剂盒(美国thermo公司);钙水平测定试剂盒(中生北控生物科技股份有限公司);Unicel Dxc800全自动生化分析仪(Beckman公司);所用引物由生工生物工程(上海)股份有限公司根据设计合成(见表1)。

表1 引物序列
注:Cbfα1=核心结合因子α1;GADPH为内参基因
1.3 实验方法
1.3.1 分组及造模方法 将大鼠采用随机数字表法均分为4组,即对照组(A组)、慢性肾衰竭血管钙化组(B1组)、低镁组(B2组)、高镁组(B3组)。参照文献[9]制备大鼠血管钙化模型,将32只健康雄性SD大鼠适应性喂养高磷饲料2周后进入实验。A组给予1.5%甲基纤维素6 ml/kg在1~3周时每天灌胃,4~15周时给予高磷饮食(P:1.2%、Ca:1%、 Mg:0.05%)。B1组1~3周时给予硫酸腺嘌呤悬浊液(硫酸腺嘌呤溶于1.5%甲基纤维素中制成100 mg/ml的悬浊液)6 ml·kg-1·d-1灌胃,4~15周时给予高磷饮食(P:1.2% 、Ca:1%、 Mg:0.05%)。B2组1~3周时给予硫酸腺嘌呤悬浊液6 ml·kg-1·d-1灌胃,4~15周时给予高磷低镁饮食(P:1.2%、Ca:1%、Mg:0.02%)。B3组1~3周时给予硫酸腺嘌呤悬浊液6 ml·kg-1·d-1灌胃,4~15周时给予高磷高镁饮食(P:1.2%、Ca:1%、Mg:0.15%)。
1.3.2 主动脉脉搏波速率(PWV)的测定及动脉血管标本的采集 实验15周末,用2%戊巴比妥钠45 mg/kg麻醉所有大鼠,暴露颈动脉及股动脉,全身肝素化后插入腰椎麻醉导管,用多导电生理仪测量波形,解剖大鼠后测定两导管尖端距离,计算PWV值。快速取大鼠胸主动脉置于冻存管中,放于液氮罐中保存,留取做反转录聚合酶链反应(RT-PCR);取部分腹主动脉进行von Kossa染色法[10]测定主动脉钙化情况。剩余腹主动脉烤干至质量不再改变,留取测量钙水平。慢性肾衰竭血管钙化造模成功的标准:肾脏HE染色肾小管内可见棕黑色结晶,异物巨细胞肉芽肿形成,灶状肾小管扩张,间质灶片状淋巴单核细胞浸润伴纤维化;主动脉von Kossa染色后,主动脉血管中膜可见棕黑色颗粒沉积;血肌酐、尿素氮、血磷均高于A组。
1.3.3 RT-PCR法检测血管组织中Cbfα1 mRNA的表达 采用RNA分离试剂盒Trizol提取并纯化组织总RNA。分光光度法测定提取的总RNA水平。PCR反应在ABI5700型PCR仪上进行,反应条件为:95 ℃预变性5 min,95 ℃变性30 s、55 ℃退火30 s、72 ℃延伸45 s(共35个循环),最后于72 ℃延伸10 min。取PCR产物,在1.5%琼脂糖凝胶上电泳(120 V 30 min),凝胶图像成像系统拍摄保存实验结果,凝胶图像分析系统(GelPro Analyzer 3.0)分析Cbfα1与GADPH基因条带吸光度值。Cbfα1 mRNA的表达量采用gel-Image J软件计算灰度值。
1.3.4 血管壁钙水平的测定 取腹主动脉烤干至质量不再改变后称重,置于1 mmol/L的盐酸中37 ℃消化过夜,用钙水平测定试剂盒(邻甲酚酞络合酮比色法),酶标仪测定。血肌酐、尿素氮、血钙、血磷、血镁水平的测定由Unicel Dxc800全自动生化分析仪检测。
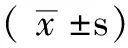
2 结果
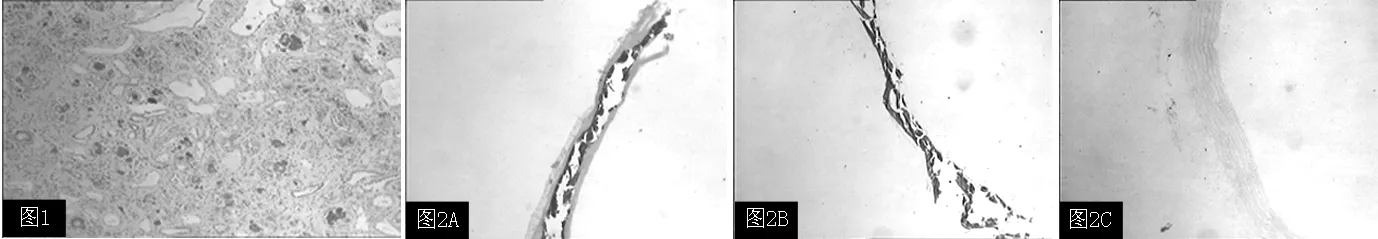
2.1 慢性肾衰竭大鼠血管钙化模型的构建 B1组血肌酐、尿素氮、血磷水平分别为(172.6±10.8) μmol/L、(23.9±2.2) mmol/L 、(3.8±0.1) mmol/L,高于A组的(37.7±4.8) μmol/L、(6.5±0.4) mmol/L 、(2.5±0.1) mmol/L,差异均有统计学意义(t=32.284、22.010、26.000,P<0.05);肾脏病理改变:肾小管内可见大量棕黑色结晶,异物巨细胞肉芽肿形成,灶状肾小管扩张,部分可见少量蛋白管型,间质灶片状淋巴单核细胞浸润伴纤维化(见图1);B1组主动脉von Kossa染色后,主动脉血管中膜可见大量棕黑色颗粒沉积(见图2A)。
2.2 4组血镁水平比较 A组血镁水平为(0.9±0.1)mmol/L、B1组为(0.9±0.5) mmol/L、B2组为(0.6±0.5) mmol/L、B3组为(1.4±0.6) mmol/L,4组间差异有统计学意义(F=7.745,P<0.05)。B3组血镁水平高于B2组,差异有统计学意义(q=2.897,P<0.05)。
2.3 4组胸主动脉钙化及钙水平比较 A组主动脉钙水平为(2.9±0.3) μg/mg、B1组为(8.1±0.6) μg/mg、B2组为(12.4±0.7) μg/mg、B3组为(5.3±0.6) μg/mg,4组间差异有统计学意义(F=6.824,P<0.05)。B2组主动脉钙水平高于B1组,差异有统计学意义(q=13.192,P<0.05);B1组主动脉钙水平高于A组,差异有统计学意义(q=21.925,P<0.05);B3组主动脉钙水平低于B1组和B2组,差异有统计学意义(q=9.333、21.782,P<0.05)。von Kossa染色及主动脉钙水平测定发现B1组发生了明显的主动脉钙化(见图2A),B2组主动脉钙化更加严重(见图2B),B3组主动脉钙化明显减轻(见图2C)。
注:大鼠肾脏间质灶片状淋巴单核细胞浸润伴纤维化
图1 慢性肾衰竭血管钙化大鼠肾脏病理结果(HE染色,×200)
Figure1 Pathology results of the chronic renal failure rats with vascular calcification
注:A为B1组主动脉钙化情况,大鼠主动脉血管中膜大量棕黑色颗粒沉积;B为B2组主动脉钙化情况;C为B3组主动脉钙化情况
图2 大鼠胸主动脉钙化情况(von Kossa染色,×100)
Figure2 The rat thoracic aortic calcification
2.4 4组胸主动脉PWV值比较 A组胸主动脉PWV值为(1.3±0.1) m/s、B1组为(2.9±0.3) m/s、B2组为(6.1±0.6) m/s、B3组为(2.1±0.3) m/s,4组间差异有统计学意义(F=6.454,P<0.05)。B2组主动脉PWV值高于B1组,差异有统计学意义(q=13.492,P<0.05);B1组PWV值高于A组,差异有统计学意义(q=14.311,P<0.05);B3组PWV值低于B1组和B2组,差异有统计学意义(q=5.333、16.865,P<0.05)。
2.5 4组胸主动脉血管Cbfα1 mRNA表达情况比较 A组胸主动脉Cbfα1 mRNA表达量为(0.56±0.03)、B1组为(0.67±0.03)、B2组为(1.72±0.24)、B3组为(0.54±0.02),4组间差异有统计学意义(F=3.212,P<0.05)。B1组和B2组Cbfα1 mRNA表达量高于A组,差异有统计学意义(q=7.333、13.565,P<0.05);B3组Cbfα1 mRNA表达量低于B1组和B2组,差异有统计学意义(q=10.198、13.858,P<0.05);B2组Cbfα1 mRNA表达量高于B1组,差异有统计学意义(q=12.279,P<0.05,见图3)。
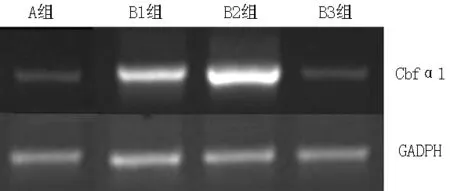
注:Cbfα1 =核心结合因子α1
图3 大鼠胸主动脉Cbfα1 mRNA表达情况
Figure3 The rat thoracic aorta Cbfα1 mRNA expression
3 讨论
近年研究发现,血管钙化是类似骨发育的、主动的、可调控的、多种因素综合作用的生物学过程[11-12]。CKD患者的血管钙化除了受传统危险因素影响外,还与尿毒症相关因素有关,如高磷血症[13-15]。本研究发现,大鼠胸主动脉血管平滑肌细胞在高磷培养基中出现了钙化,该钙化过程可以被镁离子有效抑制,与文献报道一致[16-17]。
镁是体内占第4位的阳离子,其中60%在骨骼中,是骨盐的组成成分[18]。镁具有多种生理功能,包括调节各种离子通道的电子流,催化多种酶活性,调节细胞生长、再生和膜结构,维持心肌、骨骼肌及胃肠道平滑肌兴奋性等[19-20]。本研究在慢性肾衰竭大鼠血管钙化模型上发现,B2组主动脉血管钙化更严重,血管内膜、外膜也发生了钙化,血管组织钙水平也更高;B3组主动脉血管钙化程度则明显减轻,提示镁离子具有抑制血管钙化的作用。
为了探讨镁离子对血管钙化抑制作用的具体机制,本研究进一步检测了胸主动脉Cbfα1 mRNA的表达情况,发现B1组大鼠主动脉Cbfα1 mRNA的表达量较对照组明显增加,与Montezano等[21]报道的结果一致。Cbfα1作为平滑肌细胞发生表型转化的标志物,提示高血磷诱导慢性肾衰竭大鼠胸主动脉平滑肌细胞发生了表型转化,平滑肌细胞表型转化是血管钙化尤其是中膜钙化发生的关键步骤,这从平滑肌细胞表型转化的角度也解释了为什么高磷可以导致血管钙化。本研究结果显示,B3组的胸主动脉Cbfα1 mRNA表达量低于B1组、钙化减轻,提示镁离子有可能是通过抑制平滑肌细胞表型转化来抑制血管钙化的。但其具体作用机制还有待进一步研究。同时本研究还发现,B3组主动脉PWV值明显低于B1组,提示B3组血管弹性功能明显优于B1组,更加印证了镁离子具有抑制血管钙化的作用。
综上所述,镁离子可能是通过抑制高磷诱导血管平滑肌细胞表型转化来抑制血管钙化、改善血管弹性功能的,有望成为防治血管钙化的有效药物之一。但本研究仅在基因水平上进行了验证,且为动物模型,因此将其结果外推到人还需在蛋白水平、血管钙化的分子机制及改变研究对象上进行深入研究。
1 Shan A,Zhou C,He Y,et al.Expression of both matrix metalloproteinase-2 and its tissue inhibitor-2 in tunica media of radial artery in uremic patients [J].Ren Fail,2013,35(1):37-42.
2 Massy ZA,Drüeke TB.Magnesium and outcomes in patients with chronic kidney disease:focus on vascular calcification,atherosclerosis,and survival[J].Clin Kidney,2012,5(Suppl 1):i52-61.
3 Russo D,Palmiero G,De Blasio AP,et al.Coronary artery calcification in patients with CRF not undergoing dialysis [J].Am J Kidney Dis,2004,44(6):1024-1030.
4 Nitta K.Vascular calcification in patients with chronic kidney disease [J].Ther Apher Dial,2011,15(6):513-521.
5 Pun PH,Smarz TR,Honeycutt EF,et al.Chronic kidney disease is associated with increased risk of sudden cardiac death among patients with coronary artery disease[J].Kidney Int,2009,76(6):652-658.
6 Shechter M.Magnesium and cardiovascular system[J].Magnes Res,2010,23(2):60-72.
7 Reffelmann T,Ittermann T,Dörr M,et al.Low serum magnesium concentrations predict cardiovascular and all-cause mortality[J].Atherosclerosis,2011,219(1):280-284.
8 Reffelmann T,Dörr M,Ittermann T,et al.Low serum magnesium concentrations predict increase in left ventricular mass over 5 years independently of common cardiovascular risk factors[J].Atherosclerosis,2010,213(2):563-569.
9 Terai K,Nara H,Takakura K,et al.Vascular calcification and secondary hyperparathyroidism of severe chronic kidney disease and its relation to serum phosphate and calcium levels [J].British Journal of Pharmacology,2009,156(8):1267-1278.
10 Reid JD,Andersen ME.Medial calcification(whitlockite) in the aorta [J].Atherosclerosis,1993,101(2):213-224.
11 Persy V,D′Haese P.Vascular calcification and bone disease:the calcification paradox[J].Trends Mol Med,2009,15(9):405-416.
12 潘宋斌,万琳,邵卫,等.绝经期女性脑梗死患者血清雌二醇及同型半胱氨酸的相关性分析[J]. 神经损伤与功能重建, 2012, 7 (3):193-194.
13 Kendrick J,Chonchol M.The role of phosphorus in the development and progression of vascular calcification [J].Am J Kidney Dis,2011,58(5):826-834.
14 McIntyre CW,Pai P,Warwick G,et al.Iron-magnesium hydroxycarbonate(fermagate):a novel non-calcium-containing phosphate binder for the treatment of hyperphosphatemia in chronic hemodialysis patients[J].Clin J Am Soc Nephrol,2009,4(2):401-409.
15 Giachelli CM.The emerging role of phosphate in vascular calcification [J].Kidney Int,2009,75(9):890-897.
16 Kircelli F,Peter ME,Sevinc Ok E,et al.Magnesium reduces calcification in bovine vascular smooth muscle cells in a dose-dependent manner [J].Nephrol Dial Transplant,2012,27(2):514-521.
17 Spiegel DM,Farmer B.Long-term effects of magnesium carbonate on coronary artery calcification and bone mineral density in hemodialysis patients:a pilot study[J].Hemodial Int,2009,13(4):453-459.
18 Belluci MM,Giro G,del Barrio RA,et al.Effects of magnesium intake deficiency on bone metabolism and bone tissue around osseointegrated implants[J].Clin Oral Implants Res,2011,22(7):716-721.
19 Swaminathan R.Magnesium metabolism and its disorders [J].Clin Biochem Rev,2003,24(2):47-66.
20 Kanbay M,Goldsmith D,Uyar ME,et al.Magnesium in chronic kidney disease:challenges and opportunities [J].Blood Purif,2010,29(3):280-292.
21 Montezano AC,Zimmerman D,Yusuf H,et al.Vascular smooth muscle cell differentiation to an osteogenic phenotype involves TRPM7 modulation by magnesium [J].Hypertension,2010,56(3):453-462.
