Toll样受体4及骨形成蛋白2表达在慢性阻塞性肺疾病患者血管重塑中的作用研究
2014-02-09张馨文丛金鹏于文成
张馨文,丛金鹏,董 蕾,于文成
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种以气流受限不完全可逆、呈进行性发展为特征,可以预防和治疗的疾病[1-2],常表现为气道、肺实质及血管的慢性炎症。其中肺血管的慢性炎症及其所引起的肺血管重塑被认为是COPD的基本病理特征之一,但其机制尚待阐明。近年有关Toll样受体4(TLR-4)及骨形成蛋白2(BMP-2)在肺血管重塑中可能具有重要作用的报道多数来自动物模型[3-5],但二者在COPD患者体内表达情况及其作用的研究尚未见报道。本研究以COPD肺组织标本为材料,对其中TLR-4、BMP-2及平滑肌细胞增殖细胞核抗原(PCNA)的表达进行了检测,并将其表达水平与肺血管重塑进行了相关性分析,为COPD的防治提供参考依据。
1 材料与方法
1.1 标本来源与处理 肺组织标本取自青岛大学医学院附属医院胸外科2012年7月—2013年7月住院需要手术治疗的50例男性高分化肺鳞癌患者。根据是否患有COPD将患者分为COPD组和对照组,各25例。COPD诊断依据慢性阻塞性肺疾病诊治标准[1],且COPD患者均处于稳定期,无其他肺部及其他系统性疾病。两组患者年龄比较,差异无统计学意义(P>0.05);术前肺功能测定,COPD组第1秒用力呼气末容积占预计值百分比(FEV1%)、第1秒用力呼气末容积占用力肺活量百分比(FEV1/FVC)均低于对照组,差异有统计学意义(P<0.05,见表1)。

表1 两组患者年龄和肺功能比较
注:FEV1%=第1秒用力呼气末容积占预计值百分比;FEV1/FVC=第1秒用力呼气末容积占用力肺活量百分比
1.2 标本处理 手术切除患者肺叶后,取远离肿瘤部位5 cm以上未见浸润的正常外周肺组织,石蜡包埋切片。所有标本的使用符合知情同意原则。
1.3 形态学观察 切片经HE染色,光学显微镜下观察肺动脉形态结构变化,选择直径为100~500 μm的动脉,半定量评价动脉壁及周围炎性细胞浸润程度。炎症评分标准:无炎性细胞浸润为0分;少许炎性细胞浸润为1分;浸润的炎性细胞较多但分布不均匀为2分;炎性细胞浸润较多,分布均匀,但不聚集成团为3分;大量炎性细胞浸润并聚集成团为4分。随机选取横断面较圆且结构完整的5条肺小动脉,Dotslide取像并测量肺小动脉管壁内外径及管壁厚度与管壁面积,计算管壁厚度占外径百分比(WT%)和血管壁横断面积占血管总面积百分比(WA%),取其平均值记为各组的血管重塑指标。
1.4 免疫组化染色法检测TLR-4、BMP-2、PCNA 采用PV-6000二步法检测TLR-4、BMP-2、PCNA,严格按照试剂盒(购自美国3M公司)说明书进行操作。每张切片在400倍视野下随机采集5条直径100~500 μm肺小动脉,请两位有经验的病理专业医师观察同一血管壁横断面,计数并取其均值。TLR-4、BMP-2以细胞质呈棕黄色颗粒改变为阳性表达,观察计数肺动脉平滑肌细胞中TLR-4、BMP-2阳性细胞数占总平滑肌细胞数的百分比计为TLR-4、BMP-2表达水平;PCNA阳性反应定位于细胞核,出现棕黄色颗粒则为增殖细胞,观察计数PCNA阳性细胞占总平滑肌细胞数的百分比计为PCNA表达水平。
2 结果
2.1 两组肺血管炎性细胞浸润及重塑程度比较 光学显微镜下COPD组肺血管管壁及周围有大量单核细胞、淋巴细胞、中性粒细胞浸润,肺血管管壁明显增厚,管腔狭窄,细胞间质增多,出现肺血管重塑现象。COPD组患者炎症评分、WT%、WA%均高于对照组,差异有统计学意义(P<0.05,见表2)。

Table2 Comparison of inflammatory infiltration degree and vascular remodeling degree between the two groups

组别例数炎症评分(分)WT%WA%对照组250 4±0 614 2±1 721 6±1 8COPD组251 6±0 827 8±3 435 7±3 0t值-6 278-17 624-19 942P值<0 01<0 01<0 01
注:WT%=管壁厚度占外径百分比,WA%=血管壁横断面积占血管总面积百分比
2.2 两组TLR-4、BMP-2及PCNA阳性表达水平比较 COPD组患者肺动脉血管平滑肌细胞TLR-4、BMP-2、PCNA表达水平均高于对照组,差异有统计学意义(P<0.05,见表3)。
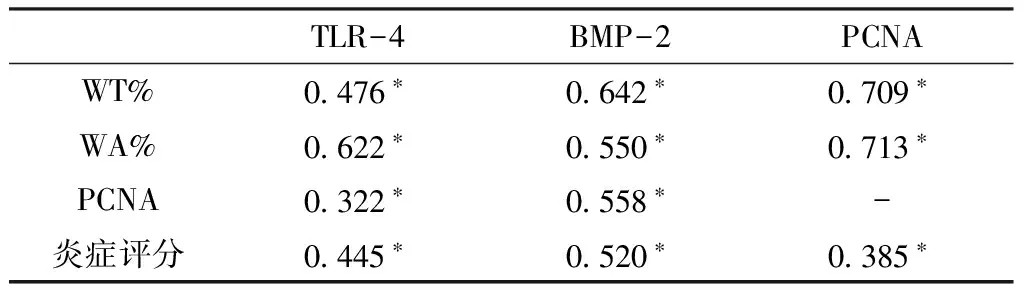
2.3 COPD组TLR-4、BMP-2及PCNA表达水平与血管重塑相关性 COPD组患者肺动脉平滑肌细胞TLR-4、BMP-2水平与炎症评分、WT%、WA%及PCNA水平均呈正相关,PCNA水平与WT%、WA%、炎症评分均呈正相关(P<0.05,见表4)。

Table3 Comparison of the levels of expression of TLR-4,BMP-2 and PCNA between the two groups

组别例数TLR-4BMP-2PCNA对照组25 9 5±9 4 5 0±4 6 7 8±5 0 COPD组2529 3±16 030 9±21 328 3±12 7t值-5 344-6 099-7 522P值<0 01<0 01<0 01
注:TLR-4=Toll样受体4,BMP-2=骨形成蛋白2,PCNA=增殖细胞核抗原
表4 COPD组TLR-4、BMP-2及PCNA表达水平与WT%、WA%、PCNA及炎症评分的相关性(r值)
Table4 Correlation between the expression level of TLR-4,BMP-2,PCNA and WT%,WA%,PCNA,inflammation score in COPD group
TLR-4BMP-2PCNAWT%0 476∗0 642∗0 709∗WA%0 622∗0 550∗0 713∗PCNA0 322∗0 558∗-炎症评分0 445∗0 520∗0 385∗
注:*P<0.05;-为无此项
3 讨论
Toll样受体(Toll-like receptor,TLR)是一类天然免疫受体,可激活天然免疫、诱导获得性免疫,其在COPD发病机制中的作用日益受到关注[6]。TLR-4是人类发现的第一个TLR相关蛋白,其主要识别革兰阴性杆菌的内毒素/脂多糖(lipopolysaccharide,LPS)[7]。LPS进入肺脏后与TLR-4结合,产生多种促炎细胞因子的合成和释放,引起肺部炎性反应[8]。孟莹等[3]通过动物实验发现,在烟熏和脂多糖联合烟熏所致肺部炎症损伤大鼠中TLR-4的表达量较对照组明显增加,指出TLR-4可能参与了大鼠肺部炎性反应及COPD的形成。BMP属于转化生长因子β(TGF-β)超家族的一员[9],参与调节多种细胞增殖、分化、组织修复、炎性反应、血管形成等作用[10]。BMP-2是这一家族的主要成员,其与受体结合后能调节细胞的增殖和凋亡[11]。杨莹等[5]实验表明,慢性低氧可引起大鼠肺小动脉壁BMP-2表达的上调,证实BMP-2可能在低氧性肺血管重塑过程中发挥一定作用。
本研究表明,COPD组血管炎症程度、血管重塑指标(WT%、WA%)明显高于对照组,提示COPD血管存在炎性反应,后者可能直接或间接诱导血管重塑的发生;而肺动脉平滑肌细胞TLR-4的表达与对照组相比明显提高,且其表达水平与血管炎症程度、血管重塑指标呈正相关,表明TLR-4参与了血管炎症的发生,炎症进一步引起了血管重塑,且与PCNA表达呈正相关。这一研究结果提示,TLR-4可能通过诱导肺动脉平滑肌的增殖,平滑肌的增生引起血管壁的增厚,管腔狭窄,引起肺血管重塑,继而导致肺动脉高压的产生。
近年来的研究发现,家族性肺动脉高压及部分特发性肺动脉高压的患者存在BMPR-Ⅱ的基因突变,由于BMP与BMPR-Ⅱ、BMPR-Ⅰ复合物形成缺陷,致使肺动脉平滑肌细胞增殖效应增加,而凋亡作用减弱[12-13]。目前尚未有实验证实BMPR-Ⅱ基因突变与COPD引起的低氧性肺动脉高压有关。本研究结果显示,COPD组肺动脉平滑肌细胞BMP-2表达较对照组明显升高,且与反映肺小动脉平滑肌细胞增殖的PCNA、与反映肺血管重塑程度的指标WT%、WA%及炎症程度呈正相关。其机制可能在于,COPD患者长期的慢性低氧可引起血管BMP-2的上调,致使肺动脉平滑肌细胞增殖,并促进炎性反应的发生,继而造成肺血管重塑的形成,从而引起低氧性肺动脉高压,这与家族性肺动脉高压及部分特发性肺动脉高压产生的机制不同。
总之,COPD患者肺血管平滑肌中TLR-4及BMP-2的表达水平增加,均能够从促进炎性反应及血管平滑肌细胞的增殖两个途径引起COPD患者血管重塑,进而促进肺动脉高压的形成。因此,及时检测TLR-4及BMP-2的表达水平,可能有助于COPD的早期诊断及其病情严重程度的观察,这对防治COPD的进展、改善其预后等具有一定临床意义。但本研究在应用到临床患者的治疗中如发展靶向治疗的方法,具有一定的局限性,故今后还有待进一步研究。
1 中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病(COPD)诊治指南(2013年修订版)[J].中华结核和呼吸杂志,2013,36(4):255-264.
2 张志恒.氧疗持续时间对慢性阻塞性肺疾病患者肺功能及运动耐力改善的临床观察[J].中国临床医生,2013,41(8): 34.
3 孟莹,余常辉,李婷,等.Toll样受体4在单纯烟熏法和脂多糖(LPS)联合烟熏所致肺损伤大鼠中的表达及意义[J].中华医学杂志,2013,93(28):2230-2234.
4 Pace E,Giarratano A,Ferraro M,et al.TLR4 upregulation underpins airway neutrophilia in smokers with chronic obstructive pulmonary disease and acute respiratory failure[J].Human Immunology,2011,72(1):54-62.
5 杨莹,程德云,樊莉莉,等.骨形成蛋白在低氧性肺动脉高压发病中的作用[J].中华结核和呼吸杂志,2007,30(9):662-666.
6 Chaudhuri N,Dower SK,Whyte MK,et al.Toll-like receptors and chronic lung disease [J].Clin Sci(Lund),2005,109(2):125-133.
7 Poltorak A,He X,Smirnova I,et al.Defective LPS signaling in C3H /HeJ and C57BL/10ScCr mice:mutations in Tlr4 gene[J].Science,1998,282(5396):2085-2088.
8 Hritz I,Mandrekar P,Velayudham A,et al.The critical role of toll-like receptor(TLR)4 in alcoholic liver disease is independent of the common TLR adapter MyD88[J].Hepatology,2008,48(4):1224-1231.
9 Miyazono K,Kusanagi K,Inoue H.Divergence and convergence of TGF-beta/BMP signaling[J].J Cell Physiol,2001,187(3):265-276.
10 Morrell NW,Yang X,Upton PD,et al.Altered growth responses of pulmonary hypertension to transforming growth factor-beta(1) and bone morphogenetic proteins[J].Circulation,2001,104(7):790-795.
11 Derynck R,Zhang YE.Smad-dependent and Smad-independent pathways in TGF-beta family signaling[J].Nature,2003,425(6958):577-584.
12 Yang X,Long L,Southwood M,et al.Dysfunctional Smad signaling contributes to abnormal smooth muscle cell proliferation familial pulmonary arterial hypertension[J].Circ Res,2005,96(10):1053-1063.
13 Zhang S,Fantozzi I,Tigno DD,et al.Bone morphogenetic proteins induce apoptosis in human pulmonary vascular smooth muscle cells[J].Am J Physiol Lung Cell Mol Physiol,2003,285(3):L740- 754.
