壳聚糖絮凝法精制合欢皮多糖水提液的工艺
2014-02-08孙晓海
韩 乐,孙晓海,韩 伟
(华东理工大学中药现代化工程中心,上海200237)
壳聚糖絮凝法精制合欢皮多糖水提液的工艺
韩 乐,孙晓海,韩 伟
(华东理工大学中药现代化工程中心,上海200237)
采用壳聚糖对合欢皮总多糖的絮凝纯化工艺进行研究。通过单因素和正交试验,得到优化的工艺条件:壳聚糖用量为生药量0.8 mL/g,絮凝温度35 ℃,絮凝时间4 h,药液浓缩比(质量体积比)为1∶10(g/mL),在此条件下,多糖保留率、脱蛋白率和多糖纯度分别为91.23%、22.26%和47.27%,优于传统的水提醇沉法。
合欢皮;壳聚糖;絮凝;多糖
合欢皮是一味传统中药,具有解郁安神、活血消肿等功效[1],近期研究发现:合欢皮还具有抗炎[2]、抗生育[3]、抗肿瘤[4-5]、抗氧化[6]、镇静催眠[7]、免疫调节[8]等药理活性,其活性成分之一的合欢皮多糖与抗肿瘤和免疫调节活性相关[9-10]。
壳聚糖是一种天然的链状高分子絮凝剂,由葡萄糖胺通过β-1,4-糖苷键连接而成[11]。由于分子中含有氨基,使壳聚糖在酸性条件下带有正电荷,因此具有中和电荷与吸附架桥的双重絮凝作用[12]。壳聚糖作为絮凝剂具有安全、无毒、稳定的优点,被广泛应用于污水处理等工业。近年来,絮凝剂被逐步应用于中药有效成分的分离纯化过程,而中药絮凝纯化技术是利用絮凝剂使药液中的蛋白质、胶体、鞣质等微粒絮凝沉降,再通过过滤实现分离纯化的方法。
笔者以多糖保留率和脱蛋白率为指标,考察壳聚糖对合欢皮总多糖提取液的絮凝纯化工艺,并通过数据分析优化工艺参数,以期获得壳聚糖絮凝纯化合欢皮总多糖的最佳工艺参数。
1 材料与方法
1.1 材料与设备
UV1900PC型紫外分光光度计,上海市亚研电子公司;SHB-Ⅲ型循环水真空泵、DF-101S型集热式恒温加热磁力搅拌器,巩义市英峪予华仪器厂;AL104型电子天平,上海市Mettle Toledo仪器有限公司;RE-52C型旋转蒸发器,上海市予华仪器有限公司;RJ-TGL-16C型台式高速离心机,无锡市瑞江分机仪器有限公司;PHS-3C型酸度计,上海理达仪器厂。
葡萄糖为标准品(质量纯度>95%),上海市天莲精细化工有限公司;牛血清白蛋白和考马斯亮蓝G-250均为分析纯,上海市源聚生物科技有限公司;壳聚糖,上海市伟康生物制品有限公司;合欢皮药材,购自上海市药材公司雷允上药店;无水乙醇、苯酚、H2SO4、HCl、NaOH均为市售分析纯。
1.2 试样及试剂的制备
1.2.1 试样溶液的制备
1)药材的预处理 称取合欢皮药材适量,加入10倍量的95%工业乙醇,回流提取2 h,冷却,上清液回收乙醇,残渣挥干溶剂,干燥至恒质量,用于提取多糖。
2)试样溶液的制备 精确称取预处理后的合欢皮试样50 g,加入适量去离子水,加热回流2 h,冷却至常温,过滤、滤渣再提取一次,合并两次提取液,减压浓缩,定容备用。
1.2.2 试剂的配制
1)考马斯亮蓝试剂的制备 取100 mg考马斯亮蓝G-250,用95%乙醇50 mL溶解,加入85% H3PO4100 mL,然后用去离子水定容至1 000 mL,过滤,备用。
2)壳聚糖溶液的配制 称取1.0 g壳聚糖,加入适量1%醋酸溶液,搅拌溶解,配制成1%的壳聚糖溶液,静置24 h,充分溶胀后备用。
1.3 分析方法的建立及计算
1.3.1 合欢皮总多糖含量的测定
精密称取105 ℃干燥至恒质量的葡萄糖标准品50.0 mg,加去离子水溶解,并定容至500 mL,摇匀,即得0.1 mg/mL葡萄糖溶液。
分别精密量取0、0.2、0.4、0.6、0.8、1.0、1.2和1.4 mL的标准品溶液,采用苯酚-H2SO4法[13],于485 nm处测定吸光度,以质量浓度(ρ)为横坐标,吸光度(A)为纵坐标,绘制标准曲线,得回归方程:A=14.23 80ρ-0.000 86,发现在0.010 5~ 0.073 5 mg/mL范围内R2=0.999 5。
准确移取2 mL试样溶液,按相同的显色操作,测定吸光度,根据回归方程计算试样溶液中总多糖的浓度,通过式(1)计算合欢皮总多糖的含量。
(1)
式中:m1为总多糖的含量,mg;ρ1为试样中总多糖的质量浓度,mg/mL;V1为试样中溶剂体积,mL。
(2)
式中:m1为絮凝前总多糖含量,mg;m2为絮凝后总多糖含量,mg。
1.3.2 蛋白质含量的测定
称取0.02 g结晶牛血清白蛋白,用去离子水溶解稀释,并定容至100 mL,即得0.20 mg/mL蛋白质标准溶液。
分别量取标准蛋白质溶液0、0.1、0.2、0.4、0.6、0.8和1.0 mL,采用考马斯亮蓝G-250染色法[14],于595 nm处测定吸光度,绘制蛋白质标准曲线,得回归方程:A=4.533 7ρ1-0.033 2,R2=0.999 1,且在0.02~0.20 mg/mL范围内线性关系良好。
取试样溶液1.0 mL,按相同的显色操作,测定吸光度,根据回归方程计算试样中的蛋白质浓度,通过式(3)求得蛋白质含量。
(3)
式中:m2为蛋白质质量,mg;ρ2为蛋白质的质量浓度,mg/mL;V2为蛋白质溶液体积,mL。
(4)
式中:m3为絮凝前蛋白质质量,mg;m4为絮凝后蛋白质质量,mg。
1.3.3 合欢皮多糖纯度的计算方法
对合欢皮总多糖提取液进行絮凝纯化,取上清液,减压浓缩至浸膏状,真空干燥,称质量,根据式(5)计算总多糖的纯度:
(5)
式中:ρ总多糖为药液中总多糖的质量浓度,mg/mL;V3为药液体积,mL;m5为药液浓缩后的干膏质量,mg。
1.4 实验方法
1.4.1 壳聚糖絮凝实验
移取一定浓缩比的药液50 mL,在电磁搅拌状态下,缓慢加入1%的壳聚糖醋酸溶液,搅拌5 min,水浴保温一定时间后取出,离心分离,取上清液测定多糖和蛋白质的含量。
1.4.2 水提醇沉实验
向浓缩后的合欢皮总多糖提取液中加入适量无水乙醇,使乙醇体积分数达到80%左右,置于冰箱中醇沉24 h,离心取沉淀,用无水乙醇、丙酮洗涤数次,真空干燥,得粗多糖;称质量后,用去离子水溶解,定容,测定多糖浓度,计算总多糖的纯度。
2 结果与讨论
2.1 壳聚糖加入量的影响
以药液浓缩比1∶10(g/mL)的合欢皮多糖提取液为原料,于50 ℃、不调pH的实验条件下,分别加入不同量的1%(质量分数)壳聚糖醋酸溶液,絮凝保温2 h后,测定药液的多糖和蛋白质含量变化,实验结果见图1。
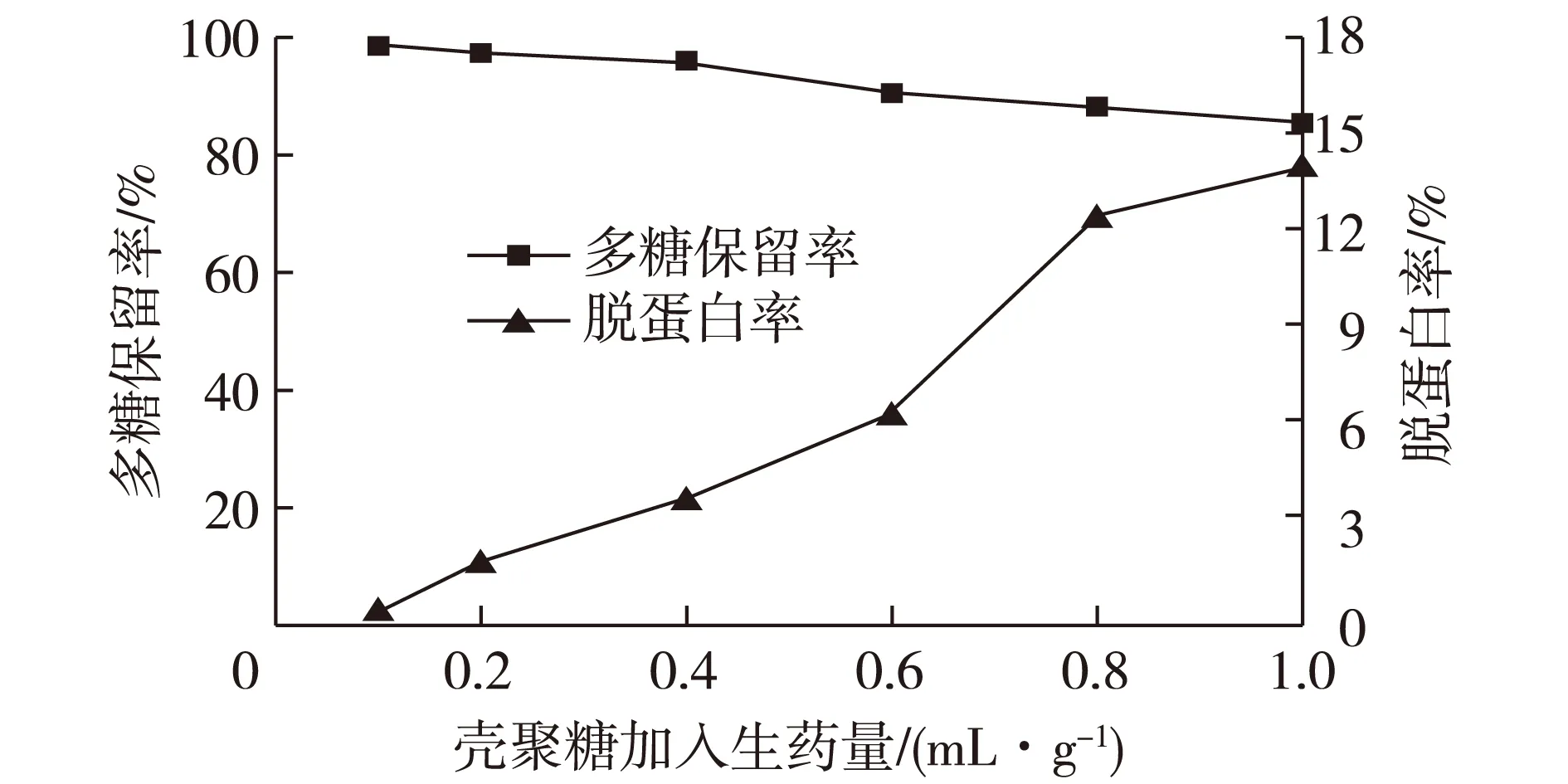
图1 壳聚糖的加入量对絮凝纯化多糖效果的影响Fig.1 Effects of chitosan dosages on flocculating purification of polysaccharides
由图1可知:随着壳聚糖加入量的增多,多糖保留率不断减小,而脱蛋白率先逐渐增加,最后达到稳定状态。这是因为当壳聚糖加入量较少时,壳聚糖分子与胶体颗粒和杂质等的碰撞几率较小,吸附架桥和电中和作用不足,导致絮凝作用不充分;随着壳聚糖加入量的增加,分子间碰撞的几率增大,絮凝作用加强,脱蛋白率增大,多糖保留率降低;当壳聚糖加入量达到一定程度后,壳聚糖对蛋白质等的絮凝作用逐步达到饱和,脱蛋白率变化趋缓。综合考虑,选择壳聚糖加入量以生药量0.8 mL/g为宜。
2.2 絮凝时间的影响
以药液浓缩比为1∶10的合欢皮多糖提取液为原料,壳聚糖加入量为0.8 mL/g生药量,在50 ℃、不调pH的实验条件下,分别絮凝保温1、2、3、4、5和6 h后,测定药液的多糖和蛋白质含量变化,实验结果见图2。
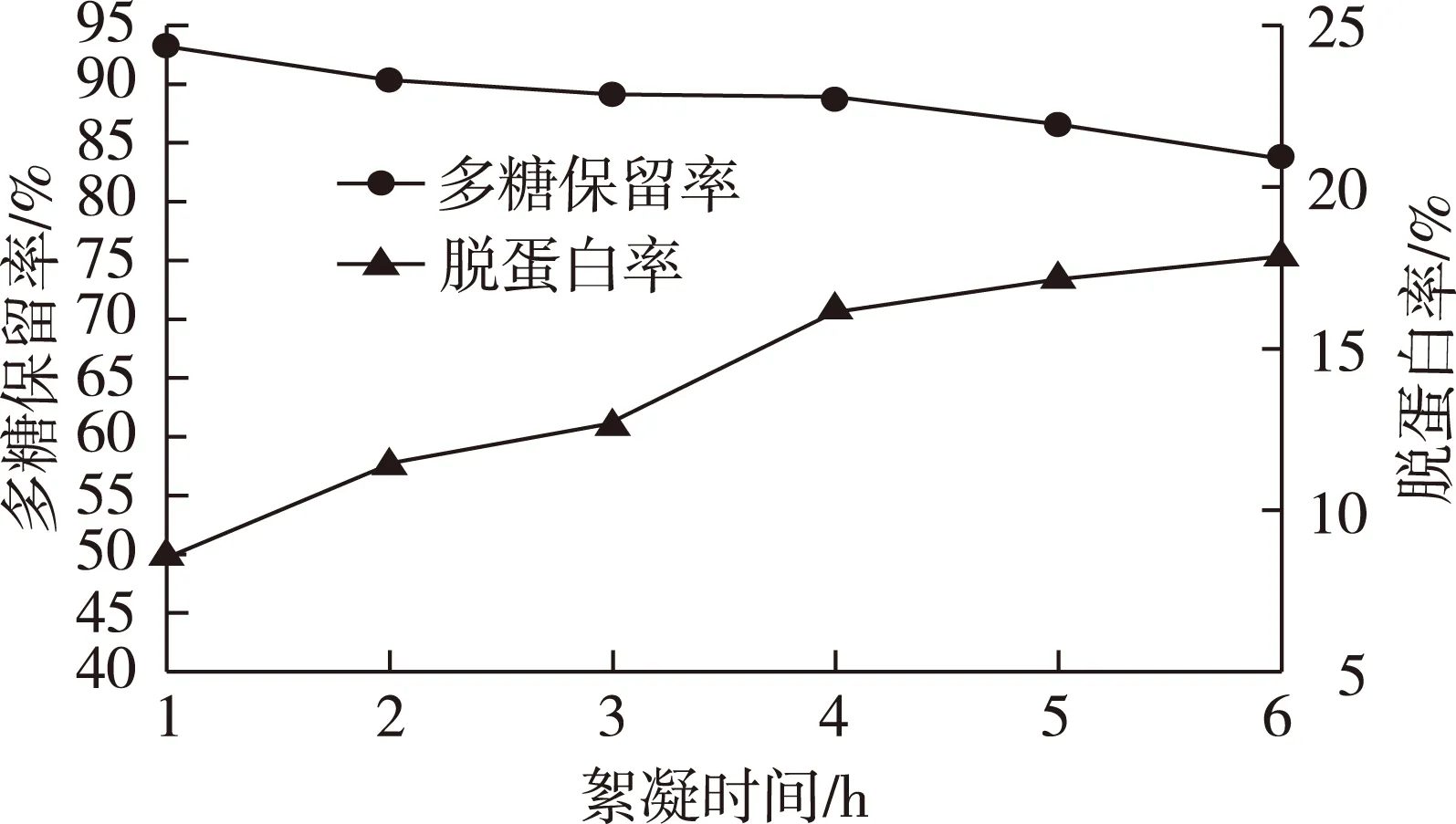
图2 絮凝时间对絮凝纯化多糖效果的影响Fig.2 Effects of time on flocculating purification of polysaccharides
由图2可知:随着絮凝时间的增加,多糖保留率逐渐降低;而脱蛋白率先迅速增大,后缓慢增加。这可能是因为当絮凝时间较短时,壳聚糖高分子链分散不均匀,与悬浮颗粒、蛋白质等杂质不能充分接触,导致絮凝效果较差;随着时间的延长,高分子链均匀分散,絮凝效果增强,脱蛋白率迅速增加,同时多糖也有所损失;当絮凝时间大于4 h后,壳聚糖对蛋白质等的絮凝作用逐渐达到平衡,但多糖易被絮团包裹而使损失增加。综上所述,絮凝时间选择4 h左右。
2.3 絮凝温度的影响
以药液浓缩比为1∶10的合欢皮多糖提取液为原料,壳聚糖加入量为0.8 mL/g生药量,不调pH,分别在不同的絮凝温度下,絮凝保温4 h后,测定药液的多糖和蛋白质含量的变化,实验结果见图3。
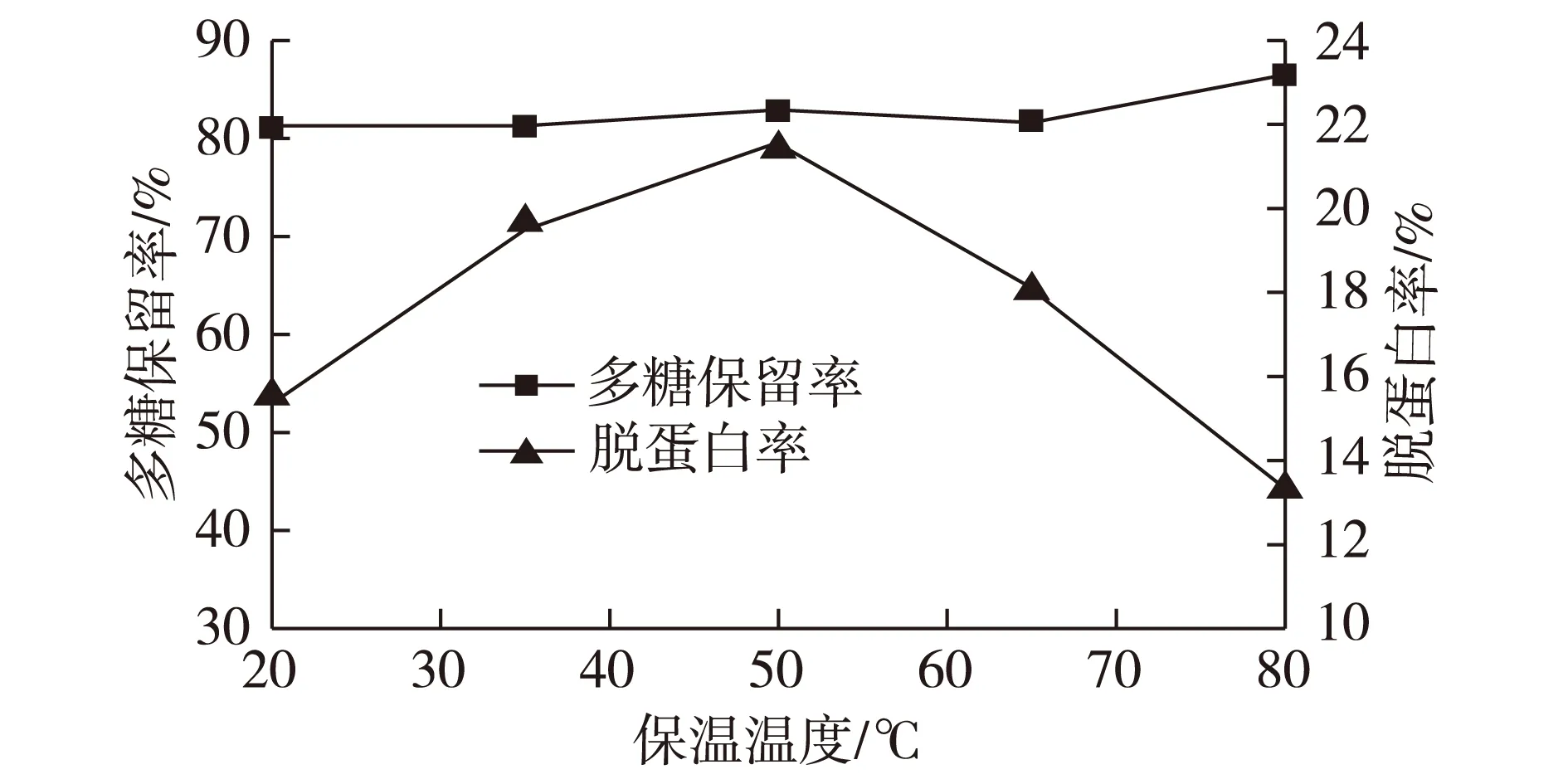
图3 絮凝温度对絮凝纯化多糖效果的影响Fig.3 Effects of temperature on flocculating purification of polysaccharides
由图3可知,该变化趋势与不同温度下分子的热运动有关。当温度过低时,分子热运动较慢,分子间的碰撞几率较小,絮凝作用不充分;随着温度的升高,体系内各分子热运动加剧,絮凝剂分子与溶液中微粒的碰撞几率增加,电中荷、吸附架桥作用较充分,脱蛋白率和多糖保留率逐渐增加;当温度超过50 ℃时,壳聚糖高分子链收缩,缩短了架桥长度,絮凝作用减弱,脱蛋白率降低。综合考虑,选择絮凝温度以50 ℃左右为宜。
2.4 药液浓缩比的影响
分别以不同药液浓缩比的合欢皮多糖提取液为原料,壳聚糖加入量为生药量0.8 mL/g,在50 ℃、不调pH的实验条件下,絮凝保温4 h后,测定药液的多糖和蛋白质含量,实验结果见图4。
由图4可知:多糖保留率和脱蛋白率随药液浓度的变化呈抛物线的变化趋势。因为药液浓度过高时,溶液黏度较大,不利于壳聚糖高分子链的分散,絮凝效果较差,脱蛋白率很低;同时,多糖易被沉淀、絮团等吸附和包裹,损失较大;药液浓度过低时,分子间距大,高分子链间的吸附架桥作用不充分,且吸附选择性较差,脱蛋白率和多糖保留率均降低。因此,选择药液浓缩比以1∶10左右为宜。
2.5 pH的影响
以药液浓缩比为1∶10的合欢皮多糖提取液为原料,壳聚糖加入量为0.8 mL/g生药量,在50 ℃、不同pH的实验条件下,絮凝保温4 h后,测定药液的多糖和蛋白质含量,实验结果见图5。

图5 pH对絮凝纯化多糖效果的影响Fig.5 Effects of pH on flocculating purification of polysaccharides
由图5可知:多糖保留率和脱蛋白率两项指标均随pH的增大呈先增大后减小的趋势,在pH 3~5的范围内,多糖保留率和脱蛋白率较高,这主要是由于氨基的存在,使得壳聚糖在弱酸性条件下带正电荷,可与溶液中带负电荷的胶体颗粒、鞣质、蛋白质等发生电中和作用,因此随着酸性的增强,壳聚糖所带的正电荷增多,絮凝能力增强,即脱蛋白率和多糖保留率随pH的减小而增大;但酸性的增强同时会破坏胶体、蛋白质等表面的负电荷结构,使其与壳聚糖的结合能力减弱,所以当酸性过强(pH<3)时,脱蛋白率和多糖保留率明显下降。因此,体系pH在3~5范围内较适宜,为节约成本,选择原药液(pH=5)进行操作。
2.6 壳聚糖絮凝纯化的正交试验
2.6.1 正交试验因素的选择
根据上述单因素实验结果,选取壳聚糖用量、絮凝时间、絮凝温度3个因素,采用L9(34)正交试验设计(表1),优化工艺条件。
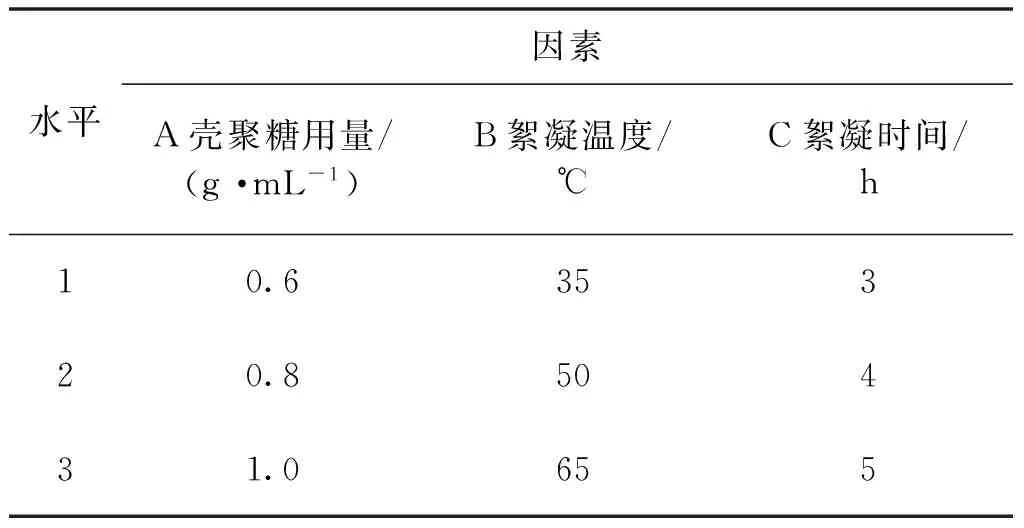
表1 壳聚糖絮凝纯化L9(34)因素水平表Table 1 Factors and levels of L9(34) orthogonal test
2.6.2 正交试验结果的分析
以多糖保留率与脱蛋白率为指标,根据L9(34)正交表设计实验,结果与极差分析见表2,多糖保留率、脱蛋白率方差分析分别见表3和表4。
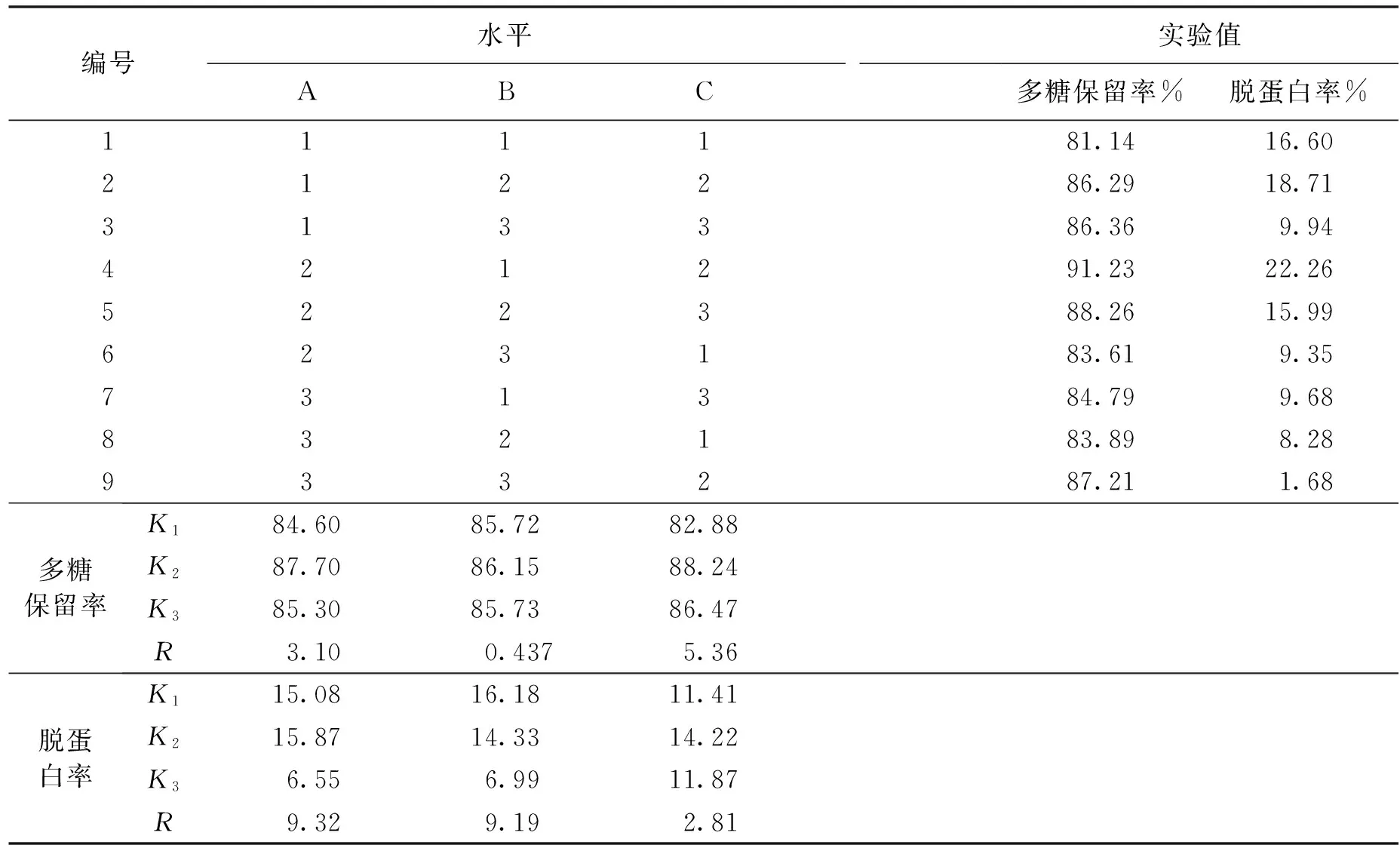
表2 壳聚糖絮凝纯化实验结果与分析表Table 2 Results and analysis of polysaccharides flocculating purification by chitosan
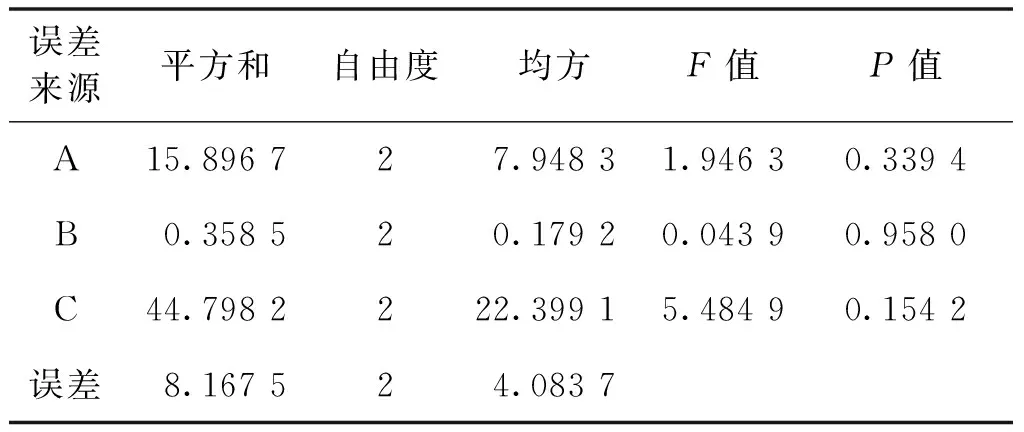
表3 多糖保留率方差分析表Table 3 Variance analysis of polysaccharide retention rate
由表2可知:以多糖保留率为评价指标,发现三因素对纯化工艺的影响作用依次为C、A、B,最佳工艺条件为A2B2C2;由表3可知,各因素对多糖保留率均无显著性影响。

表4 脱蛋白率方差分析表Table 4 Variance analysis of protein removal rate
以表2中的脱蛋白率为评价指标,三因素对纯化工艺的影响作用依次为A、B、C,最佳工艺条件为A2B1C2;由表4可知:PA<0.05,PB<0.05,即壳聚糖用量、絮凝温度对脱蛋白率的影响显著。
综合考虑,本实验优化的工艺条件为A2B1C2(壳聚糖用量0.8 mL/g,絮凝温度35 ℃,絮凝时间4 h),与正交设计中的第4组实验条件相符,此时,脱蛋白率为22.26%,多糖保留率为91.23%。
2.7 纯化工艺的比较
不同纯化工艺的各项指标比较结果如表5所示。由表5可知:壳聚糖絮凝纯化法的脱蛋白率虽低于水提醇沉的效果,但其多糖保留率和纯度均明显高于醇沉效果,分别为其2.55和1.99倍。

表5 纯化工艺的比较Table 5 Comparison of different purification processes
3 结 论
通过单因素和正交试验研究,确定了壳聚糖絮凝纯化合欢皮多糖的优化工艺条件:壳聚糖用量0.8 mL/g,絮凝温度35 ℃,药液浓缩比(质量体积比)1∶10(g/mL),不调药液pH,絮凝时间4 h,发现此时多糖保留率为91.23%、脱蛋白率为22.26%。
通过与传统醇沉法各项指标的比较可以发现,虽然水提醇沉工艺脱蛋白效果较好,但多糖损失严重,而壳聚糖絮凝法对有效成分的保留率和纯度均较高,纯化效果较好,且壳聚糖絮凝工艺实验周期短,操作简便,可以作为现代中药制药工艺改革的发展方向。
[1] 郑虎占.中药临床应用备要之二十四[J].中国临床医生,2012,40(12):67-69.
[2] 乔善义,蔚冬红,郭继芬,等.组合LC-MS-MS鉴定技术的生物活性导向研究合欢皮抗炎活性部位[J].中国中药杂志,2007,32(19):2021-2025.
[3] 马锦媚,孙秀义,毛福祥,等.合欢总甙抗早孕作用的机理研究[J].中国药学杂志,1995,30(2):111.
[4] 吴鹏西,周峰盛,朱巧英,等.“合欢皮298”对小鼠肝癌血管生成作用的实验研究[J].徐州医学院学报,2012,32(1):36-40.
[5] 刘玲艳,杜芳芳,冯磊,等.合欢皮不同提取组分对HMEC细胞和3B11细胞的作用研究[J].时珍国医国药,2011,22(3):762-764.
[6] Jung M J,Chung H Y,Kang S S,et al.Antioxidant Activity from the Stem Bark ofAlbizziajulibrissin[J].Archives of Pharmacal Research,2003,26(6):458-462.
[7] 李浩.合欢皮与山合欢皮镇静催眠作用的比较研究[J].时珍国医国药, 2005,16(6):488.
[8] 李富强.合欢皮皂苷的免疫学活性研究[D].杭州:浙江大学,2010.
[9] 韩莉,崔景荣.合欢皮多糖对S180荷瘤小鼠的抑瘤及免疫调节作用的研究[J].实用医学进修杂志,2000,28(3):144-146.
[10] 田维毅,武孔云,白惠卿.合欢皮红细胞免疫活性成分及其机制的研究[J].四川中医,2003,21(10):17-19.
[11] 成庆利.壳聚糖的结构及抗菌作用研究进展[J].生物技术,2006,16(4):88-91.
[12] Renault F,Sancey B,Badot P M,et al.Chitosan for coagulation/flocculation processes:an eco-friendly approach[J].European Polymer Journal,2009,45:1337-1348.
[13] 黎晶晶,徐格非.苯酚-硫酸法测定灵芝多糖含量的研究[J].杭州化工,2008,38(1):23-26.
[14] 南亚,李宏高.考马斯亮蓝G-250法快速测定牛乳中的蛋白质[J].饮料工业,2007,10(12):41-42.
(责任编辑 周晓薇)
Flocculating purification process of total polysaccharides from bark of Albizzia julibrissin by using chitosan
HAN Le,SUN Xiaohai,HAN Wei
(Engineering Center for Tradition Chinese Medicine Modernization,East China University of Science and Technology,Shanghai 200237,China )
Through single factor and orthogonal experimental designs,the optimun conditions were obtained as follows:the dosage of chitosan was 0.8 mL/g,temperature 35 ℃,flocculation time 4 h,determined as 1∶10 of drug density.Under the optimum conditions,polysaccharide retention rate,protein removal rate,and the purity of polysaccharide were obtained as follows:91.23%,22.26% and 47.27%,respectively.The flocculating purification of total polysaccharides was superior to the traditional method of extracting with water and depositing with alcohol.
Albizziajulibrissin;chitosan;flocculating;polysaccharide
10.3969/j.issn.1672-3678.2014.02.008
2013-07-02
国家大学生创新计划(111025124)
韩 乐(1989—),女,山东威海人,硕士研究生,研究方向:中药制药工程;韩 伟(联系人),教授,E-mail:whan@ecust.edu.cn
R284.2
A
1672-3678(2014)02-0038-06
