固定化地衣芽孢杆菌产弹性蛋白酶的研究
2014-02-08潘进权钟德广
潘进权,钟德广
(岭南师范学院生命科学与技术学院,广东 湛江 524048)
固定化地衣芽孢杆菌产弹性蛋白酶的研究
潘进权,钟德广
(岭南师范学院生命科学与技术学院,广东 湛江 524048)
为提高弹性蛋白酶的发酵产能,构建地衣芽孢杆菌连续发酵产弹性蛋白酶的生产工艺,本研究采用单因素试验及响应面分析法对地衣芽孢杆菌凝胶包埋固定化的工艺进行探讨,并对固定化细胞的发酵产酶性能进行分析。结果表明,地衣芽孢杆菌的适宜固定化体系是聚乙烯醇(polyving akohol,PVA)、海藻酸钠(sodium alginate,SA)和CaCl2,质量分数分别为8.22%、2.27%和2.42%,固定化交联剂硼酸的质量分数为4%;固定化地衣芽孢杆菌发酵产弹性蛋白酶的活力可达到386 U/mL,是相同接种量的游离细胞发酵酶活力的87%;固定化的地衣芽孢杆菌凝胶球具有很好的稳定性,在摇 瓶发酵的条件下可连续使用10 批次以上。以上结果表明,复合凝胶包埋制备的固定化地衣芽孢杆菌细胞可用于连续发酵产弹性蛋白酶的生产工艺。
地衣芽孢杆菌;固定化;发酵;弹性蛋白酶
弹性蛋白酶是一种肽链内切酶,它以水解不溶性弹性硬蛋白为特征,由于具有治疗高血脂症、防止动脉粥样硬化等生理作用,长期以来一直被作为生化药物开发[1]。此外,由于弹性蛋白酶具有特殊的肽键选择性[2-3],它对于由小分子氨基酸残基构成的肽键有很强的水解活性,因此它在蛋白质食品加工中有着特殊的用途[4-7]。弹性蛋白酶的生产一直以来多由动物胰脏提取制备,由于受动物脏器资源限制,弹性蛋白酶向来供不应求,市场售价极高。因此,近年来众多的研究者都转向微生物源弹性蛋白酶的研究[8-11],一系列具有产弹性蛋白酶能力的微生物,包括P. aeruginosa、F. immotum、B. subtilis等不断被发现[12-14]。然而,从报道的结果来看这些微生物弹性蛋白酶的产率均不高[15],这在很大程度上限制了微生物源弹性蛋白酶的开发利用。因此,如何提高微生物弹性蛋白酶的发酵产能成为了关键。
为提高微生物发酵产弹性蛋白酶的能力,课题组在前期开展了大量的菌种选育工作,并获得一株具有较强产弹性蛋白酶的地衣芽孢杆菌(Bacillus licheniformis)DB35-2011。为进一步提高该微生物弹性蛋白酶的发酵产能,课题组拟从发酵工艺的角度入手,构建该菌株的弹性蛋白酶连续发酵生产工艺。为此,本研究探讨了地衣芽孢杆菌固定化的工艺条件,采用二元凝胶(海藻糖凝胶与聚乙烯醇凝胶)包埋法固定化地衣芽孢杆菌,以充分发挥两种凝胶各自的优点,利用海藻糖凝胶球大孔特性以确保发酵过程中培养基营养物质及弹性蛋白酶在凝胶球内外较高的传质效率;聚乙烯醇凝胶则可保证固定化凝胶球有较好的机械强度,以满足连续化发酵的工艺要求。
1 材料与方法
1.1 菌种
地衣芽孢杆菌(Bacillus licheniformis)DB35-2011由湛江师范学院酶工程实验室分离鉴定。
1.2 试剂与仪器
刚果红-弹性蛋白 美国Sigma公司;聚乙烯醇(polyving akohol,PVA) 上海强顺化学试剂有限公司;海藻酸钠(sodium alginate,SA) 天津市科密欧化学试剂开发中心。
723N可见分光光度计 上海精密科学仪器有限公司;GZX-9140 MBE数显鼓风干燥箱 上海博迅实业有限公司;Rosen PSH-200生化培养箱 中科生命科技股份有限公司;HH-601恒温水浴锅 江苏金坛市亿通电子有限公司;NYQ-60生物摇床 武汉汇诚生物科技有限公司;PHS-3C型酸度计 上海雷磁仪器厂。
1.3 地衣芽孢杆菌的培养与固定化方法
1.3.1 培养基
斜面种子培养基:牛肉膏5 g/L、蛋白胨10 g/L、NaCl 5 g/L、琼脂20 g/L,pH 7.5。
液体种子培养基:牛肉膏5 g/L、蛋白胨10 g/L、NaCl 5 g/L,pH 7.5。
发酵培养基:蔗糖40 g/L、蛋白胨20 g/L、麸皮30 g/L(煮汁加入)、磷酸氢二钾2 g/L、碳酸钙3 g/L、吐温-80 2 g/L,pH 7.5。
1.3.2 液体种子培养
将保藏菌种转接到斜面培养基,在35 ℃条件下培养24 h活化,然后将其接种于液体种子培养基,置于摇床35 ℃、180 r/min培养24 h。
1.3.3 菌悬液的制备
培养获得的液体种子经10 ℃、8 000 r/min离心20 min,弃除上清液,用无菌生理盐水按10 mL/g菌体湿质量的比例配成菌悬液。
1.3.4 地衣芽孢杆菌的固定化
称取一定量的PVA于三角瓶中,按浓度要求加入适量蒸馏水,封口后在80 ℃的恒温水浴锅中溶胀约3 h,然后于80 ℃条件下磁力搅拌直至PVA全部溶解;称取一定量的SA,加入到PVA溶液中,然后在80 ℃条件下继续磁力搅拌直至SA完全溶解,即得PVA-SA共混溶液。将融化的PVA-SA共混溶液冷却到室温后,按体积比10∶1的比例与菌悬液混合,用注射器吸取混合液滴入预冷的硼酸-CaCl2混合固定液(灭菌后置于4 ℃冰箱预冷),形成固定化细胞凝胶球,于4 ℃冰箱中静置24 h,取出后用无菌生理盐水洗涤2~3 次即得到固定化细胞。
1.3.5 游离细胞发酵实验
以4%的接种量将培养好的液体种子接入发酵培养基,在35 ℃、180 r/min条件下进行振荡培养3 d,取发酵液测定酶活力。
1.3.6 固定化细胞的发酵方法
取一定量固定化细胞(相当于液体种子4%的接种量)转接入发酵培养基中,在温度35 ℃、180 r/min条件下摇瓶发酵3 d,取适量的发酵液测定酶活力。
1.4 分析方法
1.4.1 弹性蛋白酶活性测定
采用改良的Sachar法[16]:弹性蛋白酶作用于与染料偶联的弹性蛋白,从而使染料溶于水溶液,通过测定反应上清液的光密度值反映底物蛋白被酶消化的程度以确定酶活力。称取20 mg刚果红-弹性蛋白, 溶于1 mL水中,加1 mL pH 7.4、0.2 mol/L硼酸缓冲液,1 mL稀释的酶液,37 ℃振荡反应20 min, 加入2 mL pH 6.0、0.7 mol/L磷酸钠缓冲液终止反应,过滤后测定上清液在590 nm波长处的光密度值。以不加酶液和底物的反应液为空白。在此反应条件下溶解1 mg刚果红-弹性蛋白底物所需的酶量定义为一个弹性蛋白酶活力单位(U)。
1.4.2 固定化细胞凝胶球的传质性能测定[17-18]
选择粒度均匀的凝胶小球50 粒放入装有惰性红墨水的三角瓶中,放入摇床,在35 ℃、180 r/min条件下,每隔5~10 min左右剖开凝胶球观察红墨水进入凝胶球的部位,记录凝胶球充满红色墨水的时间,根据时间长短分析固定化凝胶球的传质性能。
1.4.3 固定化细胞凝胶球机械强度的测定
将固定化细胞接入发酵培养基中进行发酵,发酵3 d后,倾出发酵液,将固定化细胞转接入新的发酵培养基中进行发酵,反复多次,直至固定化细胞完全破碎,统计固定化细胞的发酵批次。根据发酵批次评价凝胶球机械强度。
1.5 单因素试验
1.5.1 PVA质量分数对固定化细胞发酵性能的影响
设定SA及交联剂硼酸、CaCl2的质量分数为1.2%、5%、1.2%,分别以不同质量分数5%、7%、9%、11%、13%的PVA制备固定化地衣芽孢杆菌凝胶球,按照1.3.6节的方法进行发酵培养,测定固定化细胞凝胶球机械强度及发酵液酶活力。
1.5.2 SA质量分数对固定化细胞发酵性能的影响
设定PVA及交联剂硼酸、CaCl2的质量分数为9%、5%、1.2%,分别以不同质量分数0.4%、0.8%、1.2%、1.6%、2.0%的SA制备固定化地衣芽孢杆菌凝胶球,按照1.3.6节的方法进行发酵培养,测定固定化细胞凝胶球机械强度及发酵液酶活力。
1.5.3 CaCl2质量分数对固定化细胞发酵性能的影响
设定PVA、SA及硼酸的质量分数分别为9%、1.2%、5%,考察不同质量分数1%、1.5%、2.0%、2.5%、3.0% CaCl2对细胞固定化及发酵产酶性能的影响。
1.5.4 硼酸质量分数对固定化细胞发酵产酶的影响
设定PVA、SA及CaCl2的质量分数分别为9%、1.2%、2%,考察不同质量分数l%、2%、3%、4%、5%、6%、7%硼酸对细胞固定化及发酵产酶性能的影响。
1.6 中心组合试验设计
在单因素试验结果的基础上,利用SAS统计软件,采用响应面分析法中的中心组合试验设计,进一步考察因素PVA、SA及CaCl2质量分数对地衣芽孢杆菌固定化及发酵产酶性能的影响,分析因素间的交互作用并确定各因素的最佳取值,由此确定制备固定化细胞合适的工艺条件。
2 结果与分析
2.1 PVA质量分数对固定化细胞发酵性能的影响
考察了由不同质量分数PVA制备所得固定化细胞凝胶球的机械强度及发酵产弹性蛋白酶的性能,实验结果如表1和图1所示。

表1 PVA质量分数对固定化细胞凝胶球性能的影响Table1 Effect of PVA mass fraction on gel sphere properties of immobilized cells
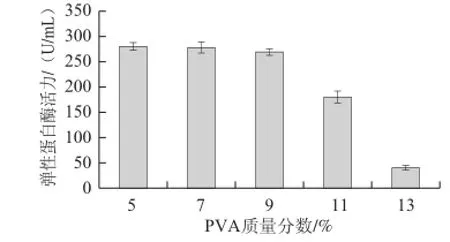
图1 PVA质量分数对固定化细胞发酵产酶的影响Fig.1 Effect of PVA mass fraction on the elastase activity of immobilized cells
由表1可知,当PVA的质量分数在5%以上时,制备所得复合凝胶球具有较好的机械强度,经多次分批发酵仍可保持完整的形态;当PVA的质量分数超过11%,复合凝胶球成形较困难,形状也变得很不规则,这一结果与文献[18]报道相吻合。另外,图1结果显示,当PVA的质量分数在11%以上时,固定化地衣芽孢杆菌细胞的发酵产酶能力会有明显下降,这应该与凝胶球传质效率的下降有密切关系。因为随着PVA质量分数的增加,载体凝胶对细胞的封闭性增强,由此将导致营养物质尤其是弹性蛋白酶在凝胶颗粒内外的扩散效率下降,从而影响凝胶颗粒内细胞的生长、发酵性能及酶的分泌,这一实验结果与文献[19]报道基本一致。综合考虑以上两方面,制备固定化细胞的PVA质量分数应控制在5%~9%范围较为适宜。
2.2 SA质量分数对固定化细胞发酵性能的影响
考察了由不同质量分数SA制备所得固定化细胞凝胶球的机械强度及发酵产弹性蛋白酶的性能,实验结果如表2和图2所示。

表2 SA质量分数对固定化细胞凝胶球性能的影响Table2 Effect of SA mass fraction on gel sphere properties of immobilized cells
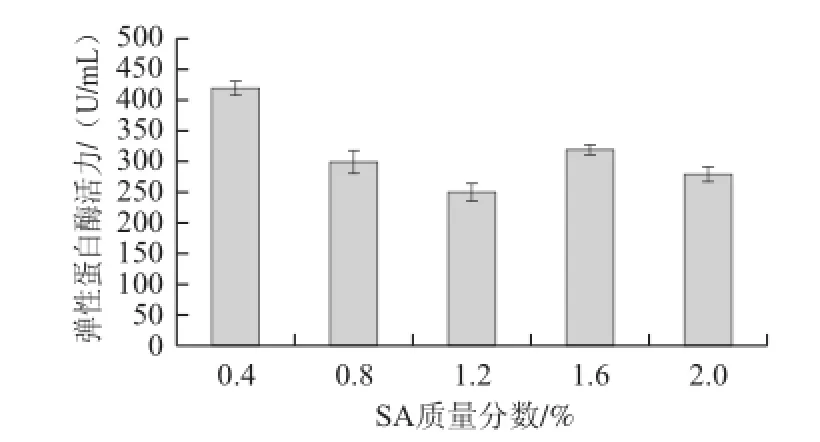
图2 SA质量分数对固定化细胞发酵产酶的影响Fig.2 Effect of SA mass fraction on the elastase activity of immobilized cells
由表2可知,SA质量分数对复合凝胶球的机械强度有显著的影响。SA质量分数过低时,滴入固定液中的复合载体成形较缓慢,极易形成椭圆形的凝胶球,固定化细胞的封闭性能较差,摇瓶发酵过程中易造成凝胶球内容物泄露,凝胶球破碎,从而失去连续发酵的意义;要保证固定化凝胶球有较好的机械强度,SA的质量分数不能低于1.2%。
图2结果表明,当SA质量分数在0.8%~2.0%范围时,固定化细胞发酵产弹性蛋白酶的能力基本保持稳定,说明在此条件下制备所得凝胶球均有较好的传质效率;另外,当SA质量分数在0.4%时,发酵液有相对较高的酶活力,这应该与固定化细胞凝胶球黏连成团,地衣芽孢杆菌细胞从凝胶球内大量释放有密切关系。综合考虑凝胶球的机械强度和固定化细胞发酵产酶性能,SA质量分数控制在1.2%~2.0%较为合适,这一结果与文献[20]报道结果基本一致。
2.3 CaCl2质量分数对固定化细胞发酵产酶的影响
考察了CaCl2质量分数对地衣芽孢杆菌固定化及固定化细胞发酵产弹性蛋白酶性能的影响,实验结果如表3和图3所示。
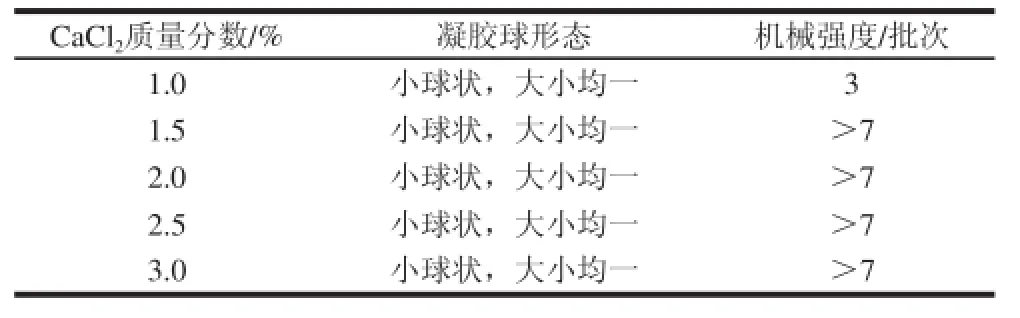
表3 CaaCCll2质量分数对固定化细胞凝胶球性能的影响Table3 Effect of calcium chloride mass fraction on gel sphere properties of immobilized cells
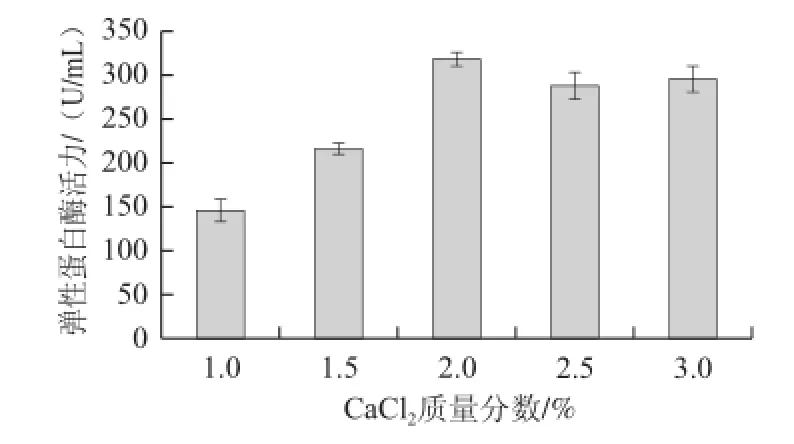
图3 CaCl2质量分数对固定化细胞发酵产酶的影响Fig.3 Effect of calcium chloride mass fraction on the elastase activity of immobilized cells
在形成PVA-SA复合凝胶球的过程中,Ca2+作为交联剂和海藻酸钠分子中的—COO-结合,从而使PVA-SA复合液的液滴交联固化,形成PVA-SA微球。因此,体系中Ca2+的质量分数对PVA-SA微球的形成也有较大的影响。由图3可知,当CaCl2质量分数低于1.5%时,固定化细胞发酵产弹性蛋白酶的能力将受影响;低于1%时,复合凝胶球的机械强度将受影响。因此,在地衣芽孢杆菌细胞固定化的过程中,CaCl2质量分数应控制在2%以上。
2.4 硼酸质量分数对固定化细胞发酵产酶的影响
考察了硼酸质量分数对地衣芽孢杆菌固定化及固定化细胞发酵产弹性蛋白酶性能的影响,实验结果如表4和图4所示。在复合凝胶球的形成过程中,硼酸主要是与PVA发生作用,促进PVA的相互交联,因此其质量分数的高低对复合凝胶球的形成也有一定的影响。由图4可知:当硼酸质量分数低于1%时,固定化凝胶球几乎无法成形;硼酸质量分数在2%~3%时,PVA交联不够充分,凝胶球的机械强度较差,固定化细胞发酵到第二批时已有不同程度的凝胶球破碎及细胞泄露;酶活力测定结果显示,随着固定化体系中硼酸质量分数的增加,固定化细胞产酶能力逐渐增大,当硼酸质量分数达到4%以上时,发酵产酶基本趋于稳定。

表4 硼酸质量分数对固定化细胞凝胶球性能的影响Table4 Effect of boric acid mass fraction on gel sphere properties of immobilized cells
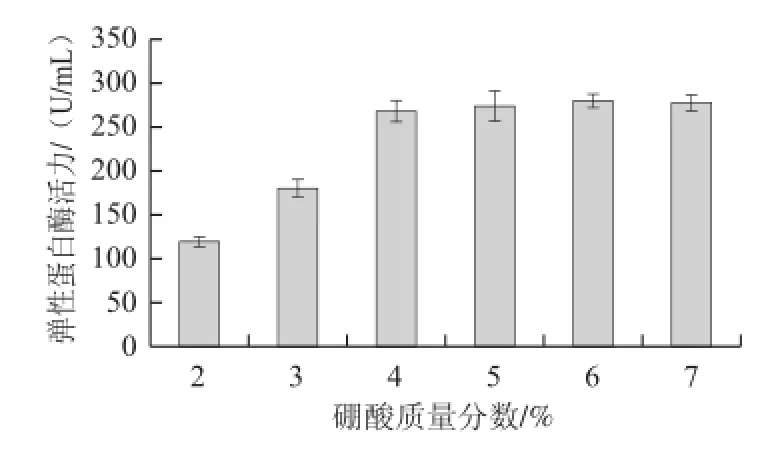
图4 硼酸质量分数对固定化细胞发酵产酶的影响Fig.4 Effect of boric acid mass fraction on the elastase activity of immobilized cells
此外,在实验过程中还发现,硼酸在固定液中的溶解度不高,大约在3.5%左右,当硼酸质量分数大于4%时,固定液中会有一定量的硼酸晶体析出,此时固定液中硼酸质量分数达到饱和并保持稳定。由此可见,固定液中硼酸的质量分数控制在4%较为合适,其足以维持固定体系中硼酸的饱和状态。为此,在后续实验中均设定硼酸质量分数为4%。
2.5 固定化细胞凝胶球传质性能的分析
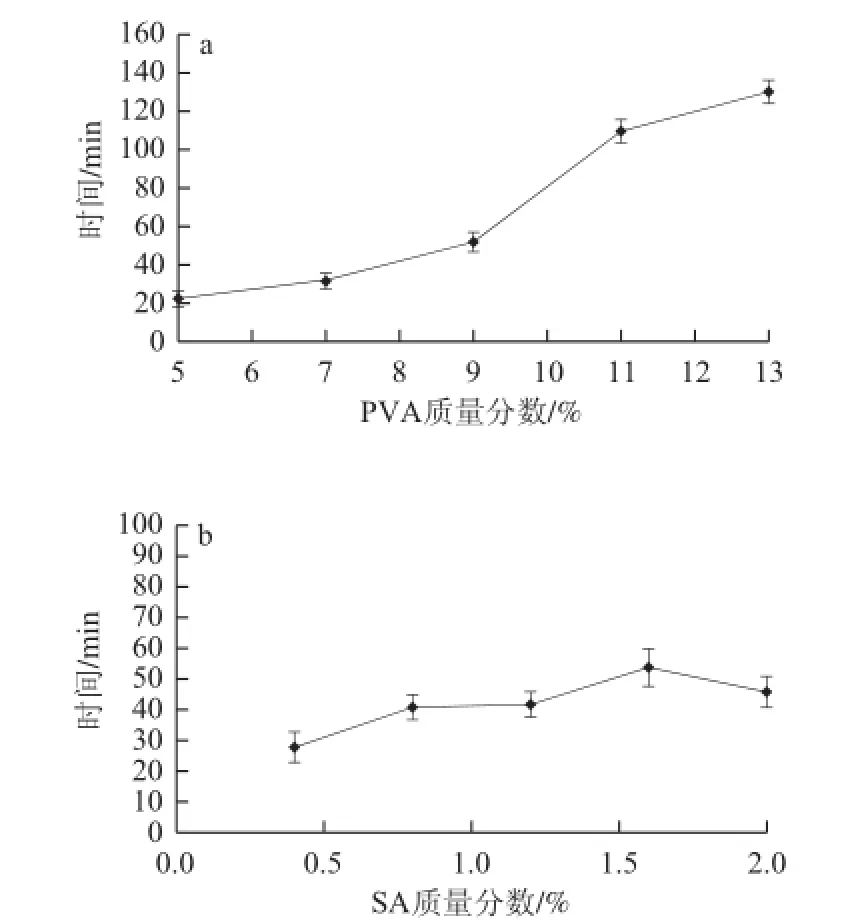
图5 PVA(a)与SA质量分数(b)对凝胶球传质性能的影响Fig.5 Effect of PVA (a) and SA (b) mass fraction on the mass transfer performance of gel spheres
由图5可知,PVA对复合凝胶球的传质效率有极显著的影响,随着凝胶球中PVA质量分数的增加凝胶球的传质效率会明显降低,尤其是当PVA的质量分数大于9%时,物质进出凝胶球所需时间几乎是直线上升,这也进一步解释了为什么当PVA质量分数大于9%时,固定化细胞发酵产弹性蛋白酶的能力会明显降低(图1);相比而言,SA对凝胶球传质性能的影响不显著。
2.6 PVA-SA固定化地衣芽孢杆菌的响应面分析
在保证凝胶球足够机械强度的前提下,进一步综合考察了PVA、SA及CaCl2质量分数对固定化细胞发酵产酶的影响,采用中心组合试验设计及响应面方法分析了各因素间的交互作用并对各因素取值进行了优化。表5给出了因素水平及试验设计与结果。

表5 中心组合试验设计方案及结果Table5 Experiment design and results of central composite design
对表5的试验结果进行回归分析可以得到以下数学模型:
Y=302.1+44.1A+54.8B+27.4C-55.0A2+25.0AB-22.5AC-24.6B2+14.3BC-22.3C2
分析表明,该回归模型具有非常高的显著性(P<0.01),其R2为0.902 7,说明该模型可以解释90.27%的实验结果。图6~8给出了拟合模型的响应曲面,该曲面的形状表明在所选取的试验空间内存在最大响应值。利用SAS软件分析确定了该最大响应值为(373±40) U/mL,其对应因素A、B、C的取值分别为8.22%、2.27%、2.42%。由此确定了地衣芽孢杆菌二元凝胶包埋体系的组成为:PVA质量分数8.22%、SA质量分数2.27%、CaCl2质量分数2.42%、硼酸质量分数4%。在此条件下制备所得固定化细胞发酵产弹性蛋白酶的酶活力平均值为386 U/mL,与模型的预测值基本一致,进一步验证了该模型的可靠性。此外,以优化工艺制备所得固定化细胞凝胶球具有很好的机械强度,在摇瓶发酵的条件下至少可以发酵使用10 批次以上。
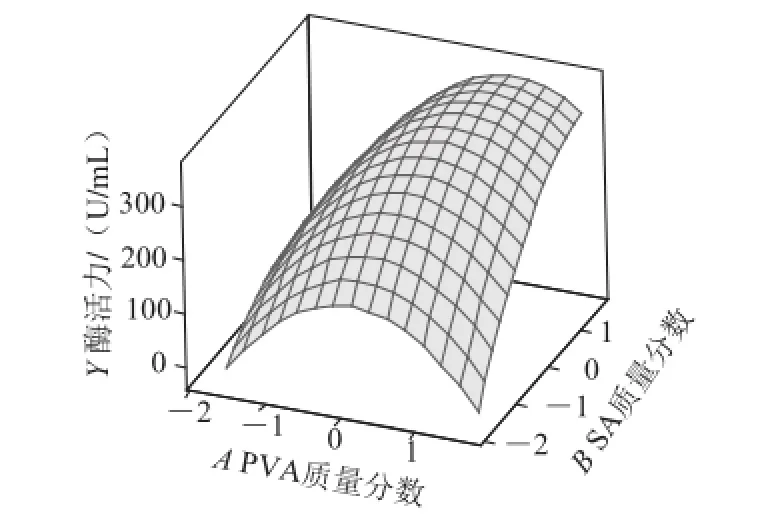
图6 PVA与SA质量分数对固定化细胞发酵产酶的影响Fig.6 Response surface plot showing the effects of PVA and SA mass fraction on the elastase yield from immobilized cells

图7 PVA与CaCl2质量分数对固定化细胞发酵产酶的影响Fig.7 Response surface plot showing the effects of PVA and CaCl2mass fraction on the elastase yield from immobilized cells

图8 SA与CaCl2质量分数对固定化细胞发酵产酶的影响Fig.8 Response surface plot showing the effects of SA and CaCl2mass fraction on the elastase yield from immobilized cells
3 结 论
本研究对地衣芽孢杆菌的固定化工艺进行了探讨,采用二元凝胶包埋的方法进行地衣芽孢杆菌的固定化,复合凝胶能有效地将PVA凝胶与SA凝胶的优点结合起来,既保证了固定化凝胶球有足够的机械强度,同时又确保了凝胶球有良好的传质性能,尤其是能够保障弹性蛋白酶从凝胶球内向发酵液自由扩散。采用中心组合及响应面分析的方法对固定化的工艺进行了优化,确定了合适的工艺条件。在优化的条件下制备所得固定化细胞发酵产弹性蛋白酶的活力可达到386 U/mL,是游离细胞发酵酶活力(440 U/mL)的87%;优化条件下制备得到的固定化细胞有很好的稳定性,在分批发酵条件下可以连续使用10 批次以上。实验结果表明,经二元凝胶包埋法制备所得的地衣芽孢杆菌固定化细胞依然保持了较强的发酵产弹性蛋白酶的活力,制备所得凝胶球具有较好的机械强度,可满足连续化发酵生产工艺的要求。
[1] 刘小杰, 陈启和, 孙桥. 弹性蛋白酶的研究进展[J]. 中国食品添加剂, 2004(4): 29-32.
[2] TSAI Y C, LIN Y T, YANG Y B, et al. Specificity of alkaline elastase Bacillus on the oxidized insulin α- and β-chains[J]. The Journal of Biochemistry, 1988, 104(3): 416-420.
[3] OZAKI H, SHIIO I. Purification and properties of elastolytic enzymes from Flavobacterium immotum[J]. Journal of Biochemistry, 1975, 77: 171-180.
[4] 徐莹, 何国庆. Bacillus sp. EL31410产弹性蛋白酶水解丝素蛋白特性的研究[J]. 食品与发酵工业, 2008, 34(6): 28-31.
[5] TAKAGI H, KONDOU M, HISATSUKA T, et al. Effects of an alkaline elastase from an alkalophilic Bacillus strain on the tenderization of beef meat[J]. Journal of Agricultural and Food Chemistry, 1992, 40(12): 2364-2368.
[6] 刘书亮, 詹莉, 吴琦, 等. 枯草芽孢杆菌弹性蛋白酶对蛋白质水解及肉类嫩化的效果[J]. 食品科技, 2010, 35(6): 162-165.
[7] 韩建春, 邢明伟. 枯草芽孢杆菌产弹性蛋白酶对肉嫩化的工艺研究[J].食品工业科技, 2011, 32(2): 166-168.
[8] 柯娜, 肖昌松. 微生物产生的弹性蛋白酶研究现状[J]. 微生物学通报, 2002, 29(4): 91-94.
[9] 方尚玲, 吉园. 弹性蛋白酶产生菌的分离鉴定和发酵条件研究[J].食品科学, 2007, 28(11): 306-309.
[10] 傅明亮, 刘晓杰, 刘婧, 等. 地衣芽孢杆菌弹性蛋白酶纯化和性质研究[J]. 食品科学, 2011, 32(7): 216-219.
[11] 刘书亮, 吴琦, 詹莉, 等. 枯草芽孢杆菌弹性蛋白酶的纯化及酶学性质研究[J]. 食品与发酵工业, 2010, 36(6): 26-30.
[12] 刘双发, 安德荣, 苟丽霞, 等. 新的产弹性蛋白酶菌株的筛选与鉴定[J].微生物学通报, 2009, 36(9): 1345-1349.
[13] 张娟, 刘书亮, 吴琦, 等. 产弹性蛋白酶芽孢杆菌的筛选与鉴定[J].四川农业大学学报, 2007, 25(3): 253-256.
[14] KAUR M, TRIPATHI K K, GUPTA M, et al. Production and partial characterization of elastase of Bacillus subtilis isolated from the cervices of human females[J]. Canadian Journal of Microbiology, 1988, 34(7): 855-859.
[15] 徐晶, 韩建春. 弹性蛋白酶高产菌株摇瓶发酵条件优化及弹性蛋白酶性质的初步研究[J]. 食品工业科技, 2008, 29(6): 142-144.
[16] 陈启和, 何国庆, 邬应龙. 弹性蛋白酶产生菌的筛选及其发酵条件的初步研究[J]. 浙江大学学报: 农业与生命科学版, 2003, 29(1): 59-64.
[17] 杨丽, 张晶, 熊强, 等. 聚乙烯醇-海藻酸钙作为德氏乳酸杆菌包埋剂的研究[J]. 南京工业大学学报, 2007, 29(1): 65-69.
[18] 冯超阳, 崔圆圆, 康晓梅, 等. PVA-SA复合微球的制备及性能研究[J].化学工业与工程, 2010, 27(5): 381-386.
[19] 钟娅玲, 汤岳琴, 王建华. PVA混合载体固定化枯草杆菌的研究[J].化学反应工程与工艺, 1996, 12(1): 96-100.
[20] 薛亮, 黄祖新, 罗招城, 等. 海藻酸钠-PVA固定化酿酒酵母制备工艺的优化[J]. 酿酒科技, 2009(2): 27-30.
Immobilization of Bacillus licheniformis for Enhanced Production of Elastase
PAN Jin-quan, ZHONG De-guang
(School of Life Science and Technology, Lingnan Normal University, Zhanjiang 524048, China)
To increase the fermentation titer unit of elastase with immobilized Bacillus licheniformis, the immobilization process and fermentation characteristics of Bacillus l icheniformis were investigated and optimized by single-factor experiments and response surface methodology. After optimization, a proper immobilization system was determined, which consisted of polyving akohol (PVA), sodium alginate (SA), calcium chloride and boric acid at a concentration by mass of 8.22%, 2.27%, 2.42% and 4% respectively. Under the optimized conditions, the activity of elastase produced from immobilized Bacillus licheniformis reached 386 U/mL, which was 87% of the fermentation yield with free cells. The immobilized Bacillus licheniformis had good stability, and could be used in fermentation for more than 10 consecutive batches. These experimental results indicate that the immobilized Bacillus licheniformis prepared by composite gel entrapment can be used in continuous fermentation process for the production of elastase.
Bacillus licheniformis; immobilization; fermentation; elastase
Q814.2
A
1002-6630(2014)23-0176-06
10.7506/spkx1002-6630-201423035
2013-12-06
国家星火计划项目(2013GA780084)
潘进权(1978—),男,副教授,博士,研究方向为酶与发酵工程。E-mail:pjq78@sina.com
