甘肃河西走廊葡萄酒产区高产β-葡萄糖苷酶酵母菌株筛选
2014-02-08侯晓瑞杨学山盛文军韩舜愈
侯晓瑞,王 婧,杨学山,盛文军,祝 霞,韩舜愈,*
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.甘肃省葡萄与葡萄酒工程学重点实验室,甘肃 兰州 730070;3.甘肃省葡萄酒产业技术研发中心,甘肃 兰州 730070;4.甘肃农业大学生命科学技术学院,甘肃 兰州 730070)
甘肃河西走廊葡萄酒产区高产β-葡萄糖苷酶酵母菌株筛选
侯晓瑞1,2,3,王 婧1,2,3,杨学山4,盛文军1,2,3,祝 霞1,2,3,韩舜愈1,2,3,*
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.甘肃省葡萄与葡萄酒工程学重点实验室,甘肃 兰州 730070;3.甘肃省葡萄酒产业技术研发中心,甘肃 兰州 730070;4.甘肃农业大学生命科学技术学院,甘肃 兰州 730070)
以甘肃河西走廊葡萄酒产区成熟葡萄浆果自然发酵过程中分离得到的115 株酵母菌株为出发菌株,采用对硝基苯基-β-D-吡喃葡萄糖苷为底物的平板初筛,摇瓶复筛,对高产β-葡萄糖苷酶酵母菌株进行WL营养培养基和赖氨酸培养基初步分类以及26S rDNA D1/D2区序列分析。结果表明:6 株酵母β-葡萄糖苷酶活性与商业酵母ICV-D254酶活性相似,酶活力可达(51.40±4.74) mU/mL,其中菌株QLFE、MQFEH-1、MQFSC-3、MQFEH-2和MQFSM-3为酿酒酵母属,菌株QLFE-4为梅奇酵母属,与分子鉴定结果一致。
酵母筛选;β-葡萄糖苷酶活性;鉴定;26S rDNA D1/D2区序列分析
β-葡萄糖苷酶能催化烷基糖苷、芳基糖苷、纤维素和纤维低聚糖等结合于糖链末端非还原性的β-D-葡萄糖苷键水解,使其释放出游离的具有香气的糖苷配体[1-3]。酵母菌是葡萄酒酿造过程中的主要微生物,原产地环境中可筛选出能充分展现该地域特色的酵母,并酿造出风格独特、具有品种典型性的葡萄酒[4]。近年来,地域特色酵母菌株的应用对提高葡萄酒色泽、香气、结构和其他工艺性能等方面具有积极影响[5-6]。酿酒过程中,酵母次级代谢产物β-葡萄糖苷酶能分解结合态芳香前体物质,对葡萄酒香气的提升具有十分重要的作用[7]。因此,筛选出具有地域特色的高产β-葡萄糖苷酶的酵母菌株对提升产区葡萄酒品质具有积极的意义。
近几年,对产β-葡萄糖苷酶酵母方面的研究一直是国内外研究热点之一。薛菊兰等[8]利用定性培养基对436 株慕萨莱思酿酒酵母产β-葡萄糖苷酶活性进行研究,筛选到10 株β-葡萄糖苷酶高产菌株。Pérez等[9]利用七叶苷甘油琼脂培养基分离得到30 株具有β-葡萄糖苷酶活性的酿酒酵母菌株。Vernocchi等[10]筛选出两株高产胞外β-葡萄糖苷酶的野生酿酒酵母,且具有低残糖和高产橙花叔醇及香茅醇等酿酒特性。
本实验采用对硝基苯基-β-D-吡喃葡萄糖苷(p-nitrophenyl-β-D-glucopyranoside,p-NPG)法从甘肃河西走廊葡萄酒产区成熟葡萄浆果自然发酵过程中分离得到野生酵母菌株中筛选高产β-葡萄糖苷酶菌株,利用WL营养培养基和赖氨酸培养基对其进行初步分类以及分子鉴定。旨在得到具有地区特色的高产β-葡萄糖苷酶的酵母菌株,为本地区葡萄酒酿造酵母资源库的建设奠定一定基础,为地区特色优质葡萄酒的生产提供参考依据。
1 材料与方法
1.1 材料与试剂
115 株酵母菌株:从甘肃河西走廊葡萄酒产区4 个酿酒葡萄种植基地(甘肃威龙酒业有限责任公司民勤苏武山葡萄庄园、甘肃黄羊镇武威莫高葡萄庄园、甘肃张掖祁连酒业有限责任公司张掖高台葡萄庄园、甘肃嘉峪关紫轩酒业有限责任公司嘉峪关葡萄庄园)成熟葡萄浆果自然发酵液中分离得到,保存于甘肃省葡萄与葡萄酒工程学重点实验室。
商业酵母ICV-D254 法国诺盟公司;p-NPG 美国Sigma公司;对硝基苯酚 天津市凯信化学工业有限公司;酵母膏、蛋白胨、葡萄糖、琼脂、柠檬酸、磷酸二氢钠、碳酸钠等均为国产分析纯。
1.2 仪器与设备
SW-CJ-2FD型超净工作台 苏州安泰空气技术有限公司;CPJ214型电子天平 奥豪斯仪器(上海)有限公司;SYQ-DSX-280B型手提式不锈钢压力蒸汽灭菌器 上海申安医疗器械厂;H2050R台式高速冷冻离心机 长沙湘仪离心机仪器有限公司;紫外-可见分光光度计 美国赛默飞世尔科技有限公司。
1.3 培养基
YEPD培养基:酵母浸膏10 g/L、蛋白胨20 g/L、葡萄糖20 g/L、琼脂20 g/L,121 ℃灭菌 20 min。
初筛培养基:马铃薯20 g/L、葡萄糖20 g/L、琼脂20 g/L,自然pH值,121 ℃灭菌 20 min,在温度降到 60~70 ℃左右加入1 g/L p-NPG。
发酵培养基:酵母浸膏10 g/L、蛋白胨20 g/L、葡萄糖20 g/L,121 ℃灭菌 20 min。
WL(Wallerstein Laboratory)营养培养基:酵母浸粉4 g/L、胰蛋白胨5 g/L、葡萄糖50 g/L、琼脂20 g/L;储液A与储液B混合,调pH值至 6.5,灭菌后加储液C。储液A:磷酸二氢钾5.5 g、氯化钾4.25 g、氯化钙1.25 g、硫酸镁1.25 g,定容至400 mL,使用时按40 mL/1 000 mL比例添加;储液B:氯化铁0.25 g、硫酸锰0.25 g,定容至100 mL,使用时按1 mL/1 000 mL比例添加;储液C:0.44 g溴甲酚绿溶于100 mL 50%乙醇溶液中,使用时按1 mL/1 000 mL比例添加。
赖氨酸培养基:称取66 g培养基粉末溶于1 000 mL蒸馏水中,121 ℃灭菌20 min,倾注平板,备用。
1.4 方法
1.4.1 产β-葡萄糖苷酶酵母菌株筛选[4,6]
初筛:由于产β-葡萄糖苷酶菌株在以p-NPG为唯一碳源的筛选培养基上能水解p-NPG生成对硝基苯酚(p-nitrophenol,p-NP),在Na2CO3作用下可形成黄色光圈。光圈颜色深浅能初步反映酶活性高低。因此,将菌株经YEPD培养基活化后接种在筛选培养基上,28 ℃培养72 h,喷1 mol/L Na2CO3进行显色,黄色光圈明显的菌株即为目标菌株,接种于斜面4 ℃保存,作为产β-葡萄糖苷酶菌株进行复筛。
复筛:将初筛得到的菌株活化后,接种到发酵培养基中,28 ℃、200 r/min摇床培养72 h。取发酵液于4 ℃、8 000 r/min离心10 min,收集上清液,即为β-葡萄糖苷酶粗酶液,用于酶活性测定,从中筛选酶活力较高的菌株。
1.4.2 β-葡萄糖苷酶活性的测定
1.4.2.1 标准曲线的绘制[6]
称取对硝基苯酚139.0 mg,蒸馏水定容至1 000 mL,分别吸取1.0、2.0、3.0、4.0、5.0、6.0 mL于100 mL容量瓶中,用1 mol/L Na2CO3溶液定容后混匀。以蒸馏水作为空白,于400 nm波长处测其吸光度。对硝基苯酚在碱性条件下显黄色,在一定范围里其浓度与吸光度成正比。以对硝基苯酚质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线,得到对硝基苯酚标准曲线回归方程:y= 19.882x+0.001 7,相关系数R2=0.999 8,吸光度与对硝基苯酚含量成线性关系。
1.4.2.2 β-葡萄糖苷酶活性测定[4]
取0.1 mL粗酶液与 0.2 mL 35 mmol/L p-NPG(pH 5.0的柠檬酸-磷酸盐缓冲液配制)混匀,50 ℃保温 10 min,加入2 mL 1 mol/L Na2CO3终止反应并显色,于400 nm波长处测定吸光度。以加热失活的酶液按照同样处理作为空白。
酶活力单位定义:酶活力单位(U)定义为pH 5.0、50 ℃反应条件下,1 min水解p-NPG产生1 μmol p-NP所需要的酶量。
1.4.3 菌株初步分类
1.4.3.1 WL固体培养基聚类分析[11]
将供试菌株活化,划线接种于WL营养培养基,28 ℃培养72~96 h,根据菌落的大小、颜色、形态等将菌株进行初步分类。Hemandez等[12]研究表明,WL培养基可以对一些常见葡萄酒相关酵母进行初步分类,不同属的酵母可以在此培养基上呈现不同的菌落形态(表1)。

表1 酵母在WL营养培养基菌落特征[13]Table1 Yeast colony characteristics on WL nutrient medium[13]
1.4.3.2 酿酒酵母与非酿酒酵母的初步鉴定[14]
将供试菌株接种于YPD液体培养基活化24 h后,转接到5 mL无菌水中进行饥饿处理,120 h后接种到赖氨酸培养基,28 ℃培养120 h后观察菌落生长情况,能够在赖氨酸培养基上生长的酵母菌株属于非酿酒酵母,无法生长的为酿酒酵母。
1.4.4 26S rDNA D1/D2区序列分析
1.4.4.1 菌株DNA提取[15]
从新鲜平板中挑取一个单菌落,转到一个含有100 mL LB培养基的1 L烧瓶中。于37 ℃剧烈振摇培养3 h(旋转摇床,300 r/min)。无菌条件下转移到预冷的50 mL聚丙烯管中,在冰上放置10 min,使培养物冷却至0 ℃。4 ℃、4 000 r/min离心10 min,回收细胞。倒出培养液,将管倒置1 min,使最后残留的痕量培养液流尽。以10 mL用冰预冷的0.1 mol/L CaCl2溶液重悬每份沉淀,放置于冰上。4 ℃、4 000 r/min离心10 min,回收细胞。倒出培养液,将管倒置1 min,使最后残留的痕量培养液流尽。每50 mL初始培养物用2 mL用冰预冷的0.1 mol/L CaCl2溶液(含体积分数20%甘油)重悬每份细胞沉淀。将细胞分装成小份(100 μL/支),置于-70 ℃条件下冻存。
1.4.4.2 26S rDNA D1/D2区域PCR扩增和测序[16]
2 6 S r D N A D1/D2区域的扩增引物:N L 1(5’-GCATATCAATAAGCGGAGGAAAAG-3’)和NL4(5’-GGTCCGTGTTTCAAGACGG-3’)。扩增条件:98 ℃ 3 min;98 ℃ 25 s;55 ℃ 25 s;72 ℃ 1 min;30 个循环;72 ℃ 10 min。PCR 反应体系:5×PCR Buffer(含Mg2+)2.5 μL;2.5 mmol/L dNTPs 1 μL;Taq酶0.2 μL,Template 0.5 μL;10 μmol/L 正向和反向引物各0.5 μL;加双蒸水至25 μL。取5 μL产物用 2%的琼脂糖凝胶电泳检测,检验合格后由上海生工生物工程技术服务有限公司进行测序。
1.4.4.3 序列分析
测序结果在GenBank数据库中用Blast程序进行同源序列分析。
2 结果与分析
2.1 产β-葡萄糖苷酶酵母菌株的初筛
将115 株出发菌株活化后分别接种于初筛平板培养后,黄色透明圈直径大小及颜色深浅有明显差异,因此,根据菌落是否有黄色光圈及颜色深浅,将菌株产酶能力初步划分为4 个等级:A为不产酶、B为弱产酶、C为中等产酶、D为较强产酶,见图2。选取初筛菌株中透明圈直径较大、颜色较深(等级划分为D)的44 株菌株进行液体发酵,测定发酵上清液的酶活力大小进行复筛。
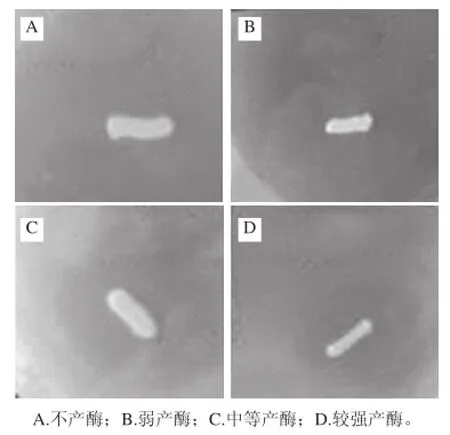
图1 产酶筛选培养基显色Fig. 1 Identification of β-glucosidase activity produced in media by color development
2.2 产β-葡萄糖苷酶酵母酶活性特性分布
由表2可知,不同产区不同发酵期分离得到的115 株酵母菌株产β-葡萄糖苷酶活力大小主要集中在中等酶活性(C)和较高酶活性(D)两个级别,并且产酶菌株以发酵前期为主,占出发菌株的56%,中期和末期均为22%。从葡萄酒产区来看,从民勤产区分离到的产酶菌株占36%,武威、张掖和嘉峪关产区分离到的产酶菌株分别为23%、23%和18%。表明在发酵前期,民勤、武威和张掖产区得到的产酶菌株较多,且活性以中等为最多。发酵中期,菌株以产β-葡萄糖苷酶活性较强为主,产区分布相当。发酵后期,来自民勤产区的出发菌株中产酶菌株较明显,且发酵后期得到的酵母菌株β-葡萄糖苷酶活性较高。说明酵母产β-葡萄糖苷酶活性高低与发酵过程及生态环境有一定关系,其相关性有待进一步研究。
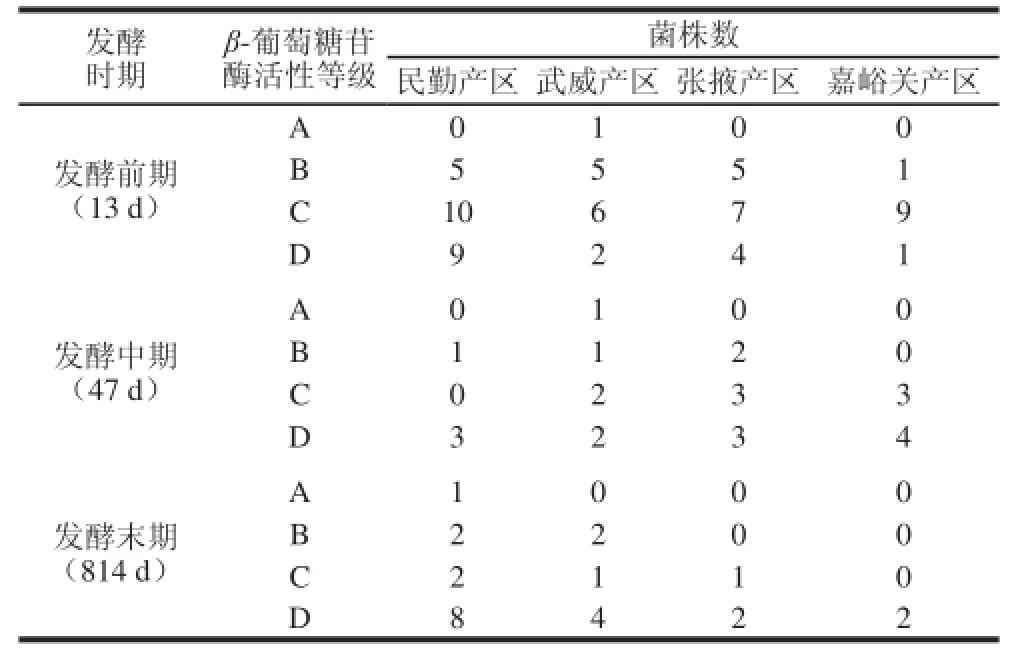
表2 产-葡萄糖苷酶野生酵母在不同产区不同发酵期的分布Table2 Distribution of wild yeast strains with -glucosidase activity from grape berries grown in different regions at different fermentation stages
2.3 高产β-葡萄糖苷酶酵母菌株的复筛
对初筛中显色较强(D级别)的44 株菌株采用p-NPG法进行β-葡萄糖苷酶活性测定,并以商业酵母ICV-D254为对照,结果有6 株酵母菌株酶活性与商业酿酒酵母相当,结果见表3。菌株MQFSC-3和QLFE具有高β-葡萄糖苷酶活性且高于对照商业酿酒酵母ICV,其次菌株QLFE-4、MQFEH-1、MQFEH-2和 MQFSM-3活性与商业酵母相当。

表3 不同酵母菌株β葡萄糖苷酶活性Table3 -glucosidase activities of different yeast strains
2.4 WL营养培养基聚类分析
将复筛到的6 株高产β-葡萄糖苷酶菌株接种于WL培养基,其菌落特征见表4。通过表1与表4的对照,菌株QLFE、MQFEH-1、MQFSC-3、MQFEH-2和MQFSM-3为酿酒酵母属,菌株QLFE-4为梅奇酵母属。

表4 WL营养培养基和赖氨酸培养基鉴定结果Table4 Colony characteristics on WL nutrient medium and growth characteristics in lysine medium
2.5 酿酒酵母与非酿酒酵母的初步鉴定
赖氨酸培养基是根据酿酒酵母不能利用赖氨酸作为唯一氮源的特性进行鉴定的[14]。将筛选到的6 株酵母菌株接种到赖氨酸培养基,观察生长情况。结果显示,菌株QLFE-4能在赖氨酸培养基上较好的生长,而菌株QLFE、MQFEH-1、MQFSC-3、MQFEH-2和MQFSM-3无法生长,如表4所示,由此也说明了QLFE、MQFEH-1、MQFSC-3、MQFEH-2和MQFSM-3为酿酒酵母,而QLFE-4为非酿酒酵母,这与WL培养基鉴定结果相符。
2.6 26S rDNA D1/D2区序列分析

图2 酵母菌株的PCR扩增电泳Fig.2 PCR amplification of yeast strains

表5 酵母菌株 26S rDNAD1/D2测序结果Table5 Sequence analysis of the 26S rDNA D1/D2 domain of yeast strains
通过PCR方法分别扩增MQFSC-3、QLFE、QLFE-4和MQFSM-3(MQFEH-1和MQFEH-2与其重复)的26S rDNA D1/D2区(图2),PCR产物纯化后测序,结果见表5。测序结果与GenBank中已鉴定的酵母26S rDNA D1/D2区序列比对,菌株QLFE、MQFSC-3和MQFSM-3与Saccharomyces cerevisiae的同源性为100%,初步鉴定为酿酒酵母,菌株QLFE-4与Metschnikowia aff. fructicola的同源性为100%,初步鉴定为核果梅奇酵母。
3 结 论
以p-NPG为唯一碳源,对自然发酵过程中分离得到的115 株酵母菌株的产β-葡萄糖苷酶能力进行初步筛选及酶活性测定,通过与商业酵母菌株ICV-D254对比发现6 株酵母菌株酶活性较高,其中菌株MQFSC-3和QLFE高于对照商业酵母,分别为51.40、50.43 mU/mL,具有较好的应用前景。产β-葡萄糖苷酶酵母活性与其分离地点及分离时间存在必然联系,总体来说,高产β-葡萄糖苷酶酵母主要集中在发酵前期以及民勤产区。
本实验利用WL培养基结合赖氨酸培养基对菌株进行初步分类鉴定,通过进一步26S rDNA D1/D2区序列分析验证,并对结果进行比较,其结果说明WL培养基和赖氨酸培养基筛选准确性较高。QLFE、MQFEH-1、MQFSC-3、MQFEH-2和MQFSM-3为酿酒酵母,QLFE-4为核果梅奇酵母。但WL培养基结合赖氨酸培养基筛选需要注意两方面:1)利用WL培养基筛选时要认真观察菌落形态,否则会因为判断错误而导致失误;2)分析赖氨酸培养基筛选过程中饥饿处理时间及菌株生存能力对结果会产生一定的影响。
本实验结果初步揭示了甘肃河西走廊葡萄酒产区葡萄自然发酵过程中产β-葡萄糖苷酶野生酵母的分布情况,并验证了WL培养基结合赖氨酸培养基对酵母筛选的适用性。为筛选具有地区特色产β-葡萄糖苷酶野生酵母提供了理论基础,为本地区葡萄酒酿造酵母资源库的建设提供参考依据,并为其在葡萄酒生产中的应用奠定基础。
[1] ARÉVALO-VILLENA M, ÚBEDA-IRANZO J F, GUNDLLAPALLI S B, et al. Characterization of an exocellular β-glucosidase from Debaromyces pseudopolymorphus[J]. Enzyme Microbial Technology, 2006, 39(2): 229-234.
[2] BAFFI M A, TOBAL T, HENRIQUE J, et al. A novel β-glucosidase from Sporidiobolus pararoseus: characterization and application in winemaking[J]. Journal of Food Science, 2011, 76(7): 997-1002.
[3] 葛有辉, 王德良, 曹建. 富含β-葡萄糖苷酶的酒香酵母在酿酒领域中的应用[J]. 酿酒科技, 2011(2): 96-99.
[4] 王玉霞. 阿氏丝孢酵母β-葡萄糖苷酶及葡萄糖苷类风味物质水解机制的研究[D]. 无锡: 江南大学, 2013.
[5] SUAREZ-LEPE J A, INIGO B. Microbiologia enologica[M]. Madrid: Mundiprensa, 2004: 124-146.
[6] 李庆华. 高产β-葡萄糖苷酶酿酒酵母的筛选及其发酵特性的研究[D].杨凌: 西北农林科技大学, 2009.
[7] 梁华正, 刘富梁, 彭玲西, 等. 京尼平苷为底物测定β-葡萄糖苷酶活力的方法[J]. 食品科学, 2006, 27(4): 182-185.
[8] 薛菊兰, 程玉来, 张佰清, 等. 慕萨莱思酿酒酵母产果胶酶及β-葡萄糖苷酶定性分析[J]. 食品科学, 2013, 34(19): 166-169.
[9] PÉREZ G, FARIÑA L, BARQUET M, et al. A quick screening method to identify β-glucosidase activity in native wine yeast strains: application of Esculin Glycerol Agar (EGA) medium[J]. World Journal of Microbiology and Biotechnology, 2011, 27(1): 47-55.
[10] VERNOCCHI P, NDAGIJIMANA M, SERRAZANETTI D I, et al. Use of Saccharomyces cerevisiae strains endowed with β-glucosidase activity for the production of Sangiovese wine[J]. World Journal of Microbiology and Biotechnology, 2011, 27(6): 1423-1433.
[11] 杨雪峰, 苏龙, 刘树文. 利用WL营养培养基鉴定葡萄酒中的相关酵母菌[J]. 中外葡萄与葡萄酒, 2006(4): 4-7.
[12] HEMANDEZ L F, ESPINOSA J C, FERNANDEZ-GONZALEZ M, et al. β-Glucosidase activity in a Saccharomyces cerevisiae wine strain[J]. International Journal of Food Microbiology, 2003, 80(2): 171-176.
[13] CAVAZZA A, GRANDO M S, ZINI C. Rilevazione della flora microbica dimosti e vini[J]. Vignevini, 1992, 9: 17-20.
[14] 薛军霞. 酿酒酵母的筛选鉴定及耐受性初步研究[D]. 杨凌: 西北农林科技大学, 2007.
[15] 刘树文, 常亚维, 胡廷, 等. 不同树龄葡萄自然发酵过程中酵母茵的研究[J]. 西北农林科技大学学报: 自然科学版, 2008, 36(7): 51-56.
[16] 陈金丽, 郭阳, 薛洁, 等. 优良野生葡萄酒酵母的筛选及性能评价[J].食品与发酵工业, 2012, 38(5): 106-111.
Screening of Yeast Strains Producing β-Glucosidase from Hexi Corridor Wine-Producing Regions of Gansu Province
HOU Xiao-rui1,2,3, WANG Jing1,2,3, YANG Xue-shan4, SHENG Wen-jun1,2,3, ZHU Xia1,2,3, HAN Shun-yu1,2,3,*
(1. College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China; 2. Key Laboratory of Viticulture and Enology in Gansu Province, Lanzhou 730070, China; 3. Research and Development Center of Wine Industry Technology in Gansu Province, Lanzhou 730070, China; 4. College of Life Science and Technology, Gansu Agricultural University, Lanzhou 730070, China)
Totally 115 yeast strains isolated from spontaneously fermented ripe grape berries from Hexi Corridor wineproducing regions of Gansu province were subjected to two-round screening on plates followed by in shaking flasks using p-nitrophenyl-β-D-glucopyranoside (p-NPG) as a substrate for β-glucosidase activity. The strains with higher β-glucosidase activity were subjected to taxonomic identification using WL nutrient medium and lysine medium, and sequence analysis of the 26S rDNA D1/D2 domain. Six yeast isolates with β-glucosidase activity similar to that of commercial yeast ICV-D254, (51.40±4.74) mU/mL, were obtained. Strains QLFE, MQFEH-1, MQFSC-3, MQFEH-2 and MQFSM-3 were identified as Saccharomyces cerevisiae, and QLFE-4 as Metschnikowia. These identification results were in accordance with those from sequence analysis of the 26S rDNA D1/D2domain.
yeast screening; β-glucosidase activity; identification; sequence analysis of the 26S rDNA D1/D2domain
TS261.1
A
1002-6630(2014)23-0139-05
10.7506/spkx1002-6630-201423028
2013-12-17
国家自然科学基金地区科学基金项目(31160310);甘肃省农业生物技术专项(GNSW-2013-16);甘肃省青年科学基金项目(1208RJYA082)
侯晓瑞(1989—),男,硕士,研究方向为酿酒微生物。E-mail:houxiaorui1989@126.com
*通信作者:韩舜愈(1963—),男,教授,博士,研究方向为果蔬加工及葡萄酒酿造。E-mail:gsndhsy@163.com
