大粒车前子麸壳多糖的分离纯化及部分理化性质
2014-02-08施晓丹林慧霞殷军艺聂少平
施晓丹,林慧霞,殷军艺,聂少平,*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.厦门华厦职业学院,福建 厦门 361000)
大粒车前子麸壳多糖的分离纯化及部分理化性质
施晓丹1,林慧霞2,殷军艺1,聂少平1,*
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.厦门华厦职业学院,福建 厦门 361000)
以大粒车前子麸壳为研究对象,提取水溶性多糖组分并对其部分理化性质进行分析。车前子麸壳水提粗多糖经过SephacrylTMS-400 HR葡聚糖凝胶柱得到纯化的多糖组分(polysaccharide from bran of Plantago asiatica L.,PBPL)。结果显示:PBPL为均一多糖,平均分子质量为619 651 D,糖含量、蛋白质含量和糖醛酸含量依次为(71.420±0.007)%、(6.07±0.02)%、(20.74±0.05)%。PBPL含有鼠李糖、阿拉伯糖、甘露糖、葡萄糖及半乳糖5 种单糖,物质的量比为2.24∶1.87∶1.00∶3.24∶3.49,糖醛酸主要是半乳糖醛酸。红外光谱中有多糖、蛋白、糖醛酸以及β-吡喃糖环特征吸收峰。
大粒车前子麸壳;多糖;理化性质
在我国,车前子被定义为大粒车前(Plantago asiatica L.)或平车前(P. depressa Willd)的干燥成熟种子[1],是我国传统中医用药之一[2]。2012年国家食品药品监督管理总局将其列为可用于保健食品的物品[3],其活性成分主要包括苯乙醇苷类、环烯醚萜类、黄酮以及多糖等[4-5]。车前子多糖是车前子种皮外表细胞壁中的黏液质,又被称为车前子胶,早在20世纪50年代左右,Laidlaw等[6-7]就报道了水提卵叶车前子胶的化学结构。近年来,研究发现不同产地来源的车前子多糖都是高度支链化的阿拉伯木聚糖[8-10],并具有免疫调节[11]、降血糖[12]、降血脂[13]以及降低胆固醇[14]等多种生物活性。由于膳食纤维含量很高,目前车前子已被开发成代餐粉,帮助人们瘦身减肥、调节便秘,或作为食品添加剂添加到冰激凌等食品中,改善食品品质。
车前子麸壳是车前子的外壳而非种皮部分,一般在车前子采收后,其麸壳都被浪费,弃之不用,关于其多糖的研究更是未见报道。因此,在车前子多糖研究的基础上,本实验以车前子麸壳作为研究对象,采用传统的水提醇沉法提取多糖,并对所得成分进行分离纯化,同时分析其部分理化性质,旨在为车前子麸壳多糖的结构和功能的深入研究提供参考,同时为车前子麸壳资源的开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
大粒车前子麸壳,产自江西吉安。
葡聚糖凝胶填料 美国Amersham Biosciences公司;葡萄糖 美国Sigma公司;鼠李糖、L-岩藻糖、D-核糖、D-阿拉伯糖、D-木糖、D-甘露糖、D-半乳糖、D-半乳糖醛酸、浓硫酸、石油醚 国药集团化学试剂有限公司;溴化钾(光谱纯)、考马斯亮蓝G-250(进口分装) 德国Fluka公司;牛血清白蛋白 美国Amersco公司;三氟乙酸 阿拉丁试剂有限公司;无水乙醇、氯仿、正丁醇、丙酮 西陇化工股份有限公司;以上试剂至少为分析纯。
1.2 仪器与设备
SephacrylTMS-400 HR凝胶柱(2.6 cm×60 cm,50 μm)上海厦美生化科技有限公司;Agilent 6890气相色谱仪美国Agilent Technologies 公司;T6新世纪紫外可见分光光度计 北京普析通用仪器有限责任公司;高效液相色谱仪 美国Waters公司;Nicolet FT-IR 5700型傅立叶红外光谱仪 美国Thermo Electron公司;ALPHA 1-2冷冻干燥机 德国Martin Christ公司;AL 104 型电子天平上海梅特勒-托利多仪器公司。
1.3 方法
1.3.1 车前子麸壳精制多糖的制备
称取干燥的车前子麸壳500 g,加入石油醚(沸程60~90 ℃)4 000 mL,常温下浸提24 h进行脱脂。过滤,挥发去除溶剂后加80%乙醇4 000 mL浸泡1 d,过滤,滤渣于50 ℃烘箱中挥发去除乙醇。干燥后,加5 000 mL 蒸馏水,沸水浴提取2 h,离心分离(4 800 r/min,10 min),过滤,滤渣重复提取2 次,合并滤液,真空浓缩,加入80%乙醇后于4 ℃醇沉过夜,再次离心分离,冷冻干燥得车前子麸壳水提物。将所得水提物复溶于水,采用Sevag法(氯仿-正丁醇(4∶1,V/V))反复脱蛋白,然后用流动自来水透析48 h,蒸馏水透析24 h,透析液真空浓缩后缓慢加入95%食用级或无水乙醇(终体积分数为80%),于4 ℃冰箱中醇沉过夜后离心分离,沉淀依次用无水乙醇、丙酮、乙醚各洗两次,冷冻干燥得大粒车前子麸壳水提粗多糖(crude polysaccharide from bran of Plantago asiatica L.,CPBPL),称质量,备用。
1.3.2 车前子麸壳水提多糖的纯化
参照文献[15]中车前子多糖的纯化方法,将所得的CPBPL用超纯水配制成4 mg/mL的溶液,用0.8 μm滤膜过滤,采用SephacrylTMS-400 HR葡聚糖凝胶柱对所得的CPBPL进行分离纯化。苯酚-硫酸法跟踪监测得到多糖洗脱曲线。实验以0.15 mol/L NaCl溶液为流动相,流速为1.2 mL/min,进样体积为3 mL。将收集的多糖组分浓缩冻干得大粒车前子麸壳多糖(PBPL)。
1.3.3 纯度及平均分子质量的测定
采用高效凝胶渗透色谱法测定PBPL的 纯度及平均分子质量[15]。色谱柱为UltrahydrogelTMLinear凝胶柱(7.8 mm×300 mm,10 μm);流动相为水,流速为0.6 mL/min;示差检测器;柱温保持在35 ℃;进样量为20 μL。以葡萄糖、Dextran T-10、Dextran T-40、Dextran T-70、Dextran T-500和蓝色葡聚糖标准品分配系数为y轴,以标准品分子质量为x轴绘制标准曲线,得到回归方程为:y=-0.236 9 lgx+1.547 8,R2= 0.994 1。相同条件下测定PBPL的保留时间,根据标准曲线求得PBPL的平均分子质量。
1.3.4 化学成分分析
采用苯酚-硫酸法[16],以葡萄糖和半乳糖的混合溶液为标准,测定总糖含量。采用考马斯亮蓝法[17],以牛血清白蛋白为标准,测定蛋白质含量。采用硫酸-咔唑法[18],以半乳糖醛酸为标准测定糖醛酸含量。
1.3.5 PBPL单糖组成分析
[19]的方法,称取3.3 mg PBPL于安瓿管中,加入2 mL浓度为2 mol/L的三氟乙酸,真空封管,然后置于烘箱中,于100 ℃反应12 h,反应完成后冷却至室温,70 ℃水浴挥发去除N2,得到水解后的单糖混合物,然后将水解得到的单糖混合物衍生为糖腈乙酸酯,反应产物可直接进样,用气相色谱(gas chromatography,GC)分析。
色谱条件:采用DB1701石英毛细管柱(30 m× 0.25 mm,0.25 μm),固定液为SE-54;载气为氮气,进样量1 μL;进样口温度:250 ℃,升温程序:170 ℃保持2 min,以10 ℃/min 升至250 ℃,维持20 min;色谱柱温:250 ℃;检测器:FID检测器;分流比:20∶1。
1.3.6 PBPL糖醛酸组成分析
采用碳化二亚胺[20-21]对PBPL进行反复还原3 次,硫酸-咔唑法检测为阴性后,冷冻干燥,将还原后的样品记为PBPL-R。所得的还原产物采用气相色谱法分析其单糖组成,通过对比羧基还原前后中性糖的变化推测出糖醛酸的组成。
1.3.7 红外光谱分析
取适量样品,用KBr压片,采集PBPL的红外光谱信号,波数扫描范围为400~4 000 cm-1,然后对光谱图进行分析[22]。
2 结果与分析
2.1 车前子麸壳多糖纯度及平均分子质量
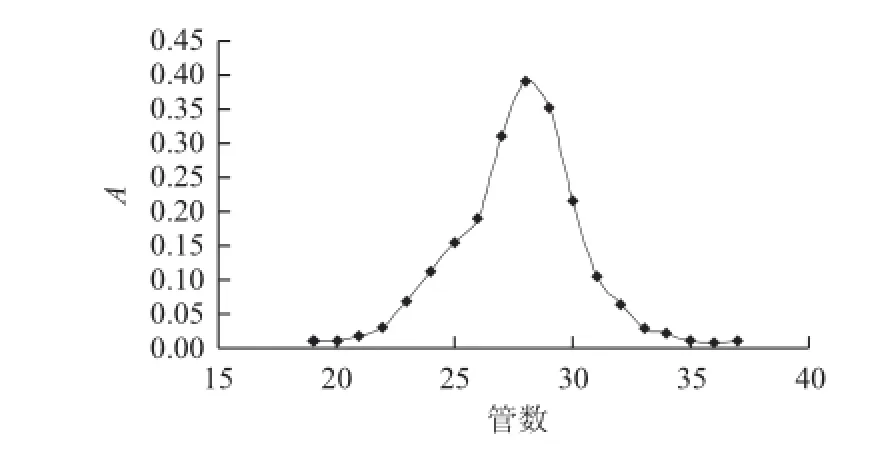
图1 大粒车前子麸壳水提粗多糖纯化洗脱曲线Fig.1 Elution curve of water extractable crude polysaccharide from Plantago asiatica L. bran
根据1.3.1节方法制备得到的CPBPL得率约为5%,少于前期报道的车前子多糖最高得率(13.79%)的一半[15]。多糖的分子大小和形状不同,在凝胶柱中的洗脱速率也不同,大分子质量的多糖先洗脱出来,小分子质量的多糖后被洗脱出来。图1是CPBPL的洗脱曲线,为单一对称峰,可见其纯度较高。

图2 PBPL的示差色谱图Fig.2 Differential chromatogram of PBPL with RI detection
由图2可知,高效凝胶渗透色谱峰为均匀对称单一峰,即经葡聚糖凝胶柱纯化后所得多糖PBPL为均一多糖。根据标准曲线方程计算得到PBPL平均分子质量为619 651 D。
2.2 车前子麸壳多糖化学成分分析
表1 PBPL 化学组成分析(±s,n=3)Table1 Chemical composition of PBPL (±s,n=3)
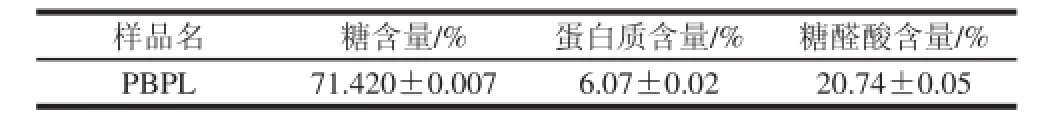
表1 PBPL 化学组成分析(±s,n=3)Table1 Chemical composition of PBPL (±s,n=3)
样品名糖含量/%蛋白质含量/%糖醛酸含量/% PBPL71.420±0.0076.07±0.0220.74±0.05
由表1可知,与同样方法制备的车前子多糖的理化指标(糖含量87.3%,蛋白质含量1.2%,糖醛酸含量14.7%)[12]相比,车前子麸壳多糖的糖含量相对较低,而蛋白质和糖醛酸含量比较高,这可能是因为蛋白质与多糖形成糖蛋白复合物,用Sevag法很难完全清除[23]。
2.3 单糖及糖醛酸组成分析
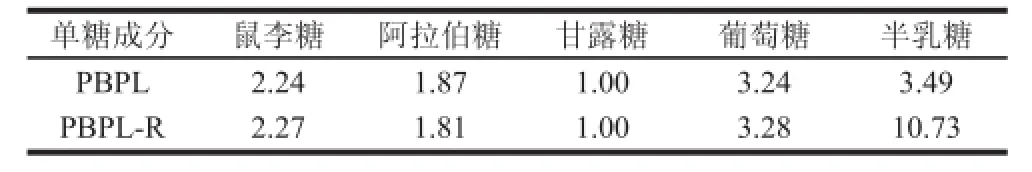
表2 PBPL单糖以及糖醛酸组成物质的量比Table2 Molar ratio of monosaccharide and uronic acid compositions of PBPL
由表2可知,PBPL主要由鼠李糖、阿拉伯糖、甘露糖、葡萄糖及半乳糖5 种单糖构成,其中葡萄糖和半乳糖为主要成分。另外,多糖经过糖醛酸还原后,半乳糖的含量明显增加,其他单糖含量基本保持不变,由此推测出其中部分半乳糖是由半乳糖醛酸转化而来的。
目前研究报道的卵叶车前子中提取的多糖则是以吡喃型木聚糖为主链,同时连有3%~5%的鼠李糖残基、5%~8%的半乳糖醛酸的高度支化的阿拉伯木聚糖[9,24-25]。另外,大粒车前子多糖PLP-2也主要由阿拉伯糖和木糖组成,还有少量的鼠李糖、甘露糖、葡萄糖和半乳糖,但PLP-2的主要糖醛酸为葡萄糖醛酸[26]。由此可见,PBPL与车前子多糖的化学组成存在很大差别。
2.4 红外光谱扫描结果
红外光谱法是鉴定化合物和测定分子结构最有用的方法之一,该测试方法所需样品少,非常适合于测定样品得率低的多糖分子结构。PBPL的红外光谱如图3所示,在3 600~3 000 cm-1之间出现的宽而强的吸收峰推测为糖类中的O—H伸缩振动形成的,在2 934.5 cm-1左右出现的弱吸收峰推测为甲基或亚甲基的C—H伸缩振动,而1 400~1 200 cm-1之间的一组峰推测为糖类的C—H变角振动,在1 650~1 600 cm-1之间应该有糖环的伸缩振动;由此可初步确定该化合物为糖类物质[27]。

图3 PBPL的红外光谱图Fig.3 IR Spectrum of PBPL
在1 611 cm-1处附近尖而强的吸收峰推测为C=O的伸缩振动形成的,而在1 413.6 cm-1处应该是N—H的变角振动,这证明有蛋白质存在。1 248.8 cm-1处吸收峰为COOH中O—H的变角振动,由此可以判断车前子麸壳多糖中含有—CHO和—COOH,这也验证了车前子多糖中含有糖醛酸。另外,1 049.5 cm-1处的吸收峰表明PBPL含有吡喃糖环,919.0 cm-1处的弱吸收峰为β-吡喃糖环的非对称伸缩振动所形成的[21,28]。
3 结 论
本实验分离纯化得到大粒车前子麸壳多糖,并对其部分理化性质作了分析。结果表明,PBPL的平均分子质量为619 651 D,所得组分中糖含量较高(约71%),同时含有较高含量的糖醛酸和少量蛋白质。单糖组成分析显示,PBPL主要含有葡萄糖和半乳糖,共占60%以上,此外还含有鼠李糖、阿拉伯糖和甘露糖。其糖醛酸主要是半乳糖醛酸。红外光谱分析显示PBPL具备多糖、糖醛酸、蛋白质以及β-吡喃糖环的特征吸收峰。PBPL在化学成分以及结构组成方面与所报道的车前子多糖相比具有很大的差异,是一种新的多糖组分,所以有必要进一步对PBPL的结构及活性进行深入研究,为大粒车前子麸壳资源的开发利用提供理论依据。
参考文献:
[1] 侯宽昭. 中国种子植物科属辞典[M]. 北京: 科学出版社, 1984: 383.
[2] 国家中医药管理局《中华本草》编委会. 中华本草精选本(下册)[M].上海: 上海科学技术出版社, 1998: 1781.
[3] 国家食品药品监督管理总局. 可用于保健食品的物品名单[EB/OL]. (2012-12-07)[2014-06-01]. 国家食品药品监督管理总局网站http:// www.sda.gov.cn.
[4] NIE Shaoping, YIN Junyi, HUANG Danfei, et al. Review of the physicochemical properties and structural characteristics of psyllium and its relative bioactivtity[C]//WILLIAMS P A, PHILLIPS G O. The Proceedings of the 17thGums and Stabilizers for the Food Industry. UK: The Royal Society of Chemistry, 2014: 79-89.
[5] SAMUELSEN A B. The traditional uses, chemical constituents and biological activities of Plantago major L.: a review[J]. Journal of Ethnopharmacology, 2000, 71(1/2): 1-21.
[6] LAIDLAW R A, PERCIVAL E G V. Studies of seed mucilages. Part Ⅴ. Examination of a polysaccharide extracted from the seeds of Plantago ovata forsk by hot water[J]. Journal of the Chemical Society, 1950: 528-534.
[7] LAIDLAW R A, PERCIVAL E G V. Studies on seed mucilages. Part Ⅲ. Examination of a polysaccharide extracted from the seeds of Plantago ovata forsk[J]. Journal of the Chemical Society, 1949: 1600-1607.
[8] YIN Junyi, LIN Huixia, LI Jing, et al. Structural characterization of a highly branched polysaccharide from the seeds of Plantago asistica L.[J]. Carbohydrate Polymers, 2012, 87(4): 2416-2424.
[9] MARLETT J A, FISHER M H. The active fraction of psyllium seed husk[J]. Proceedings of the Nutrition Society, 2003, 62(1): 207- 209.
[10] SAGHIR S, IQBAL M S, HUSSAIN M A, et al. Structure characterization and carboxymethylation of arabinoxylan isolated from Ispaghula (Plantago ovata) seed husk[J]. Carbohydrate Polymers, 2008, 74(2): 309-317.
[11] HUANG Danfei, TANG Yongfu, NIE Shaoping, et al. Effect of phenylethanoid glycosides and polysaccharides from the seed of Plantago asiatica L. on the maturation of murine bone marrow-derived dendritic cells[J]. European Journal of Pharmacology, 2009, 620(1/3): 105-111.
[12] HANNAN J M A, ALI L, KHALEQUE J, et al. Aqueous extracts of husks of Plantago ovata reduce hyperglycaemia in type 1 and type 2 diabetes by inhibition of intestinal glucose absorption[J]. British Journal of Nutrition, 2006, 96(1): 131-137.
[13] SOLÀ R, GODÀS G, RIBALTA J, et al. Effects of soluble fibre (Plantago ovate husk) on plasma lipids, lipoproteins, and apolipoproteinns in men with ischemic heart disease[J]. The American Journal of Clinical Nutrition, 2007, 85(4): 1157-1163.
[14] de BOCK M, DERRAIK J G B, BRENNAN C M, et al. Psyllium supplementation in adolescents improves fat distribution & lipid profile: a randomized, participant-blinded, placebo-controlled, crossover trial[J/OL]. PLoS One, 2012. doi: 10.1371/journal. pone.0041735.
[15] 林慧霞, 聂少平, 殷军艺, 等. 大粒车前子多糖提取工艺优化及其理化性质研究[J]. 食品科学, 2010, 31(22): 226-231.
[16] 周超, 谢明勇, 万茵, 等. 车前子多糖的测定方法研究[J]. 分析实验室, 2008, 27(4): 10-13.
[17] 王多宁, 赵雁武, 田芙蓉. 考马斯亮蓝微盘比色法测定蛋白质含量[J].第四军医大学学报, 2001, 22(6): 528-529.
[18] 林颖, 黄琳娟, 田庚元. 一种改良的糖醛酸含量测定方法[J]. 中草药, 1999, 30(11): 817-819.
[19] 殷军艺, 聂少平, 林慧霞, 等. 大粒车前子多糖乙醇分级及其理化性质研究[J]. 食品科学, 2009, 30(17): 34-37.
[20] TAYLOR R L, CONRAD H E. Stoichiometric depolymerization of polyuronides and glycosaminoglycuronans to monosaccharides following reduction of their carbodiimide-activated carboxyl groups[J]. Biochemistry, 1972, 11(8): 1183-1188.
[21] SINGTHONG J, CUI S W, NINGSANOND S, et al. Structural characterization, degree of esterif cation and some gelling properties of Krueo Ma Noy (Cissampelos pareira) pectin[J]. Carbohydrate Polymers, 2004, 58(4): 391-400.
[22] ZHANG Hui, NIE Shaoping, YIN Junyi, et al. Structural characterization of a heterogalactan purified from fruiting bodies of Ganoderma atrum[J]. Food Hydrocolloids, 2014, 36: 339-347.
[23] 刘小如, 张丽美, 胡蒋宁, 等. 油茶粕多糖的分级纯化及结构研究[J].食品科学, 2013, 34(23): 96-102.
[24] van CRAEYVELD V, DELCOUR J A, COURTIN C M. Extractability and chemical and enzymic degradation of psyllium (Plantago ovate Forsk) seed husk arabinoxylans[J]. Food Chemistry, 2009, 112(4): 812-819.
[25] EDWARDS S, CHAPLIN M F, BLACKWOOD A D, et al. Primary structure of arabinoxylans of ispaghula husk and wheat bran[J]. Proceedings of the Nutrition Society, 2003, 62(1): 217-222.
[26] 殷军艺, 林慧霞, 李菁, 等. 大粒车前子多糖PLP-2结构研究[J/OL].中文科技论文在线, 2011-10-08. http://www.paper.edu.cn.
[27] WU Yan, CUI S W, WU Jinhong, et al. Structure characteristics and rheological properties of acidic polysaccharide from boat-fruited sterculia seeds[J]. Carbohydrate Polymers, 2012, 88(3): 926-930.
[28] 张霞, 聂少平, 李昌, 等. 夏枯草水溶性多糖乙醇分级纯化及其理化性质研究[J]. 食品工业科技, 2012, 33(20): 87-90.
Isolation, Purification and Partial Physico-chemical Properties of Polysaccharide from Bran of Plantago asiatica L.
SHI Xiao-dan1, LIN Hui-xia2, YIN Jun-yi1, NIE Shao-ping1,*
(1. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China; 2. Xiamen Huaxia Vocational College, Xiamen 361000, China)
A polysaccharide fraction, PBPL, purif ed from Plantago asiatica L. bran was characterized for physico-chemical properties. It was extracted with hot water and purif ed by SephacrylTMS-400 HR chromatographic column. The relative average molecular weight determined by high performance gel permeation chromatography (HPGPC) was 619 651 D. The results showed that PBPL contained (71.420 ± 0.007)% of total sugar, (6.07 ± 0.02)% of protein and (20.74 ± 0.05)% of uronic acid by a colorimetric method. Rhamnose, arabinose, mannose, glucose and galactose were found to be the compositional monosaccharides at a molar ratio of 2.24:1.87:1.00:3.24:3.49 in PBPL using gas chromatography (GC). After reduction, galacturonic acid was conf rmed to be the major component of uronic acid. As shown by infrared spectral (IR) analysis, PBPL had characteristic absorption peaks of polysaccharide, protein and uronic acid and β-pyranose ring.
Plantago asiatica L. bran; polysaccharide; physico-chemical properties
O652.4;R284.2
A
1002-6630(2014)23-0039-04
10.7506/ spkx1002-6630-201423008
2014-06-18
国家高技术研究发展计划(863计划)项目(2013AA102102);江西省高等学校科技落地计划项目(KJLD13004);国家自然科学基金青年科学基金项目(31301434);2013年度高等学校博士学科点专项科研基金项目(20133601120009)
施晓丹(1990—),女,硕士研究生,主要从事食物(含生物质)资源开发与利用研究。E-mail:ncuskshixiaodan@163.com
*通信作者:聂少平(1978—),男,教授,博士,主要从事食品化学与分析、食品营养与安全、复杂碳水化合物研究。E-mail:spnie@ncu.edu.cn
