重组人白细胞介素-11预防髓母细胞瘤术后放射治疗所致血小板减少的临床研究*
2014-02-08方恒虎康静波赵向飞吴姗珊路泽军
方恒虎康静波*赵向飞吴姗珊路泽军
重组人白细胞介素-11预防髓母细胞瘤术后放射治疗所致血小板减少的临床研究*
方恒虎①康静波①*赵向飞①吴姗珊①路泽军①
目的:评价重组人白细胞介素-11(rhIL-11)预防髓母细胞瘤术后放射治疗所致血小板减少的疗效和不良反应。方法:60例患者采用随机对照研究方法,将其分为A组(rhIL-11预防治疗组30例)和B组(对照组30例)。A组患者放射治疗中血小板计数<100×109/L时或血小板计数较放射治疗前基线水平下降>50%即开始按50μg•kg-1•d-1剂量给予rhIL-11皮下注射,每日1次连续应用,直至血小板计数≥200×109/L时停药;B组患者不予预防性应用rhIL-11治疗,但当血小板计数<50×109/L时则按50μg•kg-1•d-1剂量给予rhIL-11皮下注射治疗,每日1次连续应用,直至血小板计数≥100×109/L时停药。结果:本研究中54例患者可进行疗效评价。rhIL-11可显著升高髓母细胞瘤术后放射治疗中血小板的最低值,显著缩短血小板减少症的持续时间和缩短放射治疗所需的时间。主要不良反应有注射部位疼痛、硬结、红肿、水肿、乏力及心悸等,但大多程度较轻,且无其他严重不良反应。结论:rhIL-11具有明显的促血小板生成作用,可显著减少髓母细胞瘤患者术后放射治疗过程中血小板减少的发生率,保证放射治疗的顺利进行,且不良反应较轻,较易处理。
重组人白细胞介素-11;血小板减少症;预防;放射治疗
髓母细胞瘤术后的全脑全脊髓+瘤床局部加量放射治疗已成为髓母细胞瘤标准的放射治疗模式,但因全脑全脊髓放射治疗照射范围广,会造成不同程度的血小板减少,轻者影响放射治疗的顺利进行,进而影响治疗效果,重者则有可能导致自发性颅内出血而危及患者生命。选取2008年7月至2012年6月60例髓母细胞瘤患者纳入本研究,在进行放射治疗的同时给予重组人白细胞介素-11(recombinant human interleukin-11,rhIL-11)预防治疗,降低了血小板减少的发生率,保证了髓母细胞瘤术后放射治疗的顺利进行。
1 资料与方法
1.1 一般资料
本研究共入选60例患者,将其随机分为A组(rhIL-11治疗组)和B组(对照组),每组30例。
入组条件:①有明确病理学诊断的髓母细胞瘤术后患者;②放射治疗前血常规基本正常,即白细胞计数≥4.0×109/L、血红蛋白≥95 g/L及血小板计数≥100×109/L;③所有患者入院时均经肝、肾功能及心电图检查,并排除严重肝、肾功能不全,心功能不全Ⅱ级以上,有血栓栓塞疾病史或心率失常史,以及妊娠及哺乳期妇女;④患者年龄在6~24岁,Karnofsky评分≥70分;⑤患者同意并签署知情同意书。最后出组4例、剔除2例,进入统计分析54例(A组28例,B组26例)。
1.2 治疗方法
(1)放射治疗。所有患者于术后4周内行全脑全脊髓+瘤床局部缩野放射治疗,采用西门子公司Somatom螺旋CT模拟定位机定位,患者取俯卧位,双手平行置于双腿外侧,热塑颈肩膜固定。平静状态行螺旋CT,层厚5 mm的连续扫描,所有患者均行增强扫描,激光灯3点对位,CT图像传输入Accusoft三维适形TPS系统。
全脑全脊髓照射。①全脑照射:包括颅内全部组织,即大脑、小脑、脑干、脑膜和脑池。用左右两侧野对穿照射,射野的前、上及后界均以颅骨外侧为界。下界包括全颅底,因前颅凹较高,为眶上缘到鞍背的连线。接着从鞍背向下连线与枕骨大孔下缘的水平线相交,即为颅中凹和颅后凹的前界和下界;②全脊髓照射:用背侧垂直单野(分上下两野),上界为全脑射野的下界,下界在脊髓圆锥部(即L2、L3处)。两侧外界在椎弓根的外缘1 cm处,由于骶骨部宽大,两侧外界相应扩大,以防漏照。全脑射野和全脊髓射野之间的边界每周依次向上移动1次,以防射野衔接处超量或欠量。全脑全脊髓照射的分割方式为1.8 Gy/次/d、5次/周,处方剂量为36 Gy。
瘤床局部缩野照射。结合定位CT平扫及增强图像,并参考MRI等相关检查结果,由两名以上医生及物理师共同进行肿瘤体积(gross tumor volume,GTV)勾画。GTV包括MRI上T1加权像瘤床增强区域+T2加权像异常区域。GTV外放2 cm为临床靶区(clinical target volume,CTV),计划靶区(planing target volume,PTV)依据实际操作情况,在CTV基础上适当外扩0.5 cm。适形野以低熔点铅模控制,线束视角显示方向设共面或非共面野3~4个野,采用西门子Priume直线加速器6 MV-X射线为照射源照射,瘤床局部照射的分割方式为2 Gy/次·d-1、5次/周,于全脑全脊髓系统完成剂量36 Gy后连续进行照射追加剂量至56 Gy,理论治疗时间为14 d。
(2)升血小板治疗。A组28例(应用rhIL-11粉针剂治疗,3.0 mg/支,山东齐鲁制药厂提供,批号:20120301),在血小板计数<100×109/L时或血小板计数较放射治疗前基线水平下降>50%即开始按50 µg•kg-1•d-1剂量给予rhIL-11皮下注射,1次/d,连续应用,同时继续行放射治疗。隔日检查血常规,直至血小板计数≥200×109/L时停药。治疗过程中如出现WHO所规定的Ⅲ~Ⅳ级毒副反应,立即终止rhIL-11治疗。B组26例(常规应用利可君、升血小板胶囊等药物治疗)不予预防性应用rhIL-11治疗,但当血小板计数<50×109/L时则按50 µg•kg-1•d-1剂量给予rhIL-11皮下注射治疗,1次/d,连续应用。每日检查血常规,直至血小板计数≥100×109/L时停药。当两组患者血小板计数<50×109/L时即停止全脑全脊髓放射治疗;当血小板计数<20×109/L并有出血倾向时,或血小板计数<10×109/L时,给予浓缩血小板悬液输注治疗,每次输注血小板l U。患者出血症状改善或血小板计数>20×109/L,则停止血小板输注。放射治疗同时若出现白细胞计数减少,则及时给予重组人粒细胞刺激因子治疗以保证放射治疗不因白细胞计数减少而停止。
1.3 观察方法
试验开始前1周内对患者进行全面体检,观察期间隔日查血常规,观察白细胞及血小板计数的变化。放射治疗前、治疗中及治疗结束后分别进行胸透、心电图、肝肾功能及凝血功能检查。
1.4 临床反应评价
比较A、B两组患者血小板最低值、血小板减少症的持续时间、血小板减少的程度、放射治疗暂停的病例数及放射治疗所需的时间,分析rhIL-11对肝肾及凝血功能的影响,评价rhIL-11对髓母细胞瘤放射治疗引起的血小板减少症的疗效及不良反应。
1.5 统计学方法
采用SPSS l6.0进行统计学分析,计量资料用均数±标准差(x±s)表示,采用双因素方差分析进行组间均数比较,两两比较采用t检验,率的比较采用x2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 血小板的最低值
A、B两组患者血小板最低值分别为(68.9±24.3)×109/L和(33.5±19.6)×109/L,A组患者血小板最低值较B组患者平均升高105.7%,两组比较具有显著性差异。
2.2 血小板减少症的持续时间
A组患者Ⅰ、Ⅱ、Ⅲ及Ⅳ度血小板减少症的持续时间均较B组明显缩短,且具有显著性差异,见表1。
表1 A、B两组不同程度血小板减少症的持续时间(d,±s)
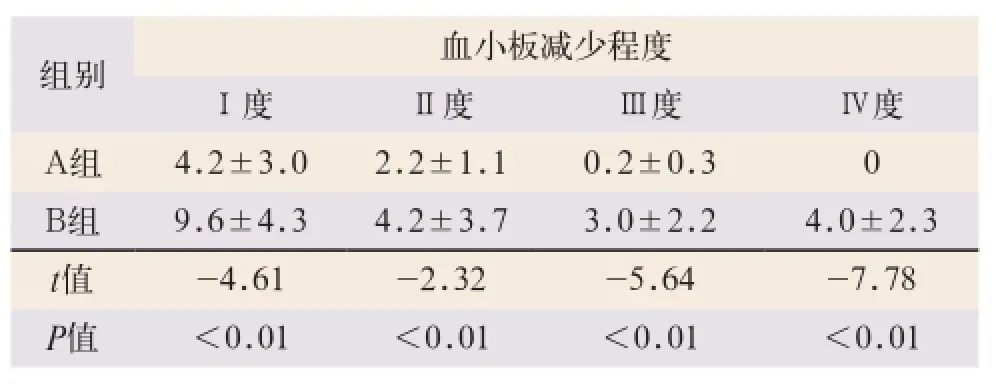
表1 A、B两组不同程度血小板减少症的持续时间(d,±s)
?
2.3 不同程度血小板减少的情况
A组患者Ⅰ、Ⅱ、Ⅲ及Ⅳ度血小板减少的例数均明显少于B组,且具有显著性差异,见表2。
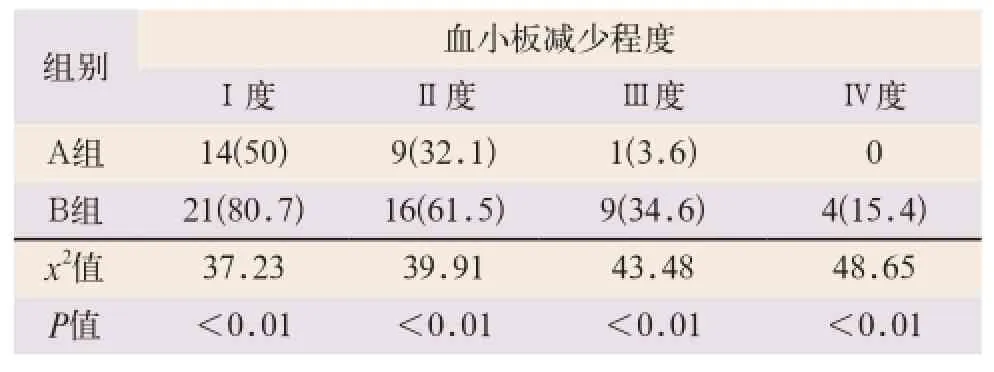
表2 A、B两组不同程度血小板减少的比较[例(%)]
2.4 放射治疗所需时间
A、B两组患者完成放射治疗所需时间分别为(43.6±1.8)d和(54.5±12.7)d,两组比较具有显著性差异。
2.5 不良反应
(1)主要不良反应为注射部位疼痛(占27.1%)、硬结(占19.8%)、红肿(占15.1%)、水肿(占7.9%)、乏力(占7.2%)以及心悸(占4.8%)等。以上不良反应多数在用药过程中自行缓解或消失,无需特殊处理,少数不良反应于停药后消失。
(2)双因素方差分析结果显示,放射治疗前、治疗中及治疗后血清GPT、γ-GT、BUN及Cr等,以及肝肾功能检查指标、PTs、PTa、PT(%)、FIB及APTT各项凝血功能指标均无明显改变,表明rhIL-11对肝肾及凝血功能无明显影响。
3 讨论
髓母细胞瘤好发于儿童中枢神经系统,是恶性程度最高的神经上皮性肿瘤之一,约占儿童颅内肿瘤的20%,多位于第四脑室顶上的小脑蚓部,生长极为迅速[1-3]。髓母细胞瘤对放化疗十分敏感,目前的标准治疗为最大限度的手术切除,辅以全脑全脊髓放射治疗30~36 Gy后瘤床局部加量至50~54 Gy;而后辅助全身化疗4~6周期。接受标准治疗的髓母细胞瘤患者的5年生存率和无进展生存率分别提高至60%~80%和50%~80%[4-7]。全脑全脊髓放射治疗的照射范围广,尤其是将含有大量骨髓造血组织的椎体包括其中,故髓母细胞瘤患者在放射治疗过程中极易出现白细胞和血小板减少。临床治疗中发现,白细胞下降后可应用重组人粒细胞刺激因子来迅速提升白细胞而不至于影响放射治疗的进程,而当血小板下降后,应用目前效果最佳的药物(如rhIL-11或重组人血小板生成素)来提升血小板往往需要很长的时间(约7~10 d),势必延长了放射治疗的时间。
众所周知,在总剂量不变的情况下,延长放射治疗的总疗程时间可以降低放射效应,影响放射治疗的效果[8]。严重血小板减少患者还需要输注血小板,有可能增加血源性感染乙型肝炎、丙型肝炎和艾滋病的危险;更有甚者会导致患者自发性颅内出血危及生命。
rhIL-11是一种促血小板生长因子,直接刺激造血干细胞和巨核系祖细胞的增殖,诱导巨核细胞的成熟分化,促进巨核细胞和血小板生成,增加体内血小板计数并保持其功能。近年的研究表明,使用rhIL-11在治疗血小板减少症方面发挥了重要作用,可以降低放化疗引起的血小板减少的风险并减轻其严重程度,缩短血小板减少症的病程[9]。为了了解rhIL-11在髓母细胞瘤患者放射治疗中对于预防血小板减少症的疗效和不良反应,本研究采用随机对照试验进行临床研究,结果发现,A组的髓母细胞瘤放射治疗中血小板最低值明显高于B组,输注血小板的次数明显少于B组,其Ⅰ、Ⅱ、Ⅲ及Ⅳ度血小板减少的持续时间也明显短于B组,由于血小板减少而被迫暂停放射治疗的病例数明显少于B组,因此A组完成放射治疗所需的时间明显短于B组。
本研究结果表明,在髓母细胞瘤患者放射治疗中预防应用rhIL-11不仅能显著降低血小板减少症的发生率,缩短其持续时间,同时又有较长时间的后续升血小板作用,表明rhIL-11具有明显的防治放射治疗所致的血小板减少的作用。本研究显示,rhIL-11可与放射治疗同时应用,而不必在放射治疗暂停后进行,这一点不同于化疗。rhIL-11的主要不良反应为注射部位疼痛、硬结、红肿、结膜充血、水肿、心悸以及乏力等,与国外及国内报道相似[10-13]。其多数不良反应在用药过程中可自行缓解或消失,无需特殊处理。
[1]Rossi A,C aracciolo V,Russo G,et al.Medulloblastom a:from molecular pathology to therapy[J].Clin Cancer Res,2008,14(4):971-976.
[2]de Bont JM,Packer RJ,Michiels EM,et al. Biological background of pediatric medullo-blastoma and ependymoma:A review from a translational research perspective[J].Neurooncology,2008,10(6):1040-1060.
[3]Agerlin N,Gjerris F,Brincker H,et al.Childhood medulloblastoma in Denmark 1960-1984.A population-based retrospective study[J].Childs Nerv Syst,1999,15(1):29-36.
[4]Klesse LJ,Bowers DC.Childhood medulloblastoma:current status of biology and treatment[J].CNS D rugs,2010,24(4):285-301.
[5]Dunkel IJ,Gardner SL,Garvin JH Jr,et al.Highdose carboplatin, thiotepa,and etoposide with autologous stem cell rescue for patients with previously irradiated recurrent medulloblastoma[J]. Neuro-oncology,2010,12(3):297-303.
[6]Lafay-Cousin L,Bouffet E,Hawkins C,et al. Impact of radiation avoidance on survival and neurocognitive outcome in infant medulloblastoma[J].Curr Oncol,2009,16(6):21-28. [7]Brandes AA,Franceschi E,Tosoni A,et al. Long-term results of a prospective study on the treatment of medulloblastoma in adults[J]. Cancer,2007,110(9):2035-2041.
[8]殷蔚伯,余子豪,徐国镇,等.肿瘤放射治疗学[M].北京:中国协和医科大学出版社,2007:1350-1352.
[9]Wu S,Zhang Y,Xu L,et al.Multicenter, randomized study of genetically modified recombinant human interleukin-11 to prevent chemotherapy-induced thrombocytopenia in cancer patients receiving chemotherapy[J]. Support Care Cancer,2012,20(8):1875-1884.
[10]储大同,徐兵河,宋三泰,等.重组人白细胞介素-11预防化疗所致血小板减少的临床研究[J].中华肿瘤杂志,2003,25(3):272-274.
[11]Tepler I,Elias L,Smith JW,et al.A randomized placebo-controlled trial of recombinant human intrleukin-11 in cancer patients with severe thrombocytopenia due to chemotherapy[J]. Blood,1996,87(9):3607-3614.
[12]Isaacs C,Robert NJ,Bailey FA,et al.Randomized placebo-controlled study of recombinant human interleukin-11 to prevent chemotherapy induced thrombocytopenia in patients with breast cancer receiving doseintensive cyclophosphamide and doxorubicin[J].J Clin Oncol,1997,15(11):3368-3377.
[13]GordonMS,McCaskil-l Stevens WJ,Bat tiato LA,et al.A phase I trial of recombinant human interleukin-11(neumega rhIL-11 growth factor)in women with breast cancer receiving chemotherapy[J].Blood,1996,87(9):3615-3624.
Clinical research on rhIL-11 application in preventing thrombocytopenia induced by postoperative radiotherapy of medulloblastoma
FANG Heng-hu, KANG Jing-bo, ZHAO Xiang-fei, et al//
China Medical Equipment,2014,11(11):104-107.
Objective: The efficacy and adverse effect of rhIL-11, which is applied to prevent thrombocytopenia induced by postoperative radio therapy of medullablastoma is assessed. Methods: Enrolled patients are divided into two groups of A as well as B in accordance with randomized controlling method. As long as platelet count fell down to the level of less than 100×109/L or that basement drop surpassed 50% compared with pre-radiotherapy, patients of group A were continuously medicated rhIL-11 in the manner of subcutaneous injection once per-day by dosage of 50 μg•kg-1•d-1, before platelet count elevated more than 200×109/L. Without prophylactic rhIL-11 medication, patients of group B were continuously treated with rhIL-11 in the manner of subcutaneous injection once per-day by dosage of 50 μg•kg-1•d-1so long as platelet count decreased less than 50×109/L, until it was enhanced to the level of more than 100×109/L. Results: There were 54 cases available to treatment efficacy evaluation, from which it was observed that rhIL-11 could significantly increase minimum platelet count in the setting of postoperative radiotherapy of medulloblastoma, significantly shorten thrombocytopenia duration, significantly reduce platelet transfusion frequency, as well as significantly lessen radiotherapy time. Major adverse reaction includes: Injection site pain, nodular, swelling, edema, fatigue and palpitation, most of which were mild and absent of additional severe adverse reaction. Conclusion: The rhIL-11 contains apparent thrombopoietin effect, as well as obviously reduces thrombocytopenia occurrence induced by postoperative radiotherapy of medulloblastoma so that it secures smooth procession of radiotherapy. The adverse reaction is moderate and undifficult to handle with.
Recombinant human interleukin-11; Thrombocytopenia; Prevention; Radiotherapy
10.3969/J.ISSN.1672-8270.2014.11.039
1672-8270(2014)11-0104-04
R816.3
A

方恒虎,男,(1979- ),硕士,主治医师。海军总医院肿瘤诊疗中心,从事肿瘤放化综合治疗。
2014-05-19
全军科技攻关项目(06G034)“中药与现代技术优化对恶性肿瘤的防治研究”①海军总医院肿瘤诊疗中心 北京 100048
*通讯作者:kjbnet@126.com
[First-author’s address]Department of Radiation Oncology, Navy General Hospital, Beijing 100048, China.
