肺表面活性物质联合高频振荡通气和吸入一氧化氮治疗新生儿重度呼吸衰竭的临床疗效研究
2014-02-08戴立英傅燕娜王琍琍
戴立英,傅燕娜,张 健,王琍琍
在新生儿重症监护室(NICU)中,大多数呼吸衰竭患儿通过积极的气道护理和常频机械通气后病情得到缓解,但也有部分严重呼吸衰竭患儿通过上述治疗仍不能恢复正常氧合,对于这部分患儿,可采用高级呼吸支持技术,如补充肺表面活性物质(PS)、高频振荡通气(HFOV)、吸入一氧化氮(iNO)、液体通气及体外膜肺氧合(ECMO)等。PS、HFOV、iNO操作较简单,成本也较低,近年来应用较多,但目前关于三者联合使用的研究报道较少。本研究将PS、HFOV、iNO联合应用于重度呼吸衰竭患儿的抢救,取得了较好效果,现报道如下。
1 对象与方法
1.1 研究对象 选择2011年2月—2013年8月安徽省儿童医院NICU收治的重度呼吸衰竭新生儿34例,均经常规呼吸支持治疗无效,其中男24例,女10例;平均胎龄(34.5±3.5)周;平均体质量(2 343.5±820.9)g;入院日龄1~24 h;原发病:新生儿呼吸窘迫综合征(respiratory distress syndrome,RDS)18例,胎粪吸入6例,肺炎及败血症5例(包括遗传代谢病3例),窒息4例,Wilson-Mikity综合征1例;合并症:气胸6例。重度呼吸衰竭诊断标准:常规机械通气4 h以上,吸入氧浓度(FiO2)>0.50时动脉血氧分压(PaO2)低于50 mm Hg(1 mm Hg=0.133 kPa),经皮测动脉血氧饱和度(TcSaO2)低于0.85和/或动脉肺泡氧分压比值(a/A)<0.22[1]。排除标准:严重多发畸形,机械通气不足24 h,严重先天性心脏病,有持续倾向。
1.2 方法
1.2.1 基础治疗 所有患儿先进行常频通气,采用同步间歇指令通气(SIMV)模式,当治疗无效或效果欠佳、达到重度呼吸衰竭诊断标准并征得患儿家属同意后采用PS、HFOV、iNO联合治疗,并继续予以基础治疗,包括保温、维持内环境稳定、营养支持、防治感染、应用多巴胺等心血管活性药物保证心血管功能稳定等。
1.2.2 PS的应用 所有患儿在上机1 d内开始应用PS,选用意大利Chiesi制药有限公司制造的猪肺表面活性物质(固尔苏),首次剂量为150~200 mg/kg,根据病情重复给药1~3次,给药间隔为6~12 h,最多给药3次;通过无菌鼻饲管经气管插管伸入到插管边缘下,在气管内滴入,每次滴注后气囊加压给氧1~2 min,给药后禁止吸痰6 h。
1.2.3 HFOV的应用 采用Stephnie呼吸机高频振荡模式,实施肺复张策略,使右膈顶与第8、9后肋水平相当[2]。机械通气超过7 d或发生肺气漏(PAL)时,经皮血氧饱和度(SPO2)稳定时右膈顶可以维持在第7、8后肋水平,调节平均气道压(MAP)至肺复张,频率为9~12 Hz,调节FiO2使SPO2达到目标水平,震荡幅度为看到胸部有较明显的振动,适当调节频率,使二氧化碳分压(PaCO2)维持在目标水平。目标血气值:SPO2为88%~95%,PaCO2为35~50 mm Hg。机械通气超过7 d或合并支气管发育不良(BPD)、PAL时,PaCO2容许升至65 mm Hg,但需保持血pH值>7.2。患儿氧合指标降低时则提高FiO2,每次0.05~0.10。患儿发生二氧化碳潴留时则调高振幅,每次5 cm H2O(1 cm H2O=0.098 kPa),保持PaCO2在允许范围。患儿病情好转后首先逐渐降低FiO2至0.40左右,然后缓慢降低MAP(≤8 cm H2O,PAL患儿先降MAP)。经应用HFOV后无自主呼吸抑制的患儿直接拔管撤机,自主呼吸较弱者采用常频通气(SIMV模式),拔管后予以经鼻持续气道正压通气。
1.2.4 iNO的应用 所有患儿同时应用iNO,一氧化氮(NO)由上海诺芬生物技术有限公司提供,采用专用质量流量控制仪(复旦大学呼吸急救实验室研制)接入呼吸机供气管道,同时在近患儿呼吸道端Y形接口处连接NO/二氧化氧(NO2)浓度监测仪(Bedfont公司,英国),监测呼吸道NO及NO2浓度。iNO的初始浓度为10 ppm,吸入1 h后行动脉血气分析检查,ΔPO2>10~20 mm Hg或SPO2上升至88%以上,则NO剂量维持不变,若ΔPO2<10 mm Hg则逐渐上调NO剂量,直至PO2或SPO2达标,NO剂量最高不超过80 ppm。患儿病情好转后每隔6~12 h下调NO剂量3~5 ppm,降至3 ppm时可停止iNO,继续基础治疗。
1.3 观察指标 (1)观察所有患儿治疗前及治疗后1、6、24 h动脉血气指标、呼吸功能指标,前者包括pH值、PaO2、PaCO2;后者包括FiO2、MAP、氧合指数(OI)、a/A,其中OI=100×MAP×FiO2/PaO2,a/A=PaO2/(713×FiO2-PaCO2/0.8)。(2)观察NO有效剂量,应用MASIMO脉氧仪监测高铁血红蛋白水平,定期监测血小板功能及凝血功能。(3)PS、HFOV、iNO联合治疗1 h后拍摄胸部X线片以了解肺复张程度,以后每天至少1次拍摄胸部X线片直至撤机,必要时随时拍摄胸部X线片。(4)记录气胸及呼吸机相关肺炎(VAP)发生情况;在患儿出生后3~7 d进行颅脑B超及心脏彩超检查,观察脑白质软化及重度脑室出血发生情况,计算患儿存活率。
2 结果
2.1 动脉血气指标 本组患儿治疗前及治疗后1、6、24 h的pH值、PaO2、PaCO2比较,差异均有统计学意义(P<0.05);治疗后1、6、24 h的pH值、PaO2大于治疗前,PaCO2小于治疗前,差异均有统计学意义(P<0.05,见表1)。
2.2 呼吸功能指标 本组患儿治疗前及治疗后1、6、24 h的FiO2、MAP、OI、a/A比较,差异均有统计学意义(P<0.05);治疗后1、6、24 h的FiO2、OI及治疗后6、24 h的MAP小于治疗前,治疗后1、6、24 h的a/A大于治疗前,差异均有统计学意义(P<0.05,见表2)。

Table1 Comparison of arterial blood gas parameters in infants with severe respiratory failure before and after treatment

时间pH值PaO2(mmHg)PaCO2(mmHg)治疗前7 10±0 1837 38±5 4766 62±9 62治疗后1h7 36±0 05∗56 26±2 93∗53 08±6 93∗治疗后6h7 37±0 04∗60 68±5 35∗46 55±5 12∗治疗后24h7 36±0 04∗64 93±8 38∗45 78±6 06∗F值52 45965 12122 088P值0 0000 0000 000
注:与治疗前比较,*P<0.01;PaO2=动脉血氧分压,PaCO2=二氧化碳分压

Table2 Comparison of respiratory function parameters in infants with severe respiratory failure before and after treatment
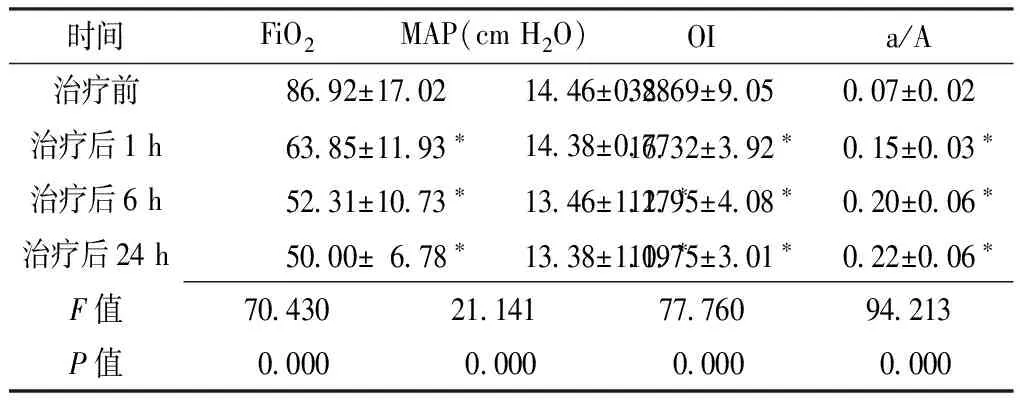
时间FiO2MAP(cmH2O)OIa/A治疗前86 92±17 0214 46±0 8832 69±9 050 07±0 02治疗后1h63 85±11 93∗14 38±0 7716 32±3 92∗0 15±0 03∗治疗后6h52 31±10 73∗13 46±1 27∗11 95±4 08∗0 20±0 06∗治疗后24h50 00±6 78∗13 38±1 19∗10 75±3 01∗0 22±0 06∗F值70 43021 14177 76094 213P值0 0000 0000 0000 000
注:与治疗前比较,*P<0.01;FiO2=吸入氧浓度,MAP=平均气道压,OI=氧合指数,a/A=动脉肺泡氧分压比值
2.3 转归及并发症情况 本组患儿平均iNO有效浓度为(10.4±2.3)ppm,平均iNO时间为(42.5±8.9)h;治愈 25例,9例因病情危重家属放弃治疗而死亡。6例患儿血小板计数有下降趋势(3例为遗传代谢病合并感染,存在顽固性血小板计数下降);所有患儿治疗期间监测的高铁血红蛋白水平均小于1.5%。并发症:1例并发气胸,6例经心脏彩超检查证实持续性肺动脉高压(治疗3 d后降至正常),VAP 6例,脑室旁白质软化3例,重度脑室出血3例。
3 讨论
新生儿呼吸衰竭(neonatal respiratory failure,NRF)是导致新生儿死亡的重要原因,是NICU最常见的危重症。2008—2009年,我国NICU的NRF发生率为19.7%(6 864/35 817)[3],但缺失重度呼吸衰竭发病率的统计。Clark[4]研究发现,胎龄≥34周的NRF患儿最常见的病因为RDS,其次为胎粪吸入综合征(MAS)、肺炎/败血症及湿肺,胎龄越小,RDS发生率越高,总体死亡率为5%(51/1 011)。我国进行的3次NRF多中心流行病学调查结果显示,呼吸系统疾病是NRF最常见的病因,其中RDS最为常见,其他病因包括新生儿缺氧缺血性脑病、原发性或继发性肺动脉高压及各种先天性畸形(如先天性心脏病、先天性肺发育不良及21-三体综合征等),总体死亡率为32%(553/1 722)[5]。本组患儿中共发现18例新生儿RDS,发生率为53%(18/34)。
近20年来研究表明,常频机械通气及PS用于治疗新生儿重度呼吸衰竭取得了显著疗效,但仍有部分患儿经常频机械通气及PS治疗后仍不能缓解缺氧症状,究其原因为:原发病严重、PS消耗导致肺萎陷、炎性介质释放等使常频机械通气造成的气压伤、容量伤及剪切伤加重肺损伤,加之患儿内源性NO分泌减少,肺动脉痉挛而导致肺动脉高压。因此,部分重度呼吸衰竭患儿采用常频机械通气及PS治疗效果不佳[6-7]。PS缺乏是导致新生儿急性呼吸系统疾病及新生儿死亡的重要原因,补充PS是预防及治疗早产儿RDS的标准方案,可提高早产儿成活率。对于MAS、重症感染、肺出血等肺部疾病引起的继发性PS减少及PS活性抑制,补充PS后肺泡立即扩张,肺顺应性改善,氧合好转,可大幅度改善机械通气参数。因此,PS替代疗法已成为治疗新生儿严重肺部疾病的有效手段之一,能明显降低NRF患儿病死率[8]。
临床上常将HFOV作为常频机械通气治疗失败的补救性措施,但对于难治性NRF,如先天性膈疝或合并肺动脉高压的严重低氧性呼吸衰竭患儿,HFOV较常频机械通气更为有效[9]。HFOV能够柔和地增加早产儿肺容积,保证肺复张,并募集更多肺泡参加气体交换,保证肺泡扩张,使肺内气体均匀分布,清除二氧化碳,改善氧合,从而减少肺损伤[10-11]。Miedema等[10]研究证实,发生RDS的早产儿常需要人工复苏且更容易合并PS缺乏,在应用常频机械通气治疗的短期内即可导致肺损伤,因此,其认为应早期应用HFOV以避免早产儿肺损伤的发生。Gerstmann等[12]进行了一项多中心研究,并与常频机械通气进行比较,结果显示早期应用HFOV可减少PS使用次数,更好地发挥PS的生物学效应,并减少ECMO的使用,增加患者存活率,减少慢性肺部疾病的发生。本组患儿中,合并气胸的6例患儿均获痊愈,得益于行HFOV时气道压比较稳定,且经过气道传递衰减,终末气道压较小,最大限度地保护了患儿肺脏,避免了气压伤的发生;1例患儿治疗过程中发生气胸,后经尸检证实为Wilson-Mikity综合征,分析其气胸的发生与肺发育极不成熟有关。
NO作为一种选择性肺血管舒张剂,可选择性地降低肺动脉压力,改善通气/血流(V/Q)比值及氧合。2008年,我国学者进行的一项多中心研究表明,对于低氧性呼吸衰竭(OI>15)足月儿及近足月儿,iNO能有效改善其氧合,可用于治疗新生儿低氧性呼吸衰竭[13]。本院于2007年引进iNO技术,在治疗难治性呼吸衰竭方面积累了一些经验,进行的临床研究亦证实iNO联用PS效果确切[14]。近年来,iNO在早产儿中的应用逐渐增加,研究表明,iNO可通过抑制核因子κB介导的促炎性介质释放过程,减少中性粒细胞在肺内的聚集,减轻肺部炎症,增加肺泡增殖修复,抑制肺纤维化,并可改善PS的功能[15-16]。
目前,关于PS、HFOV、iNO中的两种联合用于治疗新生儿重度呼吸衰竭的报道较多,并证实其较单独应用其中1种具有明显优势,但关于三者联合应用的报道则较为少见。本研究结果显示,本组患儿治疗后1、6、24 h的pH值、PaO2大于治疗前,PaCO2小于治疗前;治疗后1、6、24 h的FiO2、OI及治疗后6、24 h的MAP小于治疗前,治疗后1、6、24 h的a/A大于治疗前,表明联合应用PS、HFOV、iNO可以改善重度呼吸衰竭新生儿的动脉血气指标和呼吸功能指标,改善其氧合,有一定的推广应用价值。目前的HFOV多采用高肺容量策略及肺复张策略,可使肺泡充分均一地扩展及更多的肺泡扩张,减少高气道压引起的肺损伤,有利于气体交换;与PS联合应用可使PS在肺内的分布更加均匀,减少了PS的消耗,有助于其发挥更大的生物学效能。NO能选择性地扩张肺血管,但难以到达肺通气不良部位,而该部位的血管痉挛可导致肺内分流,引起继发性肺高压,患儿临床表现为严重低氧血症,严重危及患儿生命;与PS及HFOV联合应用,能有效地改善肺泡通气,增加肺血流,使V/Q比值更趋合理,有助于改善氧合,具有协同作用。
本组患儿平均iNO有效浓度为(10.4±2.3)ppm,平均iNO时间为(42.5±8.9)h,治愈 25例,9例因病情危重放弃治疗而死亡。在治疗过程中,有2例患儿iNO有效剂量一度达到80 ppm,分析其原因与应用HFOV时MAP的控制相对保守有关,后经2次调整MAP使肺处于开放状态后,其NO吸入浓度迅速降至10 ppm以下,均在3 d后停用NO。9例死亡患儿虽经联合应用PS、HFOV、iNO后氧合均有一定程度改善,但2例患儿因重度缺氧缺血性脑病治疗4 d后,家长放弃治疗;2例重度RDS患儿发生呼吸机参数上调及Ⅲ度以上脑室出血,需重复应用PS,家长放弃治疗;3例患儿发生肺出血,后证实为遗传代谢病;1例患儿因感染严重而并发败血症、多脏器功能衰竭而死亡,血培养铜绿不动杆菌阳性,免疫功能低下;1例患儿尸检证实为重度Wilson-Mikity综合征,其胎龄为27周,治疗9 d后因多发PAL而死亡,分析其死因与肺发育极不成熟有关。6例经心脏彩超检查证实的持续性肺动脉高压患儿治疗3 d后降至正常,提示对于严重肺实质病变所致的持续性肺动脉高压,先用PS替代治疗改善肺顺应性,再经HFOV治疗持续稳定肺容量并加强肺严重病变区域NO的递送,可以更好地发挥NO的生物学效应。本组患儿中有20例为早产儿,均治疗有效,且未见BPD患儿,可能与本组患儿孕周较大有关。
值得注意的是,联合应用PS、HFOV、iNO时,仍需强调PS的早期足量使用,本组患儿中有5例出生后6 h即开始联合应用PS、HFOV、iNO,治疗过程较为顺利,但因分层病例数偏少而未能进行统计学分析。新生儿重度呼吸衰竭病情极其危重,本研究因临床限制也未能设置对照以进一步分析PS、HFOV、iNO联合应用的有效性和安全性,其较单独应用其中1种或两种的优势还有待于进一步深入研究。总之,联合应用PS、HFOV、iNO治疗新生儿重度呼吸衰竭可以改善其动脉血气指标和呼吸功能指标,改善其氧合,有利于降低病死率。此外,联合应用PS、HFOV、iNO的经济成本较高,不可避免地增加了患儿家属的负担,且大多数基层医院尚未普及HFOV和iNO,其对医护人员的操作技术要求也较高,因此,在临床工作中要严格把握适应证,防止过度治疗,有条件的医院应建议患儿家属联合应用PS、HFOV、iNO,以最大限度地挽救重度呼吸衰竭患儿的生命,减少并发症的发生,降低新生儿死亡率。
1 周晓光,肖听,容绍汉.新生儿机械通气治疗学[M].北京:人民卫生出版社,2004:84-85.
2 Eichenwald EC.High frequency oscillatory ventilation:Is equivalence with conventional mechanical ventilation enough?[J].Arch Dis Child Fetal Neonatal Ed,2006,91(5):F315-F317.
3 Wang H,Gao X,Liu C,et al.Morbidity and mortality of neonatal respiratory failure in China:Surfactant treatment in very immature infants[J].Pediatrics,2012,129(3):e731-e740.
4 Clark RC.The epidemiology of respiratory failure in neonates born at an estimated gestational age of 34 weeks or more[J].J Perinatol,2005,25(4):251-257.
5 Hamon I,Fresson J,Nicolas MB,et al.Early inhaled nitric oxide improves oxidative balance in very preterm infants[J].Pediatr Res,2005,57(5 Pt 1):637-643.
6 谢桂芬,邵肖梅,孙波,等.新生儿呼吸衰竭尿NO2/NO3、肺功能变化及其临床意义[J].小儿急救医学,1998,5(2):71-73.
7 Stevens TP,Harrington EW,Blennow M,et al.Early surfactant administration with brief ventilation vs.selective surfactant and continued mechanical ventilation for preterm infants with or at risk for respiratory distress syndrome[J].Cochrane Database Syst Rev,2007(4):CD00306.
8 Konduri GG,Vohr B,Robertson C,et al.Early inhaled nitric oxide therapy for term and near-term newborn infants with respiratory failure:neurondevelopmental follow-up[J].Pediatrics,2007,150(3):235-240.
9 Tingay DG,Mills JF,Morley CJ,et al.Trends in use and outcomes of newborn infants treated with high frequency ventilation in Australia and New Zealand,1996—2003[J].Pediatric Child Heath,2007,43(3):160-166.
10 Miedema M,de Jongh FH,Frerichs I,et al.Changes in lung volume and ventilation during lung recruitment in high frequency ventilated preterm infants with respiratory distress syndrome[J].J Pediatr,2011,159(2):199-205.
11 Cools F,Henderson-Smart DJ,Offringa M,et al.Elective high frequency oscillatory ventilation versus conventional ventilation for acute pulmonary dysfunction in preterm infants[J].Cochrane Database Syst Rev,2009(3):CD000104.
12 Gerstmann DR,Minton D,Stoddard RA,et al.The Provo multicenter early high frequency oscillatory ventilation trial:Improved pulmonary and clinical outcome in respiratory distress syndrome[J].Pediatrics,1996,98(6 Pt 1):1044-1057.
13 Wang YF,Liu CQ,Gao XR,et al.Collaborative Study Group for Neonatal Respiratory Diseases.Effects of inhaled nitric oxide in neonatal hypoxemia respiratory failure from a multicenter controlled trial[J].Chin Med J(Engl),2011,124(8):1156-1163.
14 程欢欢,张健,傅燕娜.一氧化氮吸入联合肺表面活性物质治疗新生儿难治性呼吸衰竭的疗效分析[J].中国医药导报,2013,10(16):84-86.
15 Hamon I,Fresson J,Nicolas MB,et al.Early inhaled nitric oxide improves oxidative balance in very preterm infants[J].Pediatr Res,2005,57(5 Pt 1):637-643.
16 Lin YJ,Markham NE,Balasubramaniam V,et al.Inhaled nitric oxide enhances distal lung growth after exposure to hyperoxia in neonatal rats[J].Pediatr Res,2005,58(1):22-29.
