病毒感染患者的淋巴细胞及单核细胞VCS参数与异型淋巴细胞的临床特点研究
2014-02-06深圳市南山区西丽人民医院第一门诊部检验科518000
黄 黎(深圳市南山区西丽人民医院第一门诊部检验科 518000)
在健康人群中,异型淋巴细胞是极为少见的,但异型淋巴细胞在病毒感染患者中却比较常见[1]。健康人若受到病毒的感染,其体内的异型淋巴细胞就会有增多的迹象,但是增高的幅度一般采用0.05作为分界点,当增高的比例幅度高于0.05的时候,则具有临床意义,当增高的比例幅度低于0.05的时候,则没有临床意义。而当增高的比例幅度高于0.1的时候,则临床的诊断具有价值性。本次研究采用来2010年10月至2012年12月进行诊治的120例病毒感染患者为研究对象,对其淋巴细胞、单核细胞VCS参数与异型淋巴细胞的临床特点进行了研究,现报道如下。
1 资料与方法
1.1 一般资料 本次研究采用2010年10月至2012年12月来本院就诊的病毒感染患者120例为研究对象,其中男59例(49.2%),女61例(50.8%);患者年龄8个月至19岁,平均年龄(10.3±1.2)岁。将这120例病毒感染患者又根据异型淋巴细胞的增加程度不同分为3个组。异型淋巴细胞增加Ⅰ组:32例(26.7%),异型淋巴细胞增高的比例幅度介于2%~5%;异型淋巴细胞增加Ⅱ组:64例(53.3%),异型淋巴细胞增高的比例幅度介于5%~10%;异型淋巴细胞增加Ⅲ组:24例(20%),异型淋巴细胞增高的比例幅度大于10%。同时选取同期来本院体检的健康同龄人120例作为健康对照组,其中男61例(50.8%),女59例(49.2%);年龄7个月至20岁,平均年龄(10.2±1.9)岁。两组在年龄、性别上差异均无统计学意义(P>0.05)。
1.2 仪器与试剂 Beckman-Coulter LH750型的血液分析仪及其配套的试剂、以及实验过程中所需要的定标液和用来作为基准校正的校准液,产自美国贝克曼-库尔特公司;ABX-DX-120的血球分析仪。
1.3 方法 对所有病毒感染患者和健康对照组进行血常规的检测,检测前先进行血液的采样,采集患者乙胺四乙酸二钾(EDTA-K2)外周血2mL,1h之内采用ABX-DX-120的血球分析仪对异型淋巴细胞进行检测,同时进行白细胞VCS参数的分析。分析所有病毒感染者和健康对照组的淋巴细胞平均体积(MLV)、淋巴细胞体积的分布宽度(LDW)、淋巴细胞平均高频传导(MLC)、淋巴细胞平均VCS(MLS)、单核细胞平均体积(MMV)、单核细胞体积分布宽度(MDW)、单核细胞平均高频传导(MMC)、单核细胞平均VCS(MMS)。本次研究的检测方法,均严格依Beckman-Coulter LH750型的血液分析仪和ABX-DX-120的血球分析仪的操作步骤进行操作。
1.4 统计学处理 采用SPSS19.0软件进行统计分析,计量数据用x±s表示,组间比较采用t检验,率的比较采用χ2检验,以P<0.05为差异具有统计学意义。
2 结 果
2.1 病毒感染患者与健康对照组淋巴细胞的VCS参数情况 见表1。从表1中可见,淋巴细胞的MLV、LDW、MLC呈现出健康对照组低于异型淋巴细胞增加Ⅰ组低于异型淋巴细胞增加Ⅱ组低于异型淋巴细胞增加Ⅲ组的趋势,而MLS却表现为健康对照组高于异型淋巴细胞增加Ⅰ组高于异型淋巴细胞增加Ⅱ组高于异型淋巴细胞增加Ⅲ组,出现了与前面三者相反的趋势。
2.2 病毒感染患者与健康对照组的单核细胞VCS参数情况 见表2。从表2中可见,单核细胞的MMV、MDW、MMC呈现出健康对照组低于异型淋巴细胞增加Ⅰ组低于异型淋巴细胞增加Ⅱ组低于异型淋巴细胞增加Ⅲ组的趋势,而MMS却表现为健康对照组高于异型淋巴细胞增加Ⅰ组高于异型淋巴细胞增加Ⅱ组高于异型淋巴细胞增加Ⅲ组,出现了与前面三者相反的趋势。
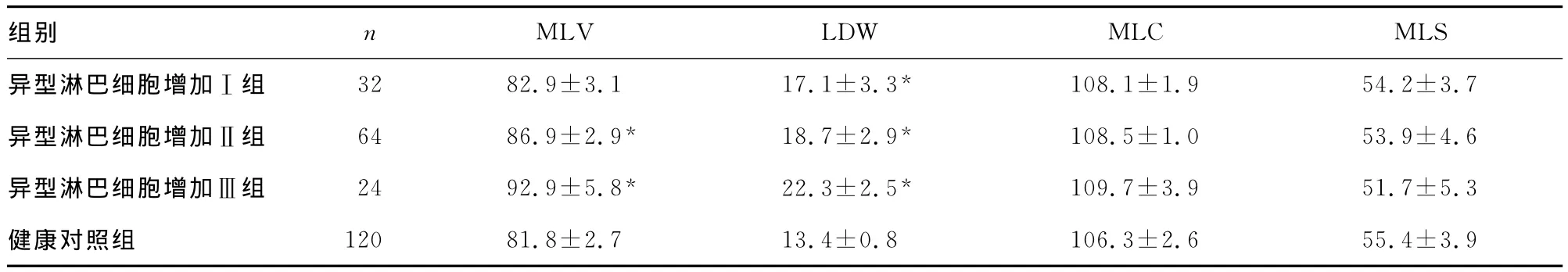
表1 病毒感染患者与健康对照组淋巴细胞的VCS参数情况(x±s)
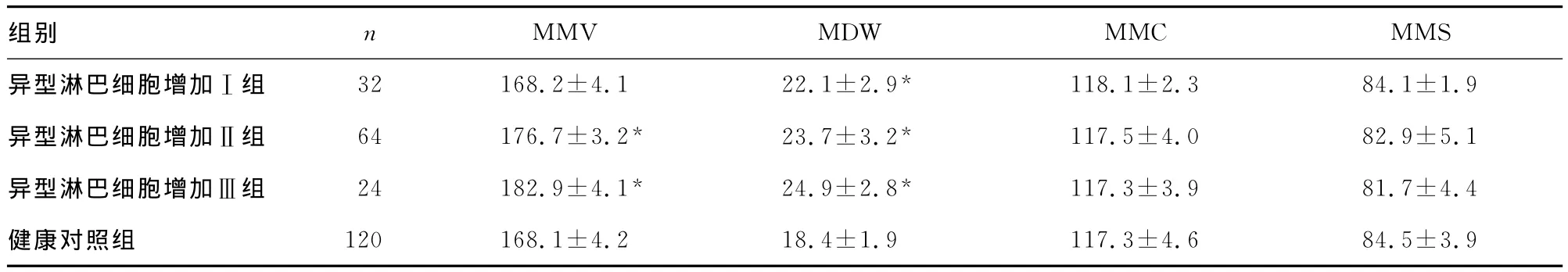
表2 病毒感染患者与健康对照组的单核细胞VCS参数情况(x±s)
3 讨 论
异型淋巴细胞又被叫做非典型淋巴细胞、传染性单核细胞等,异型淋巴细胞的细胞体和细胞核相对较大,它的细胞质具有很强的嗜碱性,同时异型淋巴细胞的染色质也不紧凑,相反还比较疏松,有的异型淋巴细胞中还会出现模糊的细胞核仁或者发生核分裂的现象。有学者采用胸腺嘧啶标记技术对异型淋巴细胞进行了观察,结果显示当异型淋巴细胞处于细胞S期(即细胞间期,DNA合成期),在显微镜高倍镜下可以看到异型淋巴细胞的细胞质内存在着不少的核糖体和正在扩张的内质网。许多研究发现,异型淋巴细胞的增高与病毒感染以及病毒的变态有着很大的关系[2]。
白细胞VCS参数能对细胞的形态变化进行充分的表达和描述,病毒性感染患者的淋巴细胞不论是在数量上,还是在形态上都有着很大的变化,同时他们血常规淋巴细胞的VCS参数也与之保持一定的趋势[3-4]。有研究发现,在病毒性感染患者中,由于淋巴细胞的免疫应答,使得其体内的T淋巴细胞受到激活,从而引出了异型淋巴细胞的产生[5]。另外还有研究发现,在病毒性感染患者中,其病毒抗原大多是在其胞质中产生,而这就是引起MLV、LDW变大的原因[6]。异型淋巴细胞类似于单核细胞[7-9],因而血液分析仪进行分析的时候,会把异型淋巴细胞当成单核细胞处理,因而导致了单核细胞的VCS参数随之变动。在本次研究中,根据异型淋巴细胞的增加程度不同分为3个组,结果表明,淋巴细胞的MLV、LDW、MLC呈现出对照组低于异型淋巴细胞增加Ⅰ组低于低于异型淋巴细胞增加Ⅱ组低于异型淋巴细胞增加Ⅲ组的趋势,而MLS却表现为对照组大于异型淋巴细胞增加Ⅰ组大于异型淋巴细胞增加Ⅱ组大于异型淋巴细胞增加Ⅲ组,出现了与前面三者相反的趋势。与此同时,单核细胞的MMV、MDW、MMC呈现出对照组低于异型淋巴细胞增加Ⅰ组低于异型淋巴细胞增加Ⅱ组低于异型淋巴细胞增加Ⅲ组的趋势,而MMS却表现为对照组大于异型淋巴细胞增加Ⅰ组大于异型淋巴细胞增加Ⅱ组大于异型淋巴细胞增加Ⅲ组,出现了与前面三者相反的趋势。这研究结果与其他研究结果相似[7-8]。另外,本次研究还发现,在诊断的敏感性上,淋巴细胞的LDW与单核细胞的MDW要优于淋巴细胞的MLV、MLC及单核细胞的MMV、MMC,而把这6个指标结合起来,研究效果更为准确。
在本次研究中,还发现异型淋巴细胞增加Ⅰ组、异型淋巴细胞增加Ⅱ组、异型淋巴细胞增加Ⅲ组中的淋巴细胞的MLS与单核细胞的MMS和健康对照组相比,差异无统计学意义(P>0.05),并且呈现出异型淋巴细胞增加Ⅰ组高于异型淋巴细胞增加Ⅱ组高于异型淋巴细胞增加Ⅲ组的趋势,分析其原因,可能与病毒性感染患者的病程及患者的病情有关[10-15]。另外,本次研究对象是采用了平均年龄为(10.3±1.2)岁的患者,鉴于不同的年龄阶段可能也存在有差别,因而对于其在成人中是何种规律,还有待进一步进行考察和研究。本次研究发现,病毒性感染患者的异性淋巴细胞增高与淋巴细胞、单核细胞VCS参数存在着一定的相关性,可以根据其相关性,为临床应用作出贡献。
[1]刘莹,曹军皓,容东宁,等.传染性单核细胞增多症异型淋巴细胞数量与EB病毒浓度的关系[J].实用医学杂志,2008,24(20):3582-3583.
[2]马倩.两种方法检测异型淋巴细胞结果比较[J].检验医学与临床,2011,8(15):1896-1899.
[3]陈贤,李珍宇,陈子荣.小儿外周血异型淋巴细胞检测的临床应用[J].临床和实验医学杂志,2009,16(5):57-59.
[4]刘莹,曹军皓,容东宁,等.传染性单核细胞增多症异型淋巴细胞数量与EB病毒浓度的关系[J].实用医学杂志,2010,20(37):78-81.
[5]邵平扬.传染性单核细胞增多症异型淋巴细胞免疫表型研究[J].浙江医学,2011,7(5):59-60.
[6]邱丽君,顾青,周少春.儿童传染性单核细胞增多症白细胞VCS参数变化的临床意义[J].现代检验医学杂志,2011,26(1):42-43.
[7]江咏梅,宋波,于丹.探讨儿童外周血异型淋巴细胞增多的病原学及临床动态变化特点[J].中国医药,2009,4(4):304-305.
[8]吴华军,王宇军,田俊华.外周血淋巴细胞、单核细胞VCS参数与异型淋巴细胞相关性研究[J].检验医学,2012,27(10):862-863.
[9]郑岚.外周血异型淋巴细胞检测的临床意义[J].中国当代医药,2012,6(1):70-71.
[10]王小林,苑腾,胡晓舟.LH750血液分析仪VCS数值判断异型淋巴细胞的实验研究[J].现代检验医学杂志,2009,24(3):85-86.
[11]马春芳,王剑超,王寅.淋巴细胞VCS参数在鉴别诊断病毒感染中的应用探讨[J].中国卫生检验杂志,2011,21(8):1974-1976.
[12]章小梅,刘勇,陆颖.外周血异型淋巴细胞的临床意义[J].检验医学与临床,2011,8(15):1882-1883.
[13]余文红,金叶,夏文权.XT-4000i血液分析仪检测异型淋巴细胞的实验研究[J].检验医学,2010,25(11):834-835.
[14]朱云波,夏小梅.197例儿童异型淋巴细胞的检测及临床病因分析[J].中国医学创新,2012,9(20):94-95.
[15]马学华,张萱,张娜,等.强直性脊柱炎患者外周血淋巴细胞亚群的检测及其临床意义[J].中国检验诊断学,2011,15(10):1765-1766.
