奥拉西坦/丁基苯酞对新生大鼠缺氧缺血性脑病的相关研究
2014-02-06穆国军李晓迪顾镜月李惠玲张伟东郭海涛
穆国军,李晓迪,顾镜月,李惠玲,张伟东,郭海涛
(佳木斯大学附属第一医院儿内一科,黑龙江 佳木斯 154003)
新生儿缺氧缺血性脑病(HIE),是指由乏氧引起大脑水肿、软化和坏死等一种病变,是新生儿期致残的主要病因[1~3]。而如何改善大脑微循环障碍及脑部水肿状态,保护大脑神经组织,控制惊厥,是防治本病的重要环节[4~6]。本实验首先通过建立新生大鼠缺氧缺血性脑病模型,联合应用神经保护剂—ORS及改善脑微循环障碍药物—NBP,并通过检测不同时间点各组动物大脑组织含水量、超氧化物歧化酶(SOD)含量及水通道蛋白-4(AQP-4)和环磷酸腺苷反应元件结合蛋白(CREB)表达情况证实药物的可靠叠加性效果。
1 材料与方法
1.1 实验动物
清洁级Wistar新生大鼠100只,雌雄不限,出生后7d(相当于人类新生儿期)。佳木斯大学动物实验中心提供。
1.2 主要试剂
SOD试剂盒(上海生工生物科技公司),ORS,NBP,AQP-4及CREB蛋白兔抗鼠多克隆抗体及二抗(Sigma 美国)。
1.3 制备动物模型
经乙醚麻醉后,取颈部正中切口,分离结扎左侧颈总动脉,放入含有8%氮气和2%氧气的密闭容器持续2h,制备成HIE模型。将出现左旋或夹尾左旋者纳入试验。
1.4 实验分组及给药
出生7d大鼠共分为4组,每组25只。正常组:分离左侧颈总动脉后在动脉下置线, 不结扎亦不低氧。模型组:制备大鼠HIE模型立即腹腔注射生理盐水0.1mL/只。对照组: 模型后立即腹腔注射ORS 100mg/kg,即12h,1d,3d,7d在HIE后即刻给药一次;实验组: 模型完成后立即腹腔注射ORS 100mg/kg,30min后腹腔注射丁基苯酞 10mg/kg,给药次数同对照组。
1.5 样品处理
按照不同时间点处死各组动物,大鼠经拉颈处死后迅速于冰上开颅分离脑组织,按不同检测目的分别储存大脑及部分脑干脊髓组织。
2 方法
2.1 脑组织含水量的测定
采用干湿质量法测定脑组织含水量。取各组等量脑组织滤纸吸干表面水分后电子天平称量湿重,再将组织置于80℃烘箱烤干测恒重,按Ellis公式,脑含水量=〔(湿重-干重)/湿重〕×100%计算含水量。
2.2 SOD活性测定
按SOD测定试剂盒说明检测大脑组织总超氧化物歧化酶活力(测吸光度值,从而计算匀浆组织的总SOD活力)。
2.3 免疫组化
取左脑组织,常规组织样品包埋及组织切片制备进行免疫组化检测。首先对组织载玻片进行脱蜡与复水处理。再将其入3%H2O2液中浸泡15min,经蒸馏水冲洗3min×1次,0.01M PBS液冲洗2min×3次,经抗原修复后,加入AQP-4及CREB蛋白兔抗鼠多克隆抗体,每张切片50μL。4℃冰箱过夜。0.01M PBS液冲洗2min×3次后滴加生物素化二抗每张切片50μL,湿盒37℃过夜后0.01M PBS液冲洗2min×3次,滴加S-A/HRP室温孵育15min。0.01M PBS液冲洗2min×3次后DAB显色。经复染、脱水透明后中性树胶封片,光镜下观察阳性细胞表达。
2.4 western blot检测
对各组样品进行组织总蛋白提取并定量。分别取等量总蛋白(25μg/孔)加上样缓冲液于沸水中煮5 min,以10%SDS-PAGE电泳分离。电泳完毕后将凝胶上的蛋白经湿转膜仪转至PVDF膜上,用含5%小牛血清白蛋白BSA的TBST溶液封闭2h,分别加入AQP-4及CREB蛋白兔抗鼠抗体,4℃孵育过夜,HRP标记的二抗室温孵育2h,ECL化学发光,X线显影,扫描。以GAPDH蛋白水平作为内参对照,实验重复3次。
2.5 统计学处理
采用SPSS13.0统计分析软件进行分析, 所得所有数据以均数±标准差表示,单因素方差分析进行两两比较,P<0.05为差异具有统计学意义。
3 结果
3.1 脑组织含水量
本实验采用湿重法检测脑组织含水量进以表示脑水肿程度。结果显示模型组12h即可出现脑水肿,而后呈上升趋势,3d后达到高峰,之后有下降,各时间点与空白组比较有差异性(P<0.05)。较模型组,实验组及对照组含水量明显下降,且实验组下降量高于对照组,同一时间点两两比较差异性有显著意义(P<0.05)。见表1。

表1 各组动物各时间点脑组织含水量测定
与空白组同时间点比较,差异具有统计学显著意义(P<0.05)。
3.2 脑组织SOD含量测定
显示模型组12h即可出现SOD下降趋势,而后持续下降,3d后达到高峰,各时间点与空白组比较有差异性(P<0.05)。较模型组,实验组及对照组SOD含量明显上升,且实验组高于对照组,同一时间点两两比较差异性有显著意义(P<0.05)。见表2。

表2 各组动物各时间点脑组织SOD含量测定
与空白组同时间点比较,差异具有统计学显著意义(P<0.05)。
3.3 免疫组化染色
3d时,空白组可见AQP-4呈弱阳性表达,各时间点无明显变化(图1A)。模型组各时间点与空白组比较染色较深,数量多(图1B),但各时间点免疫阳性细胞灰度值较空白组低,差异有统计意义(P<0.05)。与模型组比,实验组及对照组各时间点AQP-4灰度值均相对较低(图1C-1D),且实验组低于对照组,差异具有统计学意义(P<0.05)。CREB蛋白在空白组3d时呈高表达,模型组较空白组比较染色浅,数量少。与模型组比,实验组及对照组各时间点CREB蛋白灰度值均相对较高(图1C-1D),且实验组高于对照组,差异具有统计学意义(P<0.05)。
3.4 western blot检测
蛋白印迹显示说明模型组较空白组AQP-4蛋白表达水平明显上升,CREB蛋白蛋白表达明显下降,差异有显著性(P<0.05);实验组较模型组CREB蛋白表达水平明显升高,AQP-4蛋白表达下降,差异有显著意义(P<0.05);对照组AQP-4较模型组有下降,但高于实验组,实验组AQP-4蛋白表达高于对照组但接近空白组,差异具有显著性(P<0.05),见图2。
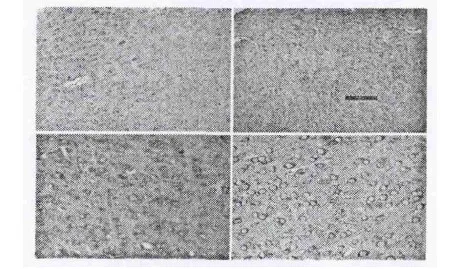
图1 3d时实验组免疫组化染色

图2 各组AQP-4及CREB蛋白在3d时蛋白表达情况
4 讨论
新生儿缺氧缺血性脑病以其高发病率及高致残率成为威胁人类健康的重要病变。它的发病因素主要指由围生期呼吸骤停及严重肺部感染所致的缺氧及严重系统疾病所致的缺血,发病机制涉及到血流动力学变化、脑细胞能量代谢衰竭、再灌注损伤及神经损伤。HIE发病机制复杂,是各种机制综合一起的连锁反应,大量研究证实多数神经元不是死于缺氧缺血时,而是死于缺血缺氧后数小时至数天,这种迟发型的细胞死亡是可以通过发病后的干预来预防及减轻病症的。
目前关于HIE的药物及方法主要集中在改善脑水肿和微循环障碍、消除自由基和保护大脑神经组织等方面。本实验首先进行了HIE模型的制备,然后选用神经保护剂药物ORS及改善脑微循环障碍药物—NBP,在试验中的联合运用中增加叠加效应,对大鼠的早期HIE的治疗起到了改善作用。通过对本实验中对大鼠分组用药后不同时间点的检测,可以发现与模型组比较,实验组的大脑含水量低于对照组,说明所选药物在改善脑水肿方面有比较好的改善作用。通过SOD活性含量的检测,也可以发现在本实验中实验组的SOD活性明显增加高于对照组,说明药物的联合运用在改善脑神经活性方面也有优势作用。目前国内外研究证实,AQP-4与脑水肿的形成有关系,本实验的研究中发现,模型组在缺氧缺血下AQP-4上调了其表达,在第3天达到高峰,这与脑组织水肿的发生与发展时间上基本一致,说明了AQP-4在脑水肿中有重要作用。国外有研究表明,AQP-4的表达的抑制,可避免神经胶质细胞过度肿胀,神经胶质细胞肿胀是由于再氧后水外排速度减慢所致,所以AQP-4对于缺氧缺血性脑病有双向的水介导的跨膜转运。环磷酸腺苷反应元件结合蛋白是脑缺血神经元存活心肌缺血或谷氨酸预处理后的一个重要媒介,谷氨酸NMDA受体门控钙离子内流和后续的CaMⅡ—Ⅳ的活化诱导CREB的磷酸化,细胞应激(例如缺血等)时磷酸化的CREB(phosphorylation of c-AMP response element binding protein,p-CREB)提供了神经保护性作用,因而重新评价兴奋性氨基酸拮抗剂的保护作用具有重要意义。本试验通过免疫组化及western blot检测发现AQP-4在HIE后12h表达既有升高,1d明显增强,3d后达高峰,与脑含水量变化一致,再次证实了AQP-4参与了HIE后脑水肿的形成,通过本实验药物的运用过程中发现,与模型组比较,实验组与对照组同时间点下AQP-4呈低表达,且实验组低于对照组,说明了药物在抑制早期HIE发病过程中具有明显意义,而CREB在实验组中的表达较模型组也比较明显,接近空白组,并结合这两种药物的保护神经组织作用及改善微循环的意义,说明了两种药物的叠加效应是有意义的。
通过本实验的研究证明,药物在HIE的治疗过程中显示了强大应用前景,在本实验HIE的治疗过程中,药物的作用可以下调AQP-4表达,减轻脑水肿,也初步显示了神经保护作用,为下一步研究工作奠定了基础,但是实验研究与临床应用存在一定差异,且由于时间关系本实验的应用剂量及周期未作进一步研究,希望在以后的研究中可以得到进一步深化。
[1]马美彩.高压氧治疗新生儿缺血缺氧性脑病的疗效观察[J].临床医药实践,2010,19(4B):463-464
[2]Conforti Andreoni C, Spreafico R, Qian HL.Uric acid-driven Th17 differentiation requires inflammasome-derived IL-1 and IL-18[J].J Immunol,2011, 187(11):5842-5850
[3]刘冬梅,王萍,卢海英,等. 高压氧治疗新生儿缺血缺氧性脑病的效果观察[J].中国伤残医学,2011,19(4):5-76
[4]虞人杰.新生儿缺氧缺血性脑病诊断与治疗的现状与新动向[J].中华儿科杂志,2005, 43(8):3
[5]Kutzing MK, Firestein BL.Altered uric acid levels and disease states[J].J Pharmacol Exp Ther,2008, 324(1):1-7
[6]顾镜月,邵巍.Rho激酶抑制剂盐酸法舒地尔对NF200在新生大鼠缺氧缺血性脑损伤中表达的影响[J].黑龙江医药科学,2014,37(1):5-6
