EPO促进胚胎神经干细胞向神经元分化的形态学研究*
2014-02-05袁丽丽马登殿孔佑华
袁丽丽 马登殿 孔佑华
(1济宁医学院基础学院,山东 济宁 272067;2济宁医学院附属医院,济宁 272029)
近些年,促红细胞生成素(erythropoietin,EPO)对中枢神经系统的保护作用[1]研究较多。本实验镜下取大鼠14d天胚胎脑皮质行体外培养,鉴定为神经干细胞(nerual stem cells,NSCs)之后培养基中加入不同浓度的EPO继续体外培养,观察NSCs向神经元方向分化的形态学表现。
1 材料与方法
1.1 实验材料
成年雌雄未经产SD大鼠晚8:00合笼,次日晨8:00查到精子者记为E0d。
悬浮培养基:DMEM/F12(1∶1,Hyclone),20 ng/mlEGF(Sigma),20 ng/mlbFGF(Sigma),2%B27(Gibco),100 u/ml青霉素,100 μg/ml链霉素。贴壁分化培养基:DMEM/F12(1∶1,Hyclone),10%FBS(杭州四季青),100u/ml青霉素,100 μg/ml链霉素。
1.2 方法
1.2.1NSCs培养和鉴定
1.2.1.1NSCs的分离和传代及自然分化 取孕14d(E14d)SD大鼠胚胎脑皮质,用袁丽丽等[2-3]培养方法先悬浮培养传代3次,第3代(P3)细胞悬浮培养7d,收集部分细胞离心后待做电镜标本,其余悬浮细胞移入涂有L-多聚赖氨酸包被盖玻片的24孔培养板中加入分化培养基。放入培养箱培养6~8h,随机选取培养板,将盖玻片固定,待行nestin免疫细胞化学染色。其余培养板继续行分化培养,7d后取出细胞爬片固定,待行神经胶质原纤维酸性蛋白(glia fibrillary acid protein,GFAP)、微管相关蛋白2(microtubule-associated protein 2,MAP2)免疫细胞化学染色。
1.2.1.2免疫细胞化学染色 Nestin、GFAP、MAP2进行免疫细胞化学染色[2]。
1.2.2EPO掺入实验
1.2.2.1分组 第3代NSCs悬浮及其后贴壁分化培养基中添加EPO,根据EPO终浓度0.5、5、50、500u/ml分为4个实验组,另设对照组(不加EPO)。培养方法同上。
1.2.2.2免疫荧光染色 NSCs爬片7d固定行MAP2免疫荧光染色[3]。后行激光共聚焦显微镜下观察并拍照。每组随机取4张盖玻片,每张400倍镜下随机选5个视野计数MAP2阳性细胞数及总细胞数,计算视野中MAP2阳性细胞百分率。实验重复3次。
1.3 统计学方法
采用SPSS11.5统计学软件处理数据,各组率的比较采用χ2检验。
2 结 果
2.1 神经干细胞鉴定
2.1.1倒置相差显微镜及电镜观察结果 分离E14d鼠胚脑皮质得到单细胞,台盼蓝活细胞计数>96%,在生长培养基中细胞悬浮生长。第5~7天,形成神经球,可传代。电镜观察细胞核大,细胞器很少,核质比较大。见图1。

图1 NSCs悬浮生长7d电镜照片(×60000)
2.1.2免疫细胞化学染色观察结果 免疫细胞化学染色结果显示,nestin在神经球内细胞胞浆呈阳性表达,细胞浆被染成棕褐色 ,见图2。

图2 神经球爬片6h,免疫细胞化学染色示神经球内细胞nestin表达阳性(×400)
分化培养7d,GFAP:在部分细胞胞浆及突起中呈阳性表达,被染成棕褐色,胞体较大、突起粗而短,见图3。MAP2:在部分细胞胞浆及突起中呈阳性表达,细胞胞浆及突起呈棕褐色,见图4。

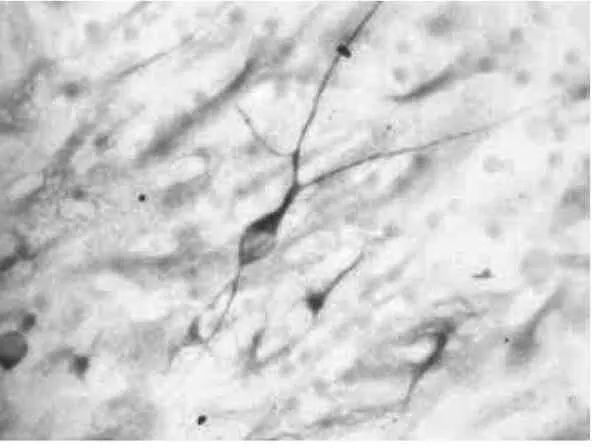
图3 神经球分化7d,免疫细胞化学染色示GFAP阳性细胞(×400)
图4 神经球分化7d,免疫细胞化学染色示MAP2阳性细胞(×400)
2.2 EPO掺入实验
2.2.1光镜观察 加入EPO分化培养,细胞透亮,折光较好,见图5,部分细胞伸出的突起细而长,随时间进行细胞突起形成复杂的网络。
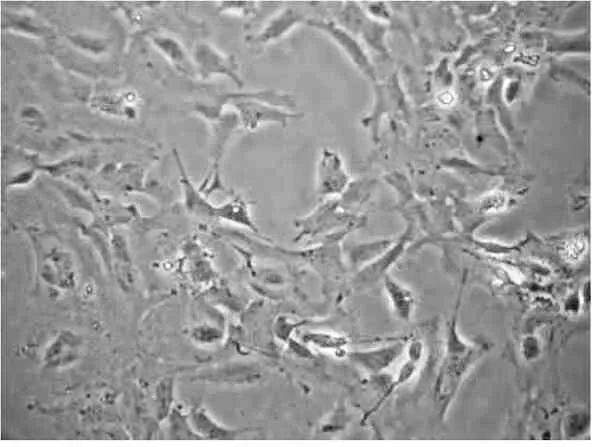
图5 EPO 5u/ml组,神经干细胞分化培养4d光镜照片(×100)
2.2.2MAP2免疫细胞荧光化学染色及共聚焦显微镜观察 加入EPO分化培养7d,MAP2免疫细胞荧光染色共聚焦显微镜观察,示部分细胞胞浆及突起呈绿色荧光,MAP2表达阳性,见图6。

图6 EPO 5u/ml组,NSCs免疫荧光细胞化学染色, 示MAP2阳性细胞(×400)
各实验组对NSCs向神经元方向分化的影响如表1所示。

表1 加入EPO各组MAP2在神经元内的表达
注:*P<0.05,说明EPO浓度不同时,NSCs向神经元分化的比例不同或不全相同。
添加EPO各组分别与对照组比较(见图7),MAP2表达阳性率EPO≥5u/ml各实验组显著高于对照组(P<0.05)。
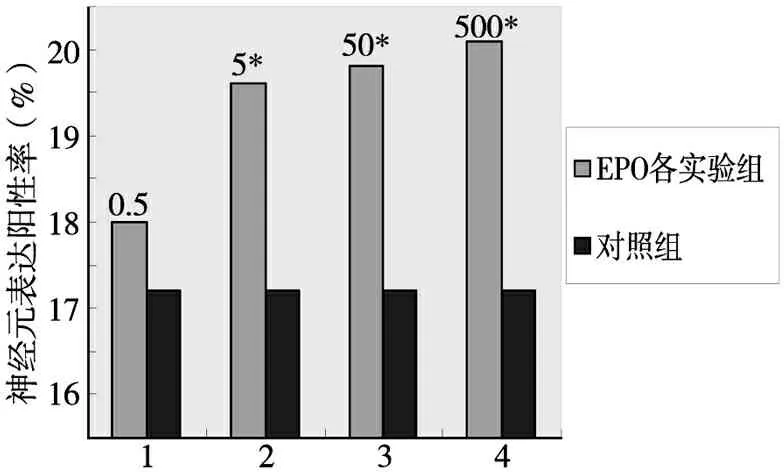
*与对照组相比P<0.05
图7 EPO各实验组与对照组比较神经元表达阳性率
3 讨论
NSCs是当今科学研究热点之一。本实验分离胚胎大鼠脑皮质,经处理吹打成单细胞,在生长培养基对其悬浮培养,可获得悬浮生长的神经球,电镜结果显示,神经球内细胞核质比例较高,细胞器较少,此结果与一般干细胞形态特征相一致。nestin具有维持神经前体细胞正常形态的作用,在本实验将nestin作为NSCs的标记物,神经球爬片6~8h,其免疫细胞化学染色结果显示球内细胞均呈nestin阳性,表明生长培养基培养的细胞为NSCs,且具增殖潜能。在添加10%FBS的培养基中NSCs贴壁,7d后行免疫细胞化学染色,示分化细胞中部分表达MAP2阳性或GFAP阳性,表明本实验源于SD大鼠胚胎脑皮质的细胞体外培养,具有分化为神经元、星形胶质细胞的能力。
EPO为促红细胞生成素,在体内对NSCs的保护作用研究较多[4-5],Yu等[4]的研究表明,在脑及脊髓EPO和其受体有抗细胞凋亡功能,对神经元正常发育有重要作用。体外培养可以研究单因素对NSCs的影响,本实验取材位置是SD大鼠胚胎脑皮质,前期实验结果[2]表明EPO在适当浓度下可抑制体外培养的NSCs凋亡。本实验NSCs爬片分化7d,MAP2免疫荧光细胞化学染色结果显示EPO≥5 u/ml各实验组阳性细胞表达率显著高于对照组(P<0.05),表明适当剂量的EPO促进体外大鼠胚胎脑皮质NSCs向神经元方向分化。在体内促红细胞生成素EPO与促红细胞生成素受体(EPO-R)结合,激活蛋白酪氨酸激酶,在细胞内快速诱导多种蛋白质发生酪氨酸磷酸化,从而启动信号转导通路如Ras有丝分裂原激活蛋白激酶等将信号传到细胞核核因子1,控制NSCs增殖、分化。脑内皮细胞在促红细胞生成素直接作用下分泌脑源性神经生长因子(NGF),后者通过作用于邻近细胞的旁分泌方式促进神经发生[6-9]。在体外EPO促进源于胚胎脑皮质的NSCs分化,推测可能原因:一方面,源于大鼠胚胎脑皮质的NSCs有与促红细胞生成素相结合的受体,体外培养基中加入EPO,EPO便与脑皮质NSCs上的EPO-R结合启动了信号传导通路而促进NSCs向神经元方向的分化,另一方面可能刺激了源于胚胎脑皮质的NSCs分泌神经生长因子,此因子作用于邻近神经干细胞,从而促进了NSCs向神经元方向的分化。NSCs向神经元方向分化的具体调控机制目前尚不清楚,受自身基因和外来信号等方面共同调节,下一步将继续深入探讨胚胎NSCs向神经元定向诱导分化的影响因素及其分化机制,为NSCs移植治疗中枢神经系统损伤及神经变性性疾病提供理论基础。
[1] Burger D,Lei M,Geoghegan-Morphet N,et al.Erythropoietin protects cardiomyocytes from apoptosis via up-regulation of endothelial nitric oxide synthase[J].Cardiovasc Res,2006, 72(1):51-59.
[2] 袁丽丽,姜海燕,杜红梅,等.EPO对鼠胚脑皮质神经干细胞抗凋亡作用的研究[J].济宁医学院学报,2011,34(2):77-80.
[3] 袁丽丽,马登殿,杜红梅,等.促红细胞生成素促进体外鼠胚脑皮质神经干细胞增殖[J].解剖科学进展,2010, 16(6):550-553.
[4] Yu X,Shacka JJ,Eells JB,et al.Erythropoietin receptor signaling is required for normal brain development[J].Development,2002,129:505-516.
[5] Wallach I,Zhang J,Hartmann A,et al.Erythropoietin-receptor gene regulation in neuronal cells[J].Pediatr Res,2009, 65:619-624.
[6] Sargin D,El-Kordi A,Agarwal A,et al.Expression of constitutively active erythropoietin receptor in pyramidal neurons of cortex and hippocampus boosts higher cognitive functions in mice[J].BMC Biol,2011,9:27.
[7] Hirabayashi Y,Itoh Y,Tabata H,et al.The Wnt/{beta}-catenin in pathway directs neuronal differentiation of cortical neural precursor cells[J].Development,2004,131:2791-2801.
[8] Wang L,Zhang Z,Wang Y,et al.Treatment of stroke with erythropoietin enhances neurogenesis and angiogenesis and improves neurological function in rats[J].Stroke,2004, 35:1732-1737.
[9] 胡宝洋.干细胞神经定向分化研究与医学转化[J].济宁医学院学报,2012,35(5):316-321.
