快速敲除补回家蚕核型多角体病毒ORF29
2014-02-05王蓉
王 蓉
(浙江理工大学,浙江杭州 310018)
快速敲除补回家蚕核型多角体病毒ORF29
王 蓉
(浙江理工大学,浙江杭州 310018)
利用Red重组系统成功敲除家蚕核型多角体病毒ORF29基因(BmNPV ORF29,简称Bm29),并利用Bac-to-Bac系统构建补回型的Bm29基因。通过PCR鉴定敲除和补回均成功,为后续的Bm29基因功能研究奠定基础。
家蚕核型多角体病毒;ORF29基因;Red重组;Bac-to-Bac
杆状病毒是已知昆虫病毒中类群最大,且具有较大实用意义的昆虫病毒[1]。目前,已有29种昆虫杆状病毒的基因组被完全测序[2]。
基因敲除技术是研究基因功能的一种常用手段。传统的构建重组杆状病毒方法是利用转移载体与野生型病毒DNA共转染昆虫细胞,通过同源交换和空斑纯化获得重组病毒,但该方法不仅重组效率低,而且耗时耗材[3]。近年来,Red重组系统,因其准确率高、操作简便的优点逐渐成为新型的基因敲除方法[4]。Red重组系统属于λ噬菌体的重组系统,它的编码基因exo,bet和gam置于L-阿拉伯糖启动子控制下,在L-阿拉伯糖诱导下能够表达重组所需的酶,从而介导线性化片段与染色体的特定片段进行同源重组,进而利用外源基因替换靶基因[5]。目前,已经有报道利用Red重组成功敲除了杆状病毒基因lef-6,l ef-8和lef-10[6-8]。
家蚕核型多角体病毒(BmNPV)基因组已经被测序完全,含有136个完整的开放阅读框[9]。BmNPVORF29,简称Bm29,全长654 bp,位于BmNPV基因组T3株的26449~27102 bp处,表达产物预测分子量为22.0 ku。该基因功能的研究还一直未见报道,本文首次利用Red重组系统在大肠杆菌中成功地对Bm29基因进行了定点敲除,并利用Bac-to-Bac系统补回缺失型的Bm29基因,为后续基因功能的研究奠定基础。
1 材料与方法
1.1 材料
BW 25113-Bac、E.coli TG1和DH10Bac菌种,质粒pFastBac1、pKD3和pKD46均由本实验室保存。
Taq酶、限制性内切酶Eco RⅠ和Bam HⅠ,T4 Ligation,DL2000,1 kb DNA Marker购于TaKaRa公司;L-阿拉伯糖购自美国Promega公司;凝胶回收试剂盒购自天根生化科技有限公司;引物合成、测序由Invitrogen公司完成;其余试剂为国产分析纯。
1.2 方法
1.2.1 Bm29基因的敲除型的构建
PCR制备Bm29基因打靶线性化片段。以pKD3质粒为模板,引物由50 bp的Bm29基因的同源臂(下划线为同源臂)和20 bp的cat的同源区组成,如下:Bm29-C-F3')。PCR扩增获得1 100 bp左右的打靶片段,命名为Bm29-C。
将纯化后的Bm29-C转化至DH10Bac感受态细胞(含pKD46质粒)中,加入L-阿拉伯糖的诱导表达λRed,使得Bm29-C与病毒基因组中的Bm29基因发生同源重组。进行蓝白斑筛选,并做PCR、双酶切鉴定和测序(图1)。
为了验证Bm29基因是否被敲除,用不同的引物组合进行PCR鉴定。所用的验证引物分别为Bm29-F(5'-CGCTGCAGGATTGTTTATGA-3')和Bm29-R(5'-TTACACCCGCCTAAGTGCGTGC-3')、Bm29-F和cat-R(5'-CAATATGGACAACTTCTTCG-3')、cat-F(5'-CAATATGGACAACTTCTTCG-3')和Bm29-R。
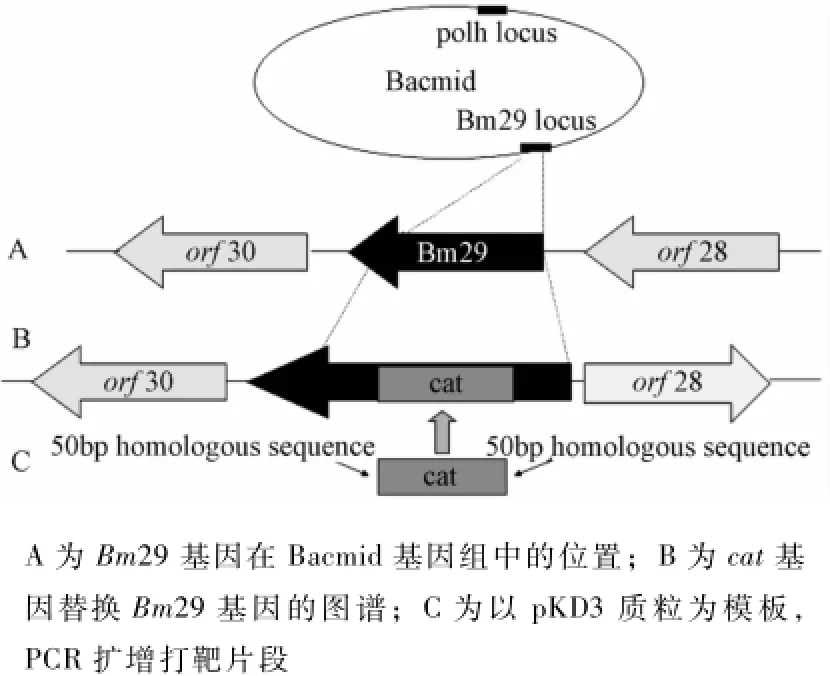
图1 Bm29基因敲除型构建策略
1.2.2 Bm29基因的补回型的构建
将Bm29基因补回至Bm29-KO-Bacmid中,需构建重组质粒pFastBac1-Bm29,并利用Bac-to-Bac系统将Bm29基因异位补回到多角体启动子下(图2)。
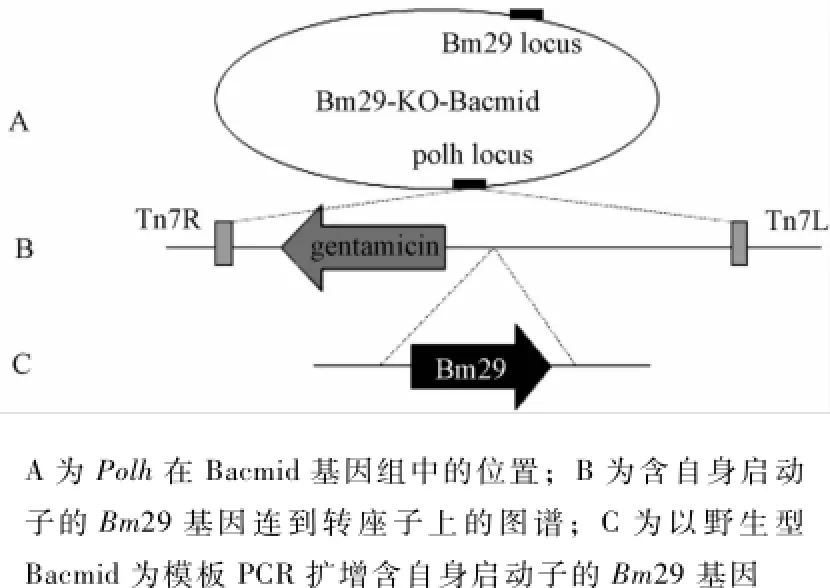
图2 Bm29基因补回型构建策略
根据Bm29基因的序列并在上下游插入酶切位点Eco RⅠ和Bam HⅠ,来设计引物。引物分别pFB-Bm29-R线为酶切位点Eco RⅠ)及pFB-Bm29-F(5'-为酶切位点Bam HⅠ)。以wtBacmid为模板,pFBBm29-F和pFB-Bm29-R为引物进行PCR扩增。纯化后的PCR产物与载体pFastBac 1分别用EcoRⅠ和Bam HⅠ进行双酶切。连接产物,并进行蓝白斑筛选。对重组质粒pFastBac1-Bm29进行双酶切和PCR鉴定,并测序。将重组成功的质粒转化至DH10Bac感受态细胞(Bm29缺失型病毒)中,Bm29基因重新补回Bm29-KO-Bacmid中,获得补回型Bm29-Re-Bacmid。
为了鉴定是否成功补回,利用M13和Bm29基因特异性引物对Bm29-KO-Bacmid和Bm29-Re-Bacmid进行PCR,引物组合分别为M13-F(5'-GTTTTCCCAGTCACGAC-3')和M13-R(5'-CAGGAAA CAGCTATGAC-3')、M13-F和pFB-Bm29-R、PFBBM29-F和M13-R。
2 结果与分析
2.1 鉴定Bm29基因的敲除
PCR鉴定Bm29基因是否敲除成功,结果如图3。结果显示Bm29-F和Bm29-R为引物的扩增产物大小约为1 600 bp;Bm29-F和cat-R为引物的扩增产物大小约为460 bp;cat-F和Bm29-R为引物的扩增产物大小约为1 100 bp;以上结果表明已成功将Bm29基因从Bcmid基因组中敲除。
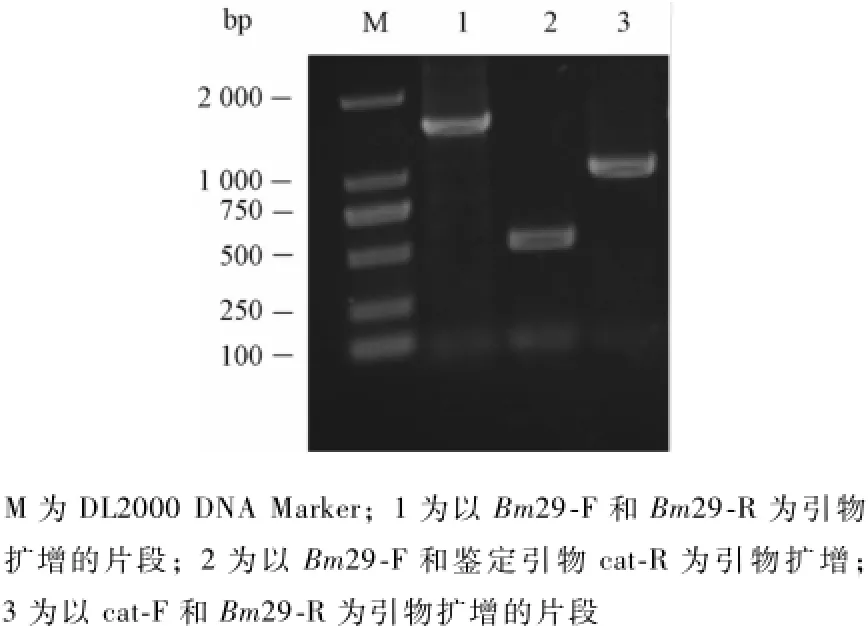
图3 敲除Bm29的PCR鉴定
2.2 鉴定Bm29基因的补回
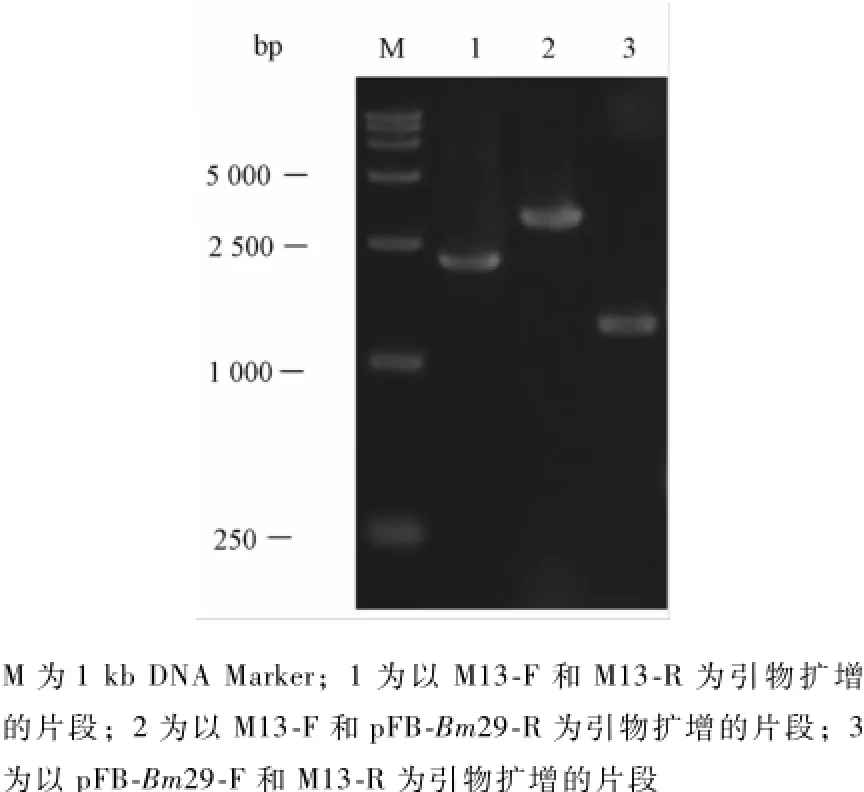
图4 补回型Bm29的PCR鉴定
PCR鉴定Bm29基因是否正确补回。结果如图4。以M13-F和M13-R为引物的扩增产物大小约为2 300 bp;以M13-F和pFB-Bm29-R为引物的扩增产物大小约为3 000 bp;以pFB-Bm29-F和M13-R为引物的扩增产物大小约1 360 bp,均与理论值相符。表明Bm29基因已成功补回。
3 小结和讨论
研究杆状病毒基因的功能需要将目的基因失活,利用Red重组系统[10-14]只要50 bp左右的同源臂即可介导外源基因与目的基因发生同源重组。这种方法不需要体外酶切反应,也不存在其他碱基突变的危险,是一个简单、快速、高效的基因敲除系统[15]。
本文利用Bac-to-Bac系统构建补回型病毒,通过PCR鉴定敲除和补回型的Bm29基因,为后续的基因功能研究奠定基础。
[1] 郭忠建,姚勤,王海燕,等.利用Red系统快速敲除家蚕核型多角体病毒orf60基因[J].生物工程学报,2007,23(5):801-805.
[2] Jehle JA,Blissard G,Bonning B,et al.On the classification and nomenclature of baculoviruses:a proposal for revision[J]. Archives of Virology,2006,151(7):1257-1266.
[3] O'Reilly D R,M iller L K,Luckow V A.Baculovirus expression vectors:a laboratory manual[M].New York:Oxford University Press,1994.
[4] 张雪,温廷益.Red重组系统用于大肠杆菌基因修饰研究进展[J].中国生物工程杂志,2008,28(12):89-93.
[5] 李樊,刘义,何钢.基因敲除技术研究进展[J].生物技术通报,2008(2):80-82.
[6] Lin G,Blissard G W.Analysis of an Autographa californica multicapsid nucleopolyhedrovirus lef-6-null virus:LEF-6 is not essen tial for viral replication bu t appears to accelerate late gene transcription[J].Journal of Virology,2002,76(11):5503-5514.
[7] Acharya A,Gopinathan K P.Characterization of late gene expression factors lef-9 and lef-8 from Bombyx mori nucleopolyhedrovirus[J].Journal of General Virology,2002,83(8):2015-2023.
[8] Yu W,Du C Y,Quan Y P,et al.Characterization of late gene expression factor LEF-10 from Bombyx mori nucleopolyhedrovirus[J].Virus Research,2013,175(1):45-51.
[9] Gomi S,Majima K,Maeda S.Sequence analysis of the genome of Bombyx mori nucleopolyhedrovirus[J].Journal of General Virology,1999,80(5):1323-1337.
[10] Passarelli A L,Guarino L A.Baculovirus late and very late gene regulation[J].Current Drug Targets,2007,8(10):1103-1115.
[11] Gomi S,Majima K,Maeda S.Sequence analysis of the genome of Bombyxmori nucleopolyhedrovirus[J].Journal of General Virology,1999,80(5):1323-1337.
[12] Vanarsdall A L,Okano K,Rohrmann G F.Characterization of the replication of a baculovirus mutant lacking the DNA polymerase gene[J].Virology,2005,331(1):175-180.
[13] Vanarsdall A L,Okano K,Rohrmann G F.Characterization of a baculoviruswith a deletion of vlf-1[J].Virology,2004,326(1):191-201.
[14] Datsenko K A,Wanner B L.One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products[J].Proceedings of the National Academy of Sciences of the USA,2000,97(12):6640-6645.
[15] 王军平,张友明.Red/ET重组及其在生物医学中的应用[J].生物工程学报,2005,21(3):502-506.
(责任编辑:张 韵)
S 884.5
:A
:0528-9017(2014)10-1624-03
文献著录格式:王蓉.快速敲除补回家蚕核型多角体病毒ORF29[J].浙江农业科学,2014(10):1624-1626.
2014-08-21
王 蓉(1989-),女,安徽当涂人,硕士研究生,主要从事基因表达与调控研究工作。E-mail:wangrong_8912 @163.com。
