hVEGF基因修饰的组织工程化复合物修复牙周组织缺损的实验研究
2014-02-05赵俊杰朱小峰闫福华
赵俊杰 朱小峰 闫福华
hVEGF基因修饰的组织工程化复合物修复牙周组织缺损的实验研究
赵俊杰 朱小峰 闫福华
目的探讨hVEGF165基因修饰的BMSCs在SD大鼠急性牙周缺损模型中对牙周组织再生的作用。方法人工构建SD大鼠急性牙周缺损模型。设以下6组(36只SD大鼠,n=6):空白对照(A组);单纯e-PTFE膜(B组);BME+e-PTFE膜(C组);BMSCs+BME+e-PTFE膜(D组);空转BMSCs+BME+e-PTFE膜(E组);hVEGF165基因修饰的BMSCs+BME+e-PTFE膜(F组)。分别将转染hVEGF165基因的BMSCs与未转染的BMSCs接种于胶原膜BME-10X后,按各分组植入人工牙周缺损内,并以空白胶原膜和空载体为对照。4周后取材作病理切片,HE染色观察牙周组织再生情况,测量新生牙槽骨面积、新生牙骨质面积以及新生牙周膜宽度,结果进行统计学分析。结果各组均可见不同程度的牙周组织再生,A组、B组和C组三组新生牙槽骨面积(NB)、新生牙骨质面积(NC)和新生牙周膜宽度(NP)均无明显差别(P>0.05);与A组相比,D组、E组、F组的NB、NC均有显著增加(P<0.05);与E组相比,转染有hVEGF165基因组(F组)的NB、NC和NP均有显著增加(P<0.05)。结论hVEGF165基因转染BMSCs与胶原膜复合物可促进大鼠牙周组织再生。
人血管内皮细胞骨髓基质干细胞组织工程牙周组织再生胶原膜急性牙周缺损
血管内皮生长因子(Vascularendothelial growth factor,VEGF)是内皮细胞的特异性丝裂原,是作用最强、特异性最高的血管形成和血管通透性诱导因子,与骨形成有直接关系,在成骨活动中具有积极作用;另外,VEGF还有强大的血管生成和骨再生能力[1]。骨髓基质干细胞(Bone marrow stromalcells,BMSCs)具有多向分化潜能,可向成骨细胞、软骨细胞、神经细胞、脂肪细胞及成肌细胞分化。获取方法简单可靠,创伤小,体外培养可获得大量扩增[2]。作为同源细胞治疗,无免疫原性,易于自体回植,是组织工程化骨理想的种子细胞。应用骨髓基质细胞来表达基因有许多优点,其细胞表面有骨诱导蛋白的受体,具有明确的成骨潜能[3]。BMSCs在不同类型生长因子的作用下,可向相应的细胞类型分化,促进组织的成熟。VEGF可促进体外培养BMSCs的增殖并向成骨表型分化,且不同浓度的VEGF可使其特定地分化成静脉或动脉血管内皮细胞[4]。本研究试图通过人血管内皮生长因子(hVEGF165)基因修饰SD大鼠BMSCs,在体外将其与胶原膜BME-10X复合构建组织工程化复合物,植入SD大鼠下颌的人工牙周组织急性缺损区,通过组织学观察和测量,进一步了解、分析评价其对牙周组织再生的影响,为将基因强化的牙周组织工程技术应用于牙周组织缺损的修复提供实验依据。
1 材料与方法
1.1 实验动物及试剂
雄性SD大鼠36只,体质量(130±20)g,清洁级,购自上海斯莱克实验动物有限公司。动物许可证号:SCXK(沪)2007-0005。大鼠由南京军区福州总医院动物比较医学科(清洁级实验动物中心)饲养管理。
DMEM培养基(Gibco,美国);胰蛋白酶(Gibco,美国);胎牛血清(FBS,杭州四季青公司);L-谷氨酰胺(Sigma,美国);磷酸缓冲生理盐水(PBS,福州迈新生物技术开发有限公司);二甲基亚砜(Invitrogen,美国);医用组织引导再生胶原膜BME-10X(福建省博特生物科技有限公司);e-PTFE膜(上海市塑料研究所);瞬康医用胶(北京瞬康科技发展有限公司);盐酸氯胺酮(恒瑞医药);阿替卡因肾上腺素注射液(塞特力,法国);多聚甲醛(天津市百世化工有限公司);10%EDTA脱钙液(汕头市西陇化工有限公司)。
1.2 方法
1.2.1 细胞载体复合物的制备
用0.25%胰蛋白酶+0.02%EDTA将转染重组腺病毒Ad5-hVEGF165-EGFP的BMSCs细胞和空转组的细胞消化后,调整细胞密度,以5×106cells/mL的密度接种于已预湿的4 mm×2 mm的胶原膜BME-10X上,每片接种10μL,置37℃孵箱中,2 h后加入2 mL含10%FBS培养液,隔日换液,倒置显微镜下观察细胞附着情况,培养2 d后用于实验。
1.2.2 实验分组
实验用雄性SD大鼠36只,随机分为6组,每组6只。A组:空白对照;B组:单纯e-PTFE膜;C组:BME+e-PTFE膜;D组:BMSCs+BME+e-PTFE膜;E组:空转BMSCs+BME+e-PTFE膜;F组:hVEGF165基因修饰的BMSCs+BME+e-PTFE膜。
1.2.3 细胞载体复合物治疗SD大鼠牙周急性缺损
SD大鼠牙周急性缺损的制备:参照赵欣等[5-7]的方法,大鼠称重后,氯胺酮(100 mg/K g)腹腔麻醉,背部固定,取仰卧位,在大鼠右侧下颌区备皮、消毒,必蓝注射液0.2 m L术区局部浸润麻醉,以减少出血。常规铺巾,暴露术区,在下颌骨下缘距离口角约1 cm处切开皮肤,往近远中方向延长切口至2 cm。逐层分离组织,于下颌骨下缘处暴露咬肌下缘,切断咬肌附着,分离咬肌和骨膜,由下向上骨膜下翻瓣,暴露下颌骨的颊侧骨面。确定下颌第1、2磨牙的相对位置,使用电动打磨手机,低速逐步磨除颊侧表层骨皮质,制备近远中向4 mm,颊舌向1 mm,垂直向2 mm的缺损。暴露第一磨牙的颊根,测量缺损大小后,以锐利的小刮匙刮除根面的牙周膜、牙骨质和表层牙本质,添加抗生素的生理盐水冲洗创面(图1)。
根据实验分组处理各个缺损,将组织工程复合物放置于骨缺损处,然后覆盖e-PTFE膜(使得膜边缘超出骨缺损边缘约0.5 mm),将e-PTFE膜四周用瞬康医用胶固定,用含抗生素的生理盐水冲洗3次。
分层缝合后,用湿纱布在创面加压5~10 min,使创面下方的软组织与骨面紧密贴合,减少出血及死腔形成,局部涂金霉素眼膏。同时,腹腔注射青霉素40万U,术后连续3 d肌注青霉素40万U/d,预防感染。严密观察SD大鼠的精神状态、饮食、活动及伤口愈合情况。
1.2.4 标本制备
术后4周取右侧下颌骨标本,即刻置于新鲜配置的4%多聚甲醛中固定7 d,流水冲洗24 h,将标本置于10%EDTA脱钙液中脱钙14 d,每3天更换一次脱钙液。标本脱钙完全后用流水冲洗24 h,梯度脱水(30%、50%、70%、80%、90%、95%乙醇各24 h,无水乙醇、正丁醇各12 h),浸蜡6 h,常规石蜡包埋。每个标本按照4μm厚度进行颊舌向冠状切片、修片,直至镜下观察到第一磨牙颊侧根面的缺损出现时开始连续切片,每间隔50μm取1张,挑选其中5张进行组织学测量和分析。
1.2.5 组织学观察和测量
将切片HE染色,正置显微镜下观察新生牙周组织再生情况,每个标本取5张连续切片进行拍照,Image-Pro Plus6.0进行组织学测量。测量指标包括:裸露于第一磨牙颊侧根面上新生牙槽骨(new alveolar bone formation,NB)、新生牙骨质(new cementum formation,NC)的面积以及新生牙周膜(new periodontal ligament,NP)的宽度,并对测量结果进行统计学分析(图2)。
1.2.6 统计学处理
所得数据采用SPSS16.0统计软件处理;所有数据以x±s表示,两组间比较采用t检验,多组间均数比较采用单因素方差分析,多组间两两比较采用LSD检验,P<0.05为差异具有统计学意义。
2 结果
2.1 动物大体观察
术后2 h大鼠逐渐恢复活动。术后1 d,各组大鼠右侧面部均出现水肿,部分大鼠右眼眶周围皮下出现淤血,伤口缝线未脱落,大鼠精神萎靡,毛发略灰暗,进食减少。术后7 d水肿消退,伤口愈合良好,大鼠饮食活动恢复正常。术后2周,术区缝线大都自行脱落,伤口愈合良好。术后4周取材,解剖下颌牙周缺损区域,肉眼观察可见e-PTFE膜贴附完好,少数e-PTFE膜有松动,但未发现脱落。

图1 SD大鼠牙周急性缺损模型示意图Fig.1 Sketch map of acute periodontal fenestration defects in SD rats
2.2 组织学观察
所有标本切片,HE染色后在光学显微镜下进行组织学观察,可见各组覆盖的屏障膜e-PTFE膜保存完整,周围有大量炎症细胞浸润;各实验组的支架材料BME胶原膜基本被吸收,没有发现材料残留。6个组均有不同程度的牙周组织再生,对空白对照组(A组)和单纯e-PTFE膜组(B组)而言,其余各组有更多新生牙槽骨形成,新生骨样组织填充于下颌牙周急性缺损部位,但新生的牙槽骨矿化程度相对较低,与周围骨组织无明显界限,可见新生骨的表面密集排列胞核大、胞浆丰富的成骨细胞(图3)。空白对照组可见新生的牙槽骨形成,其间未见到新生血管;单纯e-PTFE膜组(B组)和单纯胶原膜组(C组)只有少量新生骨,新生骨结构排列疏松,骨小梁纤细,且矿化程度较低,在新生骨周围可见大量的结缔组织,无新生血管形成;细胞组和空载组(D组和E组)可见新生骨形成,少量小血管分布其间,板层骨量少;转染组(F组)可见大量新骨形成,相互连接成片,内可见板层骨形成,在新生牙槽骨的近牙根侧可见新生牙周膜形成,镜下可见新生牙周膜为新生结缔组织,平行或斜形附着于新生牙槽骨或新生牙骨质,内含较多新生的血管,牙根表面可见呈连续或不连续覆盖于裸露牙根表面的新生牙骨质,厚薄不均,偶可见细胞型牙骨质(图4)。
2.3 组织学观察
各组新生牙槽骨、新生牙骨质面积和新生牙周膜宽度测量结果显示A、B、C三组之间新生牙槽骨面积(NB)、新生牙骨质面积(NC)和新生牙周膜宽度(NP)均无明显差别(P>0.05);与A组相比,D、E、F组NB、NC均有显著增加(P<0.05);与E组相比,转染有hVEGF165基因组(F组)的NB、NC和NP均有显著增高(P<0.05)。
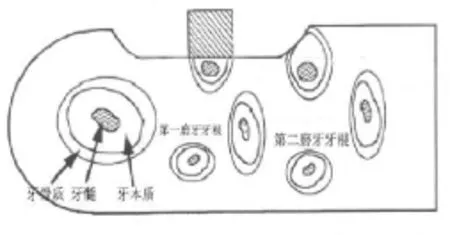
图2 颊侧根面新生牙槽骨面积测量示意图Fig.2 Schematic diagram of new alveolar bone area measurement on buccalroot

图3 术后4周各组标本组织学观察(FCT:纤维结缔组织;NB:新生牙槽骨;NC:新生牙骨质;NP:新生牙周膜)Fig.3 Histological observation in each group 4 weeks after operation (FCT:fibrous connective tissue;NB:new alveolar bone;NC:new cementum;NP:new periodontium)
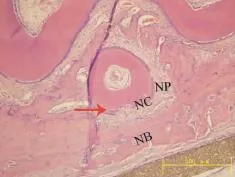
图4 细胞型牙骨质(箭头所示)Fig.4 Cytoid cementum(Indicated by the arrow)
3 讨论
建立实验性牙周缺损模型是牙周组织工程研究的前提和条件,目前常用的建立方式有两种:①外科手术造成的急性缺损;②菌斑、牙胶等各种因素诱导的慢性缺损。研究证明,急性缺损的牙周组织修复程度较高,数值相对较稳定[8]。大鼠的牙周组织结构、病理生理都与人类相似,其口腔内上下左右各有3个磨牙,龈沟内被覆角化上皮,且操作简便,易于饲养,成活率高,繁殖周期短,价格便宜。因此在牙周病的研究中,大鼠作为实验性牙周炎模型仍是理想选择[9]。Huang等[10]应用SD大鼠急性牙周缺损模型,研究不同浓度的BMP-6修复缺损的能力,结果显示在移植术后28 d就可出现完全的骨再生。林泓兵等[11]应用负载人牙周膜细胞的生物活性复合膜覆盖在大鼠急性牙周组织缺损处,发现生物活性复合膜能促进牙周组织生长,对牙周骨组织缺损修复具有显著作用。本实验选择SD大鼠进行体内研究,采用口外入路人工制备急性牙周缺损模型[5-7],在人工去除下颌第一磨牙颊侧牙槽骨后,暴露其颊根,刮除根面牙周膜、牙骨质和表层牙本质,形成4 mm×2 mm大小的矩形缺损,然后根据实验设计将不同的细胞-材料复合物植入牙周缺损中,研究hVEGF165基因修饰的BMSCs对SD大鼠牙周组织缺损修复的影响。
我们在实验中选用e-PTFE膜覆盖于组织工程化复合物表面,是希望利用e-PTFE膜的屏障作用制造出一个置于软组织和骨缺损之间相对封闭的组织环境,阻止容易干扰骨形成且迁移速度较快的纤维结缔组织细胞进入骨缺损区,充分发挥组织工程化复合物的潜在生长能力,实现牙周组织的完全再生。
传统的GTR手术切口都在口内,口腔内细菌容易通过伤口感染术区,导致实验失败。Tempro等[12]认为屏障膜在GTR术后1~2周内容易暴露在口腔中,增加了细菌定植的机会,会对牙周再生产生不良影响。因此,我们在制备SD大鼠牙周模型时,选择口外径路,避免口腔内细菌的侵入和牙龈上皮细胞长入缺损部位对实验结果造成干扰。
本实验表明,在SD大鼠体内,经过hVEGF165基因修饰后的BMSCs促进牙周组织再生的效果明显优于单纯细胞组和空转组,负载BMSCs的组织工程化复合物促进牙周组织再生的能力明显优于单纯胶原膜组。
骨的形成和修复是以成骨细胞为中心,由破骨细胞、血管内皮细胞、骨细胞及细胞外基质共同参与,并受多种生长因子和激素调控的复杂生理活动。血管内皮细胞生长因子在骨再生与代谢中的作用主要体现在3个方面:①通过促进内皮细胞增殖、血管生成,调节骨组织血供并参与骨的发育形成;②通过调节成骨细胞和破骨细胞的活性促进骨组织的再生、修复和重建;③作为旁分泌因子参与骨形成代谢。有研究发现,局部使用rhVEGF具有增强血管生成和骨再生的能力,认为其在骨形成和维持血管系统方面具有重要的作用[13]。骨再生和生物材料的骨结合都依赖于血管生成和血管化,在血管生成的不同时期,对VEGF的需求不一。血管生成早期,高浓度的VEGF可促进内皮细胞的分化、增殖和聚集形成内皮管;血管生成的后期,内皮细胞的增殖是次要的。若在血管生成的整个过程中,都使用高浓度的VEGF,可能因内皮细胞的分化、增殖和聚集形成相对过量的内皮管,造成血管畸形,形成畸形而无功能的组织。Wernike等[1]在观察体外和裸鼠体内成骨实验中发现,持续释放低浓度的VEGF有利于骨再生。本实验结果表明,hVEGF165基因修饰的BMSCs和胶原膜复合形成的组织工程化复合物,可以促进牙周组织再生,但其作用机制如何,hVEGF165在体内微环境下如何诱导BMSCs分化,是否存在时序性等,尚有待进一步的研究证实。
[1]Wernike E,Montjovent MO,Liu Y,et al.VEGF incorporated into calcium phosphate ceramics promotes vascularisation and bone formation in vivo[J].Eur Cell Mater,2010,19:30-40.
[2]孙安科,裴国献.组织工程研究面临的问题和发展方向[J].国外医学:生物医学工程分册,2003,26(5):218-223.
[3]Baltzer AW,Lattermann C,Whalen JD,et al.Potential role of direct adenoviral gene transfer in enhancing fracture repair[J]. Clin Orthop Relat Res,2000(379 Suppl):S120-S125.
[4]Zhang G,Zhou J,Fan Q,et al.Arterial-venous endothelial cell fate is related to vascular endothelial growth factor and Notch status during human bone mesenchymal stem cell differentiation [J].FEBS Lett,2008,582(19):2957-2964.
[5]赵欣.不同浓度骨髓基质细胞对牙周组织再生影响的实验研究[D].福州:福建医科大学,2009.
[6]King GN,King N,Cruchley AT,et al.Recombinant human bone morphogenetic protein-2 promotes wound healing in rat periodontal fenestration defects[J].J Dent Res,1997,76(8):1460-1470.
[7]江俊.hBMP-7基因修饰的骨髓基质细胞修复骨质疏松大鼠牙周组织缺损的实验研究[D].福州:福建医科大学,2011.
[8]Wikesjo UM,Selvig KA.Periodontal wound healing and regeneration [J].Periodontol 2000,1999,19:21-39.
[9]陈亚伟,王晖.牙周病实验动物模型的建立和应用[J].现代食品与药品杂志,2006,16(1):12-15.
[10]Huang KK,Shen C,Chiang CY,et al.Effects of bone morphogenetic protein-6 on periodontal wound healing in a fenestration defect of rats[J].J Periodontal Res,2005,40(1):1-10.
[11]林泓兵,赵斌,丁子清,等.生物活性复合膜对大鼠牙周组织缺损的修复作用[J].吉林大学学报(医学版),2013,39(5):888-892.
[12]Tempro PJ,Nalbandian J.Colonization of retrieved polytetrafluoroethylene membranes:morphological and microbiological observations[J].J Periodontol,1993,64(3):162-168.
[13]Kleinheinz J,Stratmann U,Joos U,etal.VEGF-activated angiogenesis during bone regeneration[J].J Oral Maxillofac Surg,2005,63(9): 1310-1316.
hVEGF Gene Modified Tissue-engineered Compound in the Reconstruction of Periodontal Tissue Defects in SD Rats
ZHAO Junjie1,ZHU Xiaofeng2,YAN Fuhua1.1 Institute and Hospital of Stomatology,Nanjing University School of Medicine,Nanjing 210008,China;2 Department of Oral and Maxillofacial Surgery,The First Affiliated Hospital,Fujian Medical University,Fuzhou 350004,China.Corresponding author:YAN Fuhua(E-mail:fhyan2005@126.com).
ObjectiveTo investigate the effects of hVEGF165 gene transfected bone marrow stem cells(BMSCs)in the repair of periodontal defect in rats.MethodsA model of rat periodontal defect was established.The gene-modified tissueengineered complex,constructed by transfected BMSCs and BME-10X,was implanted into subcutaneous sites in SD rats. The 36 SD rats were divided into 6 groups randomly(n=6):control(A and B),blank collagen membranes(C),BMSCs with collagen membranes(D),empty adenoviral vector transfected BMSCs with collagen membranes(E),and hVEGF165 transfected BMSCs with collagen membranes(F).BMSCs with different treatments were seeded on the collagen membranes. The collagen membrane with or without cells was transplanted into an acute periodontal defect model respectively,and then the defects were covered with e-PTFE membranes.Histological and morphometric analysis were performed 4 weeks after operation,the area of new alveolar bone(NB),cementum area(NC)and the width of periodontal ligament(NP)were measured and compared.ResultsDifferent degrees of periodontal tissue regeneration were observed in all groups.There were no differences of the area of newly formed alveolar bone(NB),cementum area(NC)and the width of periodontal ligament(NP) among the 3 groups(A,B,C).NB and NC in group D,E,F were significantly increased compared with group A(P<0.05). NB,NC and NP in group F were significantly increased compared with group E(P<0.05).ConclusionThe BME-10Xshowed a good biocompatibility with BMSCs transfected by hVEGF165.BMSCs transfected by hVEGF165 gene enhanced periodontal tissue regeneration in models of periodontal defect.
Vascular endothelial cells;Bone marrow stromal cells;Tissue engineering;Periodontal regeneration; Collagen membrane;Acute periodontal defect
Q813.1+1
A
1673-0364(2014)05-0250-05
2014年4月11日;修复日期:2014年6月2日)
10.3969/j.issn.1673-0364.2014.05.004
南京市国际合作项目(201303051);福建省教育厅资助项目(JK2010023)。
210008江苏省南京市南京大学口腔医学院(赵俊杰,闫福华);350004福建省福州市福建医科大学附属第一医院(朱小峰)。
闫福华(E-mail:fhyan2005@126.com)。
注:赵俊杰,朱小峰为共同第一作者。
