趋化因子10在慢性非萎缩性胃炎、胃癌癌前病变及胃癌中的表达及意义*
2014-02-03何甜,唐慧,郭强△,杨慧
何 甜,唐 慧,郭 强△,杨 慧
(云南省第一人民医院:1.消化内科;2.基础医学研究所/云南省重点实验室;3.病理科,昆明 650032)
胃癌(GC)是消化道常见的恶性肿瘤之一,虽然近年来世界范围内GC总体发病率呈下降趋势,但其发病率和病死率在各类恶性肿瘤中均居首位,严重威胁着人民的身体健康。目前,寻找特异性的治疗靶点,成为GC治疗研究中心的一个热点。而随着肿瘤与分子学关系研究的不断深入,其中趋化因子10(CXCL10)与其受体CXCR3构成的生物学轴成为目前研究热点。近年来的研究发现,众多肿瘤细胞均可过度表达CXCL10,其可能对肿瘤的生物学行为起到重要的调控作用,包括诱导细胞凋亡,促进细胞增殖炎症效应等[1-2],但关于CXCL10与GC的研究鲜见报道。而众所周知,GC癌变的发展演变过程是从慢性非萎缩性胃炎(chronic non-atrophy gastritis,CNAG)→慢性萎缩性胃炎(chronic atrophic gastritis,CAG)→肠上皮化生(intestinal metaplasia,IM)→不典型增生(dysplasia,Dys)→GC,其中CAG→IM→Dys作为GC发生、发展的重要阶段,被统称为癌前病变(precancerous lesions,PL)[3]。本研究采用SP免疫组织化学法检测CXCL10蛋白在GC PL组织中的表达变化,以期进一步揭示GC癌变的发生、发展机制,现报道如下。
1 资料与方法
1.1一般资料 收集本院2006年6月至2009年12月140例样本,其中CNAG 20例、PL 60例(CAG伴IM 20例、CAG伴轻-中度Dys 20例、CAG伴重度Dys 20例);GC 60例(高分化GC 20例、中低分化40例)。20例CNAG,男9例、女11例,平均(51.1±14.9)岁;60例PL,男46例、女14例,平均(55.9±22.1)岁;60例GC,男42例、女18例,平均(60.6±26.4)岁。所有病例术前均无化疗、放疗及免疫治疗史。本研究获得了本院伦理委员会的批准及患者的知情同意。全部研究样本均经病理组织学证实,GC分类参照日本胃癌学会标准[4]。判断标准:CNAG,发现水肿,线状充血,红斑,并经胃黏膜活检证实黏膜表层上皮细胞变性或坏死脱落形成糜烂,固膜有淋巴细胞及浆细胞浸润;CAG,内镜检查发现有明显的柱状上皮化生和皱襞肥厚,并经胃黏膜活检证实有杯状细胞存在和腺体细胞增生肥大;GC,手术切除样本中,取无坏死的癌组织,经常规病理切片证实为GC。
1.2方法
1.2.1免疫组织化学SP法检测CXCL10蛋白的表达 CXCL10抗体购自Abcam公司,柠檬酸型抗原修复缓冲液(pH6.0,MVS-0100)、超敏SP试剂盒(KIT-9710)、DAB试剂盒(DAB-0031)、苏木素体细胞快速染色液(CTS-1099)、磷酸盐缓冲液(PBS-0061)和中性树胶(DAB-0033)均购自福州迈新生物技术公司。
标本采用40 g/L 甲醛固定,石蜡包埋,免疫组织化学采用SP法。切片厚度4 μm,置于载玻片上;常规脱蜡,不同浓度的乙醇中脱水至水洗;30 mL/L过氧化氢甲醇溶液室温下孵育10 min,以阻断内源性过氧化物酶活性;山羊血清室温下孵育20 min;柠檬酸型抗原修复缓冲液(pH 6.0)微波修复;PBS洗后滴加一抗(工作浓度为1∶500)50 μL,湿盒内4 ℃孵育过夜,PBS冲洗;滴加SP试剂盒中生物素标记的二抗,置37 ℃ 30 min,PBS冲洗;滴加链霉亲和素辣根过氧化物酶50 μL,置37 ℃ 30 min,PBS冲洗;DAB室温下显色;PBS终止显色;清水冲洗10 min后苏木素复染、脱水、透明、封片、照相。用PBS代替一抗作阴性对照。
1.2.2图像采集和结果判读 切片用Olympus BX 50光学显微镜观察、摄像。用HMIAS-2000高清晰度全自动彩色图像分析系统(武汉千屏影像技术有限责任公司)采集图像并对各CXCL10蛋白表达的阳性染色面积及染色强度进行分析。每张切片随机选择10个视野取平均值。结果判读采用双盲法,并由两位病理医师独立读片评定CXCL10蛋白染色结果,评估参考文献[5]及预实验结果采用综合评分法,根据染色强度及着色面积进行判断。染色强度:0分,无显色;1分,浅黄色;2分,棕黄色;3分,棕褐色。在400倍光镜下随机观察5个不同的视野,按显色细胞比例评分,0分:<5%;1分:5%~25%;2分:26%~50%;3分:51%~75%;4分:>75%。根据以上两项指标得分的和作为判断表达结果,若积分小于或等于1为阴性,2~4为弱阳性,5~7为强阳性。

2 结 果
2.1CXCL10蛋白在CNAG、PL和GC中的表达结果 CXCL10蛋白在这些胃黏膜组织中均有表达,表达部位集中在细胞膜及细胞质中。在CNAG、PL和GC中CXCL10蛋白的表达阳性率分别为:10%(2/20)、26.67%(16/60)、71.67%(43/60);且CXCL10蛋白在CNAG、PL和GC中表达多为淡黄色颗粒(图1),随着CNAG-PL-GC演进过程中,CXCL10蛋白阳性表达率逐渐升高,表达面积逐渐增大。
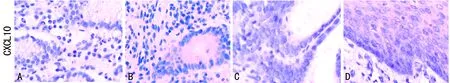
A:CAG;B:CAG伴IM;C:CAG伴Dys;D:GC。
图1 CXCL10蛋白在CNAG 、PL和GC中的表达情况(苏木素复染×400)
2.2CXCL10蛋白在不同病理类型中的表达阳性率的比较 χ2检验发现,CXCL10蛋白阳性表达率在GC组中异常升高,极显著高于CNAG及PL组,差异有统计学意义(P<0.01);而CXCL10蛋白在PL、CNAG两种病理组织中阳性表达率比较,差异无统计学意义(P>0.05),见图2。
2.3CXCL10蛋白表达与PL、 GC患者各临床病理特征的关系 将PL分为CAG伴IM及CAG伴Dys, CXCL10蛋白在两种病理组织中阳性表达率分别为15.0%、32.5%,差异无统计学意义(P>0.05);同时将Dys分为轻中度、重度不典型增生,CXCL10蛋白在两种病理组织中差异无统计学意义(P>0.05)。分别将GC中CXCL10蛋白阳性和阴性病例的各临床病理参数,包括性别、年龄、肿瘤分化程度进行统计分析, CXCL10蛋白在GC组中的表达与年龄无关,差异无统计学意义(P>0.05);而在男性GC组中,CXCL10蛋白阳性表达率显著高于女性,差异有统计学意义(P<0.05);中低分化GC中CXCL10蛋白阳性表达率显著高于高分化GC,差异有统计学意义(P<0.05)。

图2 CXCL10在CNAG、PL、GC病理组织中的阳性表达
3 讨 论
趋化因子是一组结构同源,功能相似,且能趋化细胞定向移动的小分子分泌型蛋白。在趋化因子的分子中都有4个保守的半胱氨酸(C),根据靠近分子氨基端(N端) 的前两个C 间是否插入其他氨基酸,将他们分为CXC、C-C、C及CX3C四类亚族[6],而CXCL10又称为干扰素Y诱导蛋白10,属于CXC类趋化因子,是1985年Luster等[7]首先发现并报道的能使细胞发生趋化运动的小分子细胞因子,其受体为CXCR3,含有2个亚群,即CXCR3A及CXCR3B。CXCR3B含有416个氨基酸,较CXCR3A在NH2-端的包外区长52个氨基酸残基,此种结构的差异导致了CXCR3两种亚群功能的显著不同[8]。当CXCL10与其受体CXCR3结合,经GTP耦联蛋白在机体炎症、肿瘤、自身免疫等疾病中发挥重要的生理和病理效应。尤其在肿瘤形成的生物行为中发挥双向作用:(1)通过抗肿瘤免疫性,抗肿瘤血管生成、诱导细胞凋亡从而起到抗肿瘤的作用;(2)通过促炎效应、促进肿瘤细胞增殖在肿瘤生成、发展的生物行为过程中发挥重要作用[9-10]。近年来,随着CXCL10蛋白研究的不断深入,CXCL10蛋白抗肿瘤机制日渐明朗,但亦有不少研究发现,高表达的CXCL10蛋白与大多恶性肿瘤的发生、发展、侵袭及转移相关,国内外已有大量文献报道[1-2,11],而在GC及其癌前病变中尚无CXCL10蛋白表达及临床病理参数相关性的报道。
本研究采用免疫组织化学SP法和图像分析定量,检测了作为PL的CAG、IM、Dys这三类组织类型中CXCL10蛋白的表达情况,并同时检测了其在CNAG中的表达情况。以期从肿瘤细胞自身的CXCL10蛋白表达水平方面解释由PL发展为GC的可能机制。本研究结果显示,CXCL10蛋白在CNAG、PL、GC三类病理组织中均有表达(阳性表达率分别为10.00%、26.67%、71.67%),而在GC病理组织中的阳性表达率尤其升高,显著高于PL及CNAG组;在PL、CNAG两种病理组织中CXCL10 蛋白阳性表达率差异无统计学意义(P>0.05)。同时研究显示,CXCL10蛋白阳性表达率在CNAG-PL-GC过程中逐渐升高,尤其在GC阶段,提示蛋白CXCL10有可能在胃黏膜的发育中起一定的作用,结果进一步佐证了PL发展成GC是一个逐渐演变的过程。并且CXCL10蛋白与肿瘤发生、发展机制在乳腺癌的研究中得以证实:在癌组织中,CXCL10与CXCR3A受体结合后,能在组织微环境中起作用,同时还能通过自主分泌的方式作用于肿瘤细胞本身,促进肿瘤细胞的生长,另一方面,当CXCL10蛋白与血管内皮细胞CXCR3B受体结合则抑制肿瘤细胞的生长。因此,当患者组织细胞CXCR3A受体占优势,起保护作用的CXCR3B受体处于劣势时,CXCL10蛋白与前者的优势结合介导了肿瘤的发生、发展[9]。
本研究还将CXCL10蛋白表达与临床病理参数统计分析,结果显示,在GC组中男性CXCL10蛋白阳性表达率显著高于女性,差异有统计学意义(P<0.05),而与GC发病年龄无关。该结果再次证实我国男性发病率高于女性,而随着生活及饮食习惯等影响,GC发病年龄越年轻化,各年龄阶段均可见GC的发生,该结果提示临床应该加强普查。同时中低分化GC组中CXCL10蛋白阳性表达率显著高于高分化组,该结果提示CXCL10的表达可能与GC的分化类型相关,通过检测不同分化类型CXCL10的表达在GC预后预测、个体化治疗中可能具有一定的意义。此外,本研究还将PL按CAG是否伴肠化及是否伴异型增生分为两个大组比较,发现CXCL10蛋白阳性表达水平在两组病理组织中差异无统计学意义(P>0.05),CXCL10蛋白的表达与CAG是否伴异型增生及肠化无关。同时将萎缩性胃炎伴不典型增生分为轻中度不典型增生及重度不典型增生,发现CXCL10蛋白的表达在轻中度、重度不典型增生的阳性表达率无明显差异,说明CXCL10蛋白的表达与增生程度无关。
综上所述,CXCL10蛋白与GC的发生、发展密切相关,且 CXCL10蛋白表达与GC的分化程度具有显著相关性, CXCL10蛋白极有可能成为GC诊断预后标志物之一,同时利用分子生物学技术,阻断CXCL10/CXCR3反应轴,可能成为GC治疗的一个新靶点。
[1]段波峰,郑维,唐梅徕,等.CXCR3/CXCL10在乳腺癌中的表达及临床意义[J].中国医师杂志,2011,13(10):1305-1304.
[2]Furuya M,Suyama T,Usui H,et al.Up-regulation of CXC chemokines and their receptors:implications for proinflammatory microenvironments of ov-arian carcinomas and endometriosis[J].Hum Pathol,2007,38(11):1676-1687.
[3]杜中红,魏晓萍,惠起源.胃癌前病变癌变机制及筛查研究进展[J].现代肿瘤医学杂志,2010,4(18):814-816.
[4]Japanese Gastric Cancer Assiociation.Japanese Gastric Cancer treatment guidelines 2010(ver.3)[J].Gastric Cancer,2011,14(3):113-123.
[5]Kodama J,Hasengaowa,Seki N,et al.Expression of the CXCR4 and CCR7 chemokine receptors in human endometrial cancer[J].Eur J Gynaecol Oncol,2007,28(5):370-375 PMID:17966215.
[6]郑红.趋化因子及其受体的功能[J].免疫学杂志,2004,20(1):1-9.
[7]Luster AD,Unkeless JC,Ravetch JV.Gamma-interferon transcriptionally regulates an early-response gene containing homology to platelet proteins[J].Nature,1985,315(6021):672-676.
[8]Lasagni L,Francalanci M,Annunziato F,et al.An alternatively spliced variant of CXCR3 mediates the inhibition of endothelial cell growth induced by IP-10,Mig,and I-TAC,and acts as unctional receptor for platelet factor 4[J].J Exp Med,2003,197(11):1537-1549.
[9]Nagpal ML,Chen Y,Lin T.Effects of overexpression of CXCL10(cytokine responsive gene-2) on MA-10 mouse leydig tumor cell steroidogenesis and proliferation[J].J Endocrinol JT,2004,183(3):585-594.
[10]Bodnar RJ,Yates CC,Wells A.IP-10 blocks vascular endothelial growth factor-induced endothelial cell motility and tubeformation via inhibition of calpain [J].Cric Res,2006,98(5):617-625.
[11]Glodberg-Bittman L,Neumark E,sagi-Assif O,et al.The expression of the chemokine receptors CXCR3 and its ligand,CXCL10 in human breast adenocarcinoma cell lines[J].Immunol Lett,2004,92(1/2):171-178.
