K2CO3/AC常温下脱除密闭空间CO2反应机理
2014-02-02郭亚飞赵传文黎昌海陆守香
郭亚飞,赵传文,黎昌海,陆守香
(中国科技大学 火灾科学国家重点实验室,安徽 合肥 230027)
0 引 言
密闭空间通常是指与外界相对隔离、进出口受限、自然通风不良、足够容纳一人进入并从事非常规、非连续作业的有限空间。大至空间站、航天器、船舱、潜艇和矿井,小到地下室、地下仓库、地铁和公交,密闭空间广泛存在于社会发展和日常生活各个方面[1]。环境大气中的CO2含量对人类生存影响很大,研究表明:自然界中CO2含量只有0.03%左右。当空气中的CO2含量达到0.1%时,人会感到不适;含量达到1%时,人会感到头昏,思维迟钝;含量达到2%时,呼吸次数增加,脉搏加快;含量达到3%时,人的中枢神经机能降低;含量达到5%时,人的正常呼吸难以维持,会发生生命危险[2]。由于密闭空间设计独特且环境易变,人员呼吸代谢、机械设备运行及材料氧化分解产生的CO2容易积聚,尤其是发生事故造成短时间通风换气失效,CO2浓度会骤增。当CO2浓度超过人类生存阈值时,人员健康和安全将受到威胁。因此,室温条件下连续不断清除密闭空间CO2,使其浓度维持在较低水平成为安全技术与工程领域一个极为重要的研究课题。
适用于密闭空间CO2脱除的技术首先需满足高效、安全、稳定的要求,其次应当体积小、重量轻、能耗低、可再生。对于水下密闭空间,还需保持一定的抗湿失效性能[3]。当前,各国研究人员对可能适合密闭空间CO2室温清除技术进行广泛的研究,这些技术从原理上可分为化学吸收法、物理吸附法、分离法、还原法和生物净化法5类。传统化学吸收法主要包括超氧化物、碱石灰和LiOH,其中:碱石灰吸收CO2速度缓慢效率低;LiOH成本高、生成物稳定,不利于二次回收利用;超氧化物具有强氧化性,遇水剧烈反应易爆炸,容易对密闭空间造成二次污染[4]。物理吸附法通常利用不可再生液体单羟乙胺溶液在冷态下吸入CO2,加热到110℃解吸[5]。但是,单羟乙胺泄漏于空气中易造成人员呼吸中毒,危害人体健康。分离技术主要包括分子筛吸附和膜分离:分子筛吸附主要利用沸石装置对CO2浓缩,再通过Sabatier反应还原生成水,该方法结构复杂、操作不便、效率较低且抗湿性能差;膜分离使气体选择性透过,达到分离气体目的,该技术存在体积大、能耗高和风机噪音强等缺点,且膜分离技术稳定性和选择性差,不适用于低浓度CO2分离。虽然分离技术研究起步早且近几年研究火热,但适用于密闭空间CO2分离技术仍处于实验阶段[6]。 Sabatier还原反应主要是在400℃高温下,实现CO2与H2催化反应生成CH4与H2O,并放出热量[7]。由于反应物料和生成物均为燃爆气体且反应放热影响环境温度,该方法用于密闭空间CO2清除存在一定风险性。生物净化技术主要利用生物降解和光合作用实现藻类、菌类、酶类及绿色植物的环境平衡[8],该方法需要大空间放置养殖箱,且植物吸收CO2可控性较差,其实用性并不理想。
目前广泛应用再生型CO2清除技术有MEA(一乙醇胺)和固态胺。固态胺是一种可再生吸附剂,其与水反应生成胺的水合物,再与CO2反应生成碳酸氢盐,具有吸收快,效率高,活性时间长等优点。但固态胺动力学性能较差,再生过程能耗大,在存储和使用条件下,胺基会发生氧化反应和分解反应,造成吸收剂失效,不适合小型密闭空间CO2气体长时间连续脱除[9]。MEA吸收CO2技术相对较成熟,曾广泛应用于各国潜艇上,但MEA装置体积大,能耗大,且MEA易分解、挥发,设备腐蚀严重,还会向密闭空间泄漏MEA,造成二次污染[10]。综上,现有的密闭空间CO2清除技术存在不足之处,高活性、低能耗、可再生CO2清除剂的研究至关重要。
近年来,碱金属基吸收剂干法脱除CO2技术引起了各国研究人员广泛关注,其具有原料成本低、反应能耗低、循环利用效率高、对设备无腐蚀、无二次污染等优点,被认为是极具发展前景的新技术。该技术是利用碱金属碳酸盐(Na2CO3和K2CO3)与CO2/H2O发生碳酸化反应生成碳酸氢盐(NaHCO3和KHCO3),通过升温至120℃~200℃使碳酸氢盐分解再生吸收剂,从而实现CO2循环脱除[11-12]。碱金属基吸收剂脱碳的前期工作主要集中于燃煤电厂烟气CO2捕集[13-23],研究结果表明,在温度为60℃~80℃,CO2浓度为10%~20%条件下,碱金属基吸收剂表现出优越的脱碳性能,其CO2捕集基本原理为碳酸化反应[24-25]。但是,将现有的碱金属基干法脱碳技术应用于密闭空间室温低浓度CO2脱除的研究尚未见报导。
本文利用碱金属基干法脱碳技术的固有优势,设想将其应用于密闭空间内室温低浓度CO2清除。选取K2CO3/AC为典型吸收剂,从理论上分析:K2CO3/AC主要成分为载体AC和活性组分K2CO3。载体AC为多孔介质,对CO2具有一定物理吸附作用;活性K2CO3为碱式碳酸盐,在含H2O气氛中能够与CO2气体发生反应,实现CO2有效脱除。前人研究表明,碱金属基吸收剂脱碳性能与温度、组分浓度等密切相关[26-28]。 鉴于该技术应用于密闭空间CO2脱除(通常CO2浓度低于1%,室温)与传统电厂烟气CO2捕集(10%~20%CO2,60℃~80℃)反应条件的差异,反应条件对其室温低浓度CO2清除机理及特性影响机制尚不明确。本文利用热重分析技术,对比载体AC和K2CO3/AC样品的脱碳性能,研究K2CO3/AC常温脱除低浓度CO2气体的反应机理及反应条件对脱碳特性的影响,研究结果为常温下密闭空间CO2脱除技术提供理论基础。
1 实验部分
1.1 实验材料
实验用K2CO3/AC吸收剂由南京化工集团提供,平均粒径为300 μm,其中K2CO3负载率为24.86%。实验所用高纯CO2(99.99%)和N2(99.99%)由合肥恒隆电气技术有限公司提供。
1.2 实验条件
样品的脱碳反应特性实验在热重分析系统上进行,该仪器配气系统经改造可通入水蒸气。高纯N2和CO2由高压气瓶提供,H2O由高精度微型计量泵提供,经电加热升温蒸发后,与其他气体混合通入反应器。反应系统如图1所示。
在设计基准工况20℃,1%CO2,2%H2O,N2气氛下对载体AC和K2CO3/AC样品进行实验,探
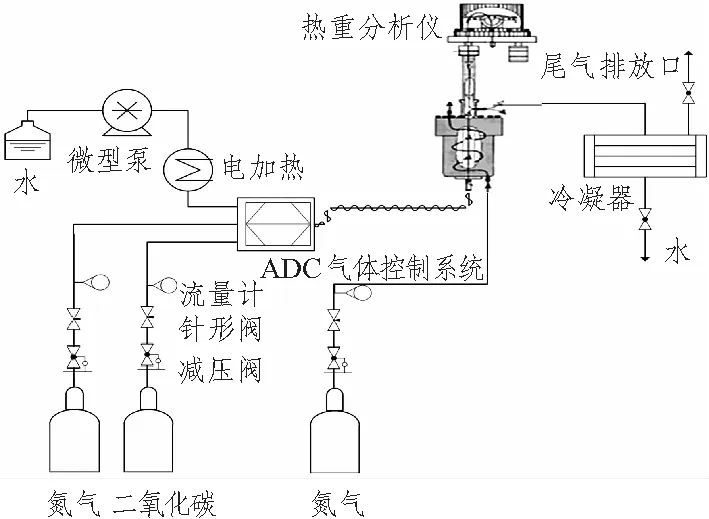
图1 热重分析实验台Fig.1 Schematic of TGA experimental apparatus
究K2CO3/AC室温脱除低浓度CO2反应机理。在K2CO3/AC脱除CO2反应机理基础上,利用单因素分析法对20℃,1%CO2,2%H2O基准工况展开:温度控制在20℃~60℃,CO2浓度控制在0.5%~2%,H2O浓度控制在1%~4%,分别探究温度、CO2浓度和H2O浓度对脱碳反应特性的影响。
2 结果与讨论
2.1 K2CO3/AC脱除CO2机理分析
将载体AC,K2CO3/AC样品分别置于热重分析仪内,温度稳定在20℃,先后进行4组实验,分别通入纯N2,1%CO2+ 99%N2,2%H2O + 98%N2和1%CO2/2%H2O + 97%N2混合气体,AC和K2CO3/AC增重随时间变化曲线如图2所示。

图2 温度为20℃时AC (a),K2CO3/AC (b)对100%N2、 1%CO2+99%N2,2%H2O+98%N2和1%CO2/2% H2O+97%N2吸附Fig.2 Adsorption performance of AC(a) and K2CO3/AC(b) on various mixing gas compositions under 20℃
图2为20℃时,AC和K2CO3/AC对纯N2、1%CO2+ 99%N2、2%H2O + 98%N2和1%CO2/2%H2O + 97%N2的吸附增重随时间变化曲线。随着反应时间持续,AC和K2CO3/AC对上述气体组分吸附呈递增趋势,但质量增率有所差异。AC对上述气体吸附前后质量增率分别为0.25%,0.30%,0.50%和1.00%;K2CO3/AC吸附前后质量增率分别为0.50%,1.00%,4.97%和11.89%。
对比AC和K2CO3/AC吸附100%N2,1%CO2+ 99%N2前后质量增率:载体AC和K2CO3/AC质量增率变化不明显,表明二者对纯N2、1%CO2+ 99%N2吸附作用微弱,其吸附机制主要为载体AC多孔结构的物理吸附。对比AC和K2CO3/AC吸附2%H2O前后质量增率:AC质量增率约为0.50%,几乎未发生变化;而K2CO3/AC质量变化率约达到5%,相比AC吸附作用,差异达10倍。对比AC和K2CO3/AC对1%CO2/2%H2O + 97%N2吸附前后质量增率:AC质量增率接近1.00%,而K2CO3/AC质量增率可达到11.89%,约为前者的12倍。由此推测二者对2%H2O,1%CO2/2%H2O吸附作用机制存在差异。AC对气体的吸附作用主要依靠其内部多孔结构的物理吸附,推测K2CO3/AC对2%H2O,1%CO2/2%H2O吸附除载体AC物理吸附外,还存在化学作用。
东南大学在研究钾基CO2吸收剂的碳酸化反应特性过程中[11],对分析纯K2CO3样品脱碳后产物进行XRD分析测试,结果表明K2CO3在H2O气氛中发生了水合反应,产物为K2CO3·1.5H2O。由此推算实验所用K2CO3/AC样品在该过程中理论水合转化率η(η可用样品反应前后质量增率表示):
式中:α为活性组分K2CO3负载率,24.86%;MK2CO3·1.5H2O为K2CO3·1.5H2O相对分子质量;MK2CO3为K2CO3相对分子质量。
上述分析表明,K2CO3/AC在含H2O气氛中,可通过化学变化实现对H2O吸收,反应的理论水合转化率为4.86%,而K2CO3/AC在吸附H2O前后的质量变化率约为5%。由此可看出,K2CO3/AC对2%H2O吸附除了物理吸附外,主要依靠化学作用,即水合反应。
东南大学在研究钾基CO2吸收剂的碳酸化反应特性过程中发现,K2CO3在H2O/CO2气氛中除了发生上述水合反应外,K2CO3及水合产物K2CO3·1.5H2O还能进一步吸收CO2气体发生碳酸化反应,对应产物为KHCO3。推算实验所用K2CO3/AC样品在该过程中理论碳酸化转化率η(η可用K2CO3反应前后质量增率表示):
式中:α为活性组分K2CO3负载率,24.86%;MK2CO3为K2CO3相对分子质量;MKHCO3为KHCO3相对分子质量。
上述分析结果表明,K2CO3/AC在H2O/CO2气氛中,可通过化学变化实现对CO2吸收,反应的理论碳酸化转化率为11.17%,而K2CO3/AC在对1%CO2/2%H2O吸附前后的质量变化率约为12%。由此可看出,K2CO3/AC对1%CO2/2%H2O吸附除物理吸附外,主要依靠化学作用,即碳酸化反应。
对比AC和K2CO3/AC对100%N2,1%CO2+ 99%N2、2%H2O + 98%N2及1%CO2/2%H2O + 97%N2吸附作用发现,载体AC对上述气体组分吸附量较小,对其单独的脱除机理均为物理吸附,反映载体AC的物理吸附作用较弱。K2CO3/AC对N2和CO2单独吸附主要是依靠AC载体物理吸附作用;而K2CO3/AC对2%H2O和1%CO2/2%H2O的吸附特性受K2CO3影响较大,H2O,CO2/H2O分别与活性成分K2CO3发生了水合反应和碳酸化反应。K2CO3/AC对H2O吸收前后质量增率约为4.97%,水合反应理论转化率为4.86%;K2CO3/AC对1%CO2/2%H2O吸收前后质量增率约为11.89%,碳酸化反应理论转化率为11.17%。由此推测,该过程发生了水合反应和碳酸化反应,K2CO3/AC在1%CO2/2%H2O + 97%N2气氛中脱除CO2机理除了载体AC物理吸附作用外,主要依靠活性组分K2CO3的化学反应。
2.2 反应条件影响
上述K2CO3/AC脱碳反应机理的探究结果与前人对碱金属基吸收剂燃煤电厂烟气低温CO2脱除机理基本一致。碱金属基吸收剂燃煤电厂烟气脱碳主要是在60℃~80℃实现10%~20%CO2清除,本文旨在研究K2CO3/AC用于密闭空间室温低浓度CO2脱除。相比而言,温度和浓度发生较大改变,而温度和浓度变化对吸收剂脱碳特性的影响有待进一步探究。因此,本部分重点阐述温度、CO2浓度和H2O浓度变化对脱碳反应机制及特性的影响规律。
2.2.1 温度对脱碳反应机制及特性影响
控制CO2浓度为1%,H2O浓度为2%,温度为20℃~60℃,利用单因素分析法探究温度变化对反应机理及特性影响。图3显示不同温度下,K2CO3/AC对CO2/H2O捕集前后质量随时间变化关系曲线,反映了温度对吸收剂碳酸化反应特性的影响。

图3 温度对吸收剂碳酸化特性影响Fig.3 Effect of temperature on carbonation characteristics of K2CO3/AC
在1%CO2/2%H2O + 97%N2组分下,随着温度在20℃~60℃内升高,K2CO3/AC对CO2捕集前后质量增率为10.64%~12.97%,总体呈降低趋势。当温度为60℃时,K2CO3/AC质量增率为10.64%,低于理论上碳酸化反应转化率11.17%,高于载体AC物理吸附增率,表明此时物理吸附和化学吸附兼有,化学吸附作用受到抑制。从反应动力学角度分析,碳酸化反应为放热可逆反应,温度升高不利于反应正向进行。从吸附动力学角度分析,温度升高有利于CO2在吸收剂表面和孔结构内部扩散。当温度为30℃时,K2CO3/AC质量增率达到12.97%,高于理论上碳酸化反应转化率,表明化学反应作用较强,相对于物理吸附作用,化学吸附占主导地位,符合动力学原理。
2.2.2 CO2浓度对脱碳反应机制及特性影响
采用单因素分析法研究CO2浓度对碳酸化反应特性影响。实验控制H2O浓度在2%,温度为20℃,CO2浓度在0.5%~2%间变化,对应TGA增重曲线如图4所示。
图4显示了温度为20℃,2%H2O + N2条件下K2CO3/AC对不同浓度CO2/H2O吸收前后质量增率随时间变化规律。随着CO2浓度在0.5%~2%范围内增高,K2CO3/AC对CO2捕集前后质量增率呈递增趋势,变化范围为10.7%~12.2%,与理论上碳酸化反应转化率相接近。当CO2浓度为0.5%时,K2CO3/AC质量增率为10.7%,高于载体AC吸附前后质量增率,低于碳酸化反应理论转化率11.17%,表明此时吸附机制为物理吸附和化学吸附。当CO2浓度达到2%时,K2CO3/AC质量增率最高达到12.2%,高于理论上碳酸化反应转化率11.17%,表明此时化学吸附作用相对突出。从反应动力学角度分析,反应物CO2浓度在一定范围内增加,浓度驱动力增大,有利于碳酸化平衡转化,化学吸附作用随着CO2浓度增加呈现增强趋势。

图4 CO2浓度对吸收剂碳酸化反应特性影响Fig.4 Effect of CO2 concentration on carbonation characteristics of K2CO3/AC
2.2.3 H2O浓度对脱碳反应机制及特性影响
控制CO2浓度为1%,温度为20℃,H2O浓度在1%~4%间变化,采用单因素分析法研究H2O浓度对碳酸化反应特性影响,实验结果如图5所示。

图5 H2O浓度对吸收剂碳酸化反应特性影响Fig.5 Effect of H2Oconcentration on carbonation characteristics of K2CO3/AC
图5显示了温度为20℃,1%CO2+ N2条件下K2CO3/AC对不同浓度CO2/H2O吸收前后质量增率随时间变化规律。随着H2O浓度在1%~4%增大,K2CO3/AC对CO2捕集前后质量增率为10.7%~13.9%,呈递增趋势,表明H2O浓度的提高促进了K2CO3/AC碳酸化性能。K2CO3/AC碳酸化需要等摩尔当量的CO2和H2O参与,H2O含量在一定范围内增加提高了反应物浓度驱动力,有利于碳酸化反应平衡正向移动。
3 结 语
借助热重分析法对K2CO3/AC进行实验,探究其常温脱除密闭空间CO2气体的反应机理,并对影响其脱碳特性的因素进行分析。所得结论如下:
1)K2CO3/AC中载体AC对纯N2,1%CO2+99N2,2%H2O+98%N2和1%CO2/2%H2O+97%N2吸附机制主要为多孔结构的物理吸附作用,且物理吸附特性表现较差。K2CO3/AC对100%N2和1%CO2+99%N2吸附主要依靠载体AC物理吸附作用,其与2%H2O+98%N2和1%CO2/2%H2O+97%N2的作用机制除载体AC物理吸附作用外,主要依靠K2CO3的化学反应,K2CO3是吸收剂脱除密闭空间CO2气体的主要因子。
2)K2CO3/AC在H2O气氛下主要发生水合反应,增量与理论转化率吻合为4.86%,在H2O/CO2气氛下发生碳酸化反应,与11.17%理论转化率吻合。K2CO3/AC室温脱除密闭空间CO2主要通过活性组分K2CO3碳酸化反应实现。
3)随着温度在20℃~60℃范围内增加,K2CO3/AC碳酸化性能呈减弱趋势,捕集CO2质量增率为10.64%~12.97%。随着CO2浓度在0.5%~2%范围内增加,K2CO3/AC碳酸化性能呈递增趋势,捕集CO2质量增率为10.7%~12.2%。随着H2O浓度在1%~4%范围内增加,K2CO3/AC碳酸化性能呈递增趋势,捕集CO2质量增率为10.7%~13.9%。
[1] 汪波,耿世彬,韩旭.封闭空间CO2气体去除技术的研究现状与展望 [J].建筑热能通风空调,2007,26(6):23-26.
WANG Bo,GENG Shi-bin,HAN Xu.Present state and perspectives of research on carbon dioxide removal technology for sealed space[J].Building Energy & Environment,2007,26(6):23-26.
[2] 陈兆文,徐文国,管迎梅,等.潜艇舱室固态胺CO2清除技术的基础理论分析[J].舰船科学技术,2006,28(4):86-90.
CHEN Zhao-wen,XU Wen-guo,GUAN Ying-mei,et al.Basic theoretical analysis for CO2removal in submarine atmosphere by solid amine[J].Ship Science and Technology,2006,28(4):86-90.
[3] 叶青.改性多孔材料常温下吸附分离密闭空间二氧化碳[D].杭州:浙江大学,2012.
YE Qing.CO2adsorption from confined space under ambient temperature by modified porous materials[D].Hangzhou:Zhejiang University,2012.
[4] 姜世楠,马丽娥,王雅娟,等.潜艇舱室CO2净化技术的研究现状与展望[J].舰船科学技术,2010(12):3-6.
JIANG Shi-nan,MA Li-e,WANG Ya-juan,et al.Present state and perspectives of research on carbon dioxide purification technology for submarine′s cabin[J].Ship Science and Technology,2010(12):3-6.
[5] JACKSON P,BESTE A,ATTALLA M.Insights into amine-based CO2capture:an ab initio self-consistent reaction field investigation[J].Structural Chemistry,2011,22(3):537-549.
[6] ZHANG Y,FAN L,ZHANG L,et al.Research progress in removal of trace carbon dioxide from closed spaces[J].Frontiers of Chemical Engineering in China,2007,1(3):310-316.
[7] BROOKS K P,HU J,ZHU H,et al.Methanation of carbon dioxide by hydrogen reduction using the sabatier process in microchannel reactors[J].Chemical Engineering Science,2007,62(4):1161-1170.
[8] BENEMANN J R.Utilization of carbon dioxide from fossil fuel-burning power plants with biological systems[J].Energy Conversion and Management,1993,34(9):999-1004.
[9] 陈兆文,徐文国,黄华尧,等.潜艇舱室固态胺CO2清除技术的动力学分析 [J].舰船科学技术,2007,29(5):105-107.
CHEN Zhao-wen,XU Wen-guo,HUANG Hua-yao,et al.Kinetics analysis for CO2removal in submarine atmosphere by solid amine[J].Ship Science and Technology,2007,29(5):105-107.
[10] 王循良,陈兆文,范海明,等.潜艇舱室SAF吸附CO2影响因素考察[J].舰船科学技术,2011,33(1):104-107.
WANG Xun-liang,CHEN Zhao-wen,FAN Hai-ming,et al.Research on SAF sorption for CO2in submarine[J].Ship Science and Technology,2011,33(1):104-107.
[11] 赵传文,陈晓平,赵长遂.钾基CO2吸收剂的碳酸化反应特性[J].化工学报,2008,59(9):2328-2333.
ZHAO Chuan-wen,CHEN Xiao-ping,ZHAO Chang-sui.Carbonation reaction characteristics of dry potassium-based sorbent for CO2capture[J].Journal of Chemical Industry and Engineering(China),2008,59(9):2328-2333.
[12] LIANG Y,HARRISON D P,GUPTA R P,et al.Carbon dioxide capture using dry sodium-based sorbents[J].Energy & Fuels,2004,18(2):569-575.
[13] LIANG Y.Carbon dioxide capture from flue gas using regenerable sodium-based sorbents[D].Faculty of the Louisiana State University and Agricultural and Mechanical College in Partial Fulfillment of the Requirements for the Degree of Master of Science in Chemical Engineering in The Department of Chemical Engineering by Ya Liang BS, Tsinghua University,2003.
[14] GREEN D A,TURK B S,GUPTA R P,et al.Capture of carbon dioxide from flue gas using solid regenerable sorbents[J].International Journal of Environmental Technology and Management,2004,4(1):53-67.
[15] GREEN D A,TURK B S,PORTZER J W,et al.Carbon dioxide capture from flue gas using dry regenerable sorbents[R].Quarterly Technical Progress Report,2005.
[16] HOFFMAN J S,PENNLINE H W.Study of regenerable sorbents for CO2capture[C].Proceedings of the First National Conference on Carbon Sequestration,Washington,DC.2001.
[17] YI C K,JO S H,SEO Y,et al.Continuous operation of the potassium-based dry sorbent CO2capture process with two fluidized-bed reactors [J].International Journal of Greenhouse Gas Control,2007,1(1):31-36.
[18] LEE S C,CHOI B Y,LEE T J,et al.CO2absorption and regeneration of alkali metal-based solid sorbents[J].Catalysis Today,2006,111(3):385-390.
[19] RYU C K,LEE J B,EOM T H,et al.CO2capture from flue gas using dry regenerable sorbents[C].8th International Conference on Greenhouse Gas Control Technology.Trondheim,Norway,2006.
[20] YI C K,JO S H,SEO Y,et al.CO2capture characteristics of dry sorbents in a fast fluidized reactor[J].Studies in Surface Science and Catalysis,2006,159:501-504.
[21] SEO Y,JO S H,RYU C K,et al.Effects of water vapor pretreatment time and reaction temperature on CO2capture characteristics of a sodium-based solid sorbent in a bubbling fluidized-bed reactor [J].Chemosphere,2007,69(5):712-718.
[22] LEE S C,CHOI B Y,RYU C K,et al.The effect of water on the activation and the CO2capture capacities of alkali metal-based sorbents[J].Korean Journal of Chemical Engineering,2006,23(3):374-379.
[23] SEO Y,JO S H,RYU H J,et al.Effect of water pretreatment on CO2capture using a potassium-based solid sorbent in a bubbling fluidized bed reactor[J].Korean Journal of Chemical Engineering,2007,24(3):457-460.
[24] 赵传文,陈晓平,赵长遂.钾基 CO2吸收剂再生反应特性[J].工程热物理学报,2009(12):2145-2148.
ZHAO Chuan-wen,CHEN Xiao-ping,ZHAO Chang-sui.Characteristics of regeneration reaction of dry potassium-based sorbent for CO2capture[J].Journal of Engineering Thermophysics,2009(12):2145-2148.
[25] 赵传文,陈晓平,赵长遂.碱金属基吸收剂干法脱除CO2技术的研究进展[J].动力工程,2008,28(6):827-833.
ZHAO Chuan-wen,CHEN Xiao-ping,ZHAO Chang-sui.Research progress of CO2capture technology using dry alkali-based sorbents[J].Journal of Power Engineering,2008,28(6):827-833.
[26] LEE S C,CHOI B Y,RYU C K,et al.The effect of water on the activation and the CO2capture capacities of alkali metal-based sorbents[J].Korean Journal of Chemical Engineering,2006,23(3):374-379.
[27] SEO Y,JO S H,RYU C K,et al.Effects of water vapor pretreatment time and reaction temperature on CO2capture characteristics of a sodium-based solid sorbent in a bubbling fluidized-bed reactor[J].Chemosphere,2007,69(5):712-718.
[28] ZHAO C,CHEN X,ZHAO C.K2CO3/Al2O3for capturing CO2in flue gas from power plants.Part 1:Carbonation behaviors of K2CO3/Al2O3[J].Energy & Fuels,2012,26(2):1401-1405.
