慢性乙型肝炎患者抗病毒治疗前后体内TFH细胞的动态变化*
2014-01-30黄春燕朱建芸陈禄彪谢冬英高志良
黄春燕, 邓 洪△, 朱建芸, 陈禄彪, 谢冬英, 高志良
(1中山大学附属第三医院感染科,广东广州510630;2中山大学热带病防治研究教育部重点实验室,广东广州510080;3广东省肝脏疾病研究重点实验室,广东广州510630)
慢性乙型肝炎(chronic hepatitis B,CHB)是一种 常见的危害公众健康的慢性感染性疾病。CHB的治疗中抗病毒治疗是关键[1],而目前对于疗效方面缺乏基线及早期的临床预测指标[2],究其原因可能是造成乙型肝炎病毒(hepatitis B virus,HBV)持续感染的因素十分复杂,涉及病毒本身和宿主免疫状态等多个方面。CHB的发生、发展、转归以及临床预后都与患者的免疫状态相关,体液免疫在机体的抗病毒机制中也发挥了重要作用。2000年研究发现滤泡辅助性 T细胞(follicular helper T cells,TFH)表面特异性标志为CD4+CXCR5+,可分泌白细胞介素21(interleukin-21,IL-21)等多种细胞因子[3]。TFH细胞以及其分泌的IL-21在体液免疫应答中的重要作用。进一步研究发现在免疫激活的CHB患者中外周血CD4+CXCR5+TFH细胞显著升高,CHB的免疫激活可能与TFH细胞有关[4],而已有大量的临床研究证实处于免疫激活状态的CHB患者抗病毒疗效较佳[5-6]。但TFH细胞及相关细胞因子在CHB抗病毒治疗前后的动态变化尚不清楚。本研究旨在探讨CHB患者抗病毒治疗对TFH细胞数量、功能的影响以及TFH与抗病毒疗效的关系。
材料和方法
1 研究对象
35例CHB患者均来自2012年4月至2013年8月中山大学附属第三医院的门诊病例,年龄在18~41岁之间,抗病毒治疗的适应症符合2010《慢性乙型肝炎防治指南》[1],乙肝 e抗原(hepatitis B e antigen,HBeAg)阳性者,乙肝病毒DNA(hepatitis B virus deoxyribonucleic acid,HBV-DNA)>2 ×107IU/L,丙氨酸氨基转移酶(alanine aminotransferase,ALT)>2倍正常上限(upper limit of normal,ULN),干扰素治疗组ALT≤10 ULN,总胆红素(total bilirubin,TBil)<2 ULN,同时排除合并其它类型肝炎病毒感染、人类免疫缺陷病毒感染、酒精性肝病、未经控制的自身免疫性疾病、失代偿期肝硬化、肿瘤、孕妇和其它重要脏器病变(严重甲亢、心脏病等)。治疗过程规律监测和随访。
2 主要试剂和仪器
BD FACS LSRII型流式细胞仪。荧光标记小鼠抗人单克隆抗体anti-CD3-PE、anti-CD4-PB、anti-CXCR5-Alexa 488、anti-IL-21-Alexa Fluor 647 及同型IgG1(κ isotype)-Alexa Fluor 647、佛波酯(phorbol 12-myristate 13-acetate,PMA)、离子霉素(ionomycin)和固定破膜剂&阻断剂brefeldin A均购自BD;淋巴细胞分离液购自Sigma,胎牛血清购自HyClone,RPMI-1640培养液购自Gibco。
3 方法
3.1 样本收集 采用Ficoll分层液法对外周血血浆及单个核细胞(peripheral blood mononuclear cells,PBMC)进行分离备用,分别冻存于-80℃低温冰箱和液氮中。
3.2 细胞内染色及流式细胞术检测 步骤简述如下:用含10%胎牛血清的RPMI-1640培养液调整样本PBMC密度为1×109/L,毎样本管加入刺激物(含 BD GolgiPlugTM)2 μL并置于37 ℃、5%CO2孵箱中4 h。收集细胞先加入anti-CD3-PE、anti-CD4-PB和anti-CXCR5-Alexa 488标记的单克隆抗体,于4℃避光静置30 min进行胞外染色,然后用固定破膜剂,根据说明书对细胞进行破膜处理,破膜洗液洗涤2次后加入anti-IL-21-Alexa Fluor 647标记的单克隆抗体及其同型IgG1于4℃ 避光静置30 min进行胞内细胞因子染色(intracellular cytokine staining,ICS),破膜洗液洗涤2次后,用300 μL的PBS重悬,应用流式细胞检测仪检测细胞,获得的数据用Flow-Jo软件分析。
3.3 生化及病毒学指标 ALT和TBil采用常规生化检测,乙肝两对半采用化学发光法(Roche),HBVDNA定量采用荧光定量PCR方法(ABI)检测。
4 统计学处理
流式数据采用FlowJo 7.6.2流式分析软件分析,SPSS 13.0软件进行统计分析,用GraphPad Prism 5 Demo统计软件进行数据整理和作图。计量资料采用均数±标准差(mean±SD)描述,两组间非参数比较采用Mann-Whitney U检验,多组间非参数比较采用Kruskal-Wallis检验。以P<0.05为差异有统计学意义。
结 果
1 患者基本情况
35例CHB患者均来自2012年4月至2013年8月中山大学附属第三医院的门诊病例(表1),其中聚乙二醇干扰素α-2a治疗21例,替比夫定治疗14例。患者基线HBeAg均为阳性,治疗前(0周)年龄、性别、HBV-DNA和ALT差异均无统计学意义(P>0.05),治疗24周中仅有2例发生血清学转换,治疗随访过程中患者未见严重不良反应。
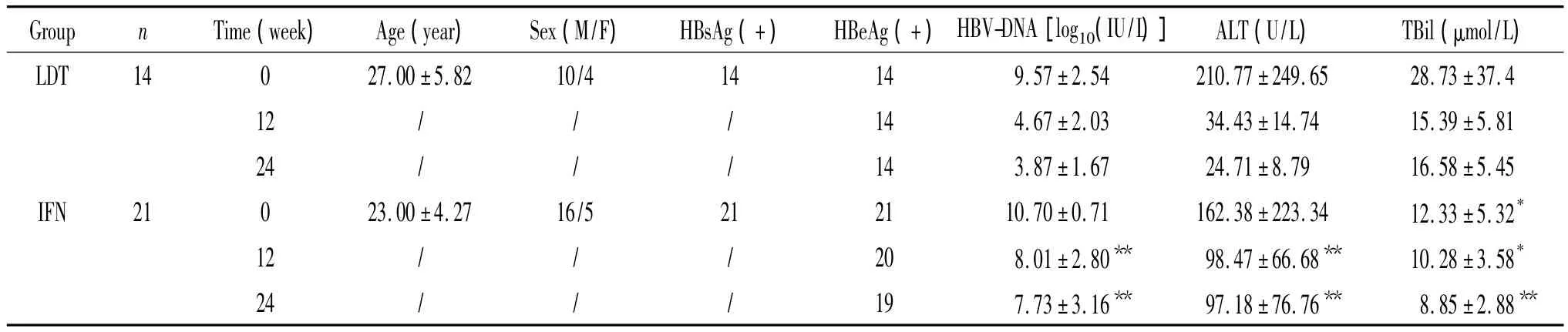
表1 抗病毒治疗过程中病人基本资料Table 1.Clinical characteristics of the study subjects with antiviral therapy(Mean±SD)
2 外周血T淋巴细胞中IL-21主要由TFH细胞分泌
从PBMC中圈出CD3和CD4双阳性细胞,细胞内IL-21的表达主要是 CD3+CD4+T细胞,CD3+CD4-群的细胞(主要是CD8+T细胞)几乎不表达,IL-21在CD4+CXCR5+T细胞中高表达(2.89% ±2.83%),见图1。
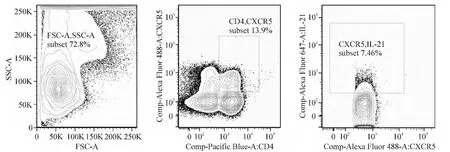
Figure 1.Analysis of IL-21-producing TFHcells by intracellular cytokine staining and flow cytometry.Intracellular IL-21 was produced mainly by CD4+CXCR5+TFHcells.图1 胞内细胞因子染色和流式细胞术检测CD4+CXCR5+T细胞及其胞内IL-21的表达
3 不同抗病毒治疗对TFH细胞和其胞内IL-21的表达水平的影响无明显差异
CHB患者在2种抗病毒治疗24周中,TFH细胞表达水平均有所波动,但不同时点(0周、治疗12周和24周)差异均无统计学意义;TFH细胞分泌IL-21的水平呈下降趋势(但P>0.05)(图2A、B);TFH细胞的表达水平在替比夫定(n=14)和干扰素(n=21)抗病毒治疗中(0周、12周、24周),两者之间差异没有统计学意义(图2C、D)。
4 发生病毒学应答(virological response,VR)与病毒学应答不佳(no virological response,NVR)患者TFH细胞及胞内IL-21表达水平的动态变化
VR(定义为48周内HBV-DNA<1×105IU/L)组和NVR(定义为48周内HBV-DNA>1×105IU/L)组治疗前HBV-DNA差异无统计学意义(P>0.05);VR组治疗12周及24周HBV-DNA较NVR组显著下降(P<0.01),见图3A。TFH细胞在NVR组呈持续上升趋势(但P>0.05);VR组治疗前和治疗12周TFH细胞表达水平均显著高于NVR组(分别P<0.01和P<0.05),见图3B。VR组治疗前IL-21表达水平显著高于NVR组(P<0.05),见图3C。
讨 论
目前认为免疫发病机制是CHB发病的主要机制。前期我们研究证实细胞免疫在CHB中起着重要作用[7-8],而近期有研究显示,在慢性病毒性感染的动物模型中IL-21对特异性细胞免疫功能的维持起重要作用[9]。亦有研究提示在CHB患者中替比夫定抗病毒治疗12周血清IL-21可以预测CHB患者的HBeAg血清学转换[10]。因IL-21是TFH细胞分泌的主要效应因子,从而推测TFH细胞在CHB中发挥了一定的免疫调节功能。而我们研究发现CHB患者使用核苷类似物(替比夫定)或干扰素治疗12周及24周后,2组患者TFH细胞水平变化无明显差别,因两者抗病毒机制不同,故我们推测替比夫定和干扰素对CHB患者TFH细胞影响均是间接作用,或者可能是一种伴随现象。进一步研究发现VR组随着抗病毒治疗HBV-DNA持续下降的同时TFH细胞也随之下降,与之相反,NVR组中TFH细胞持续升高,提示抑制病毒复制可能可以部分恢复TFH细胞的水平。
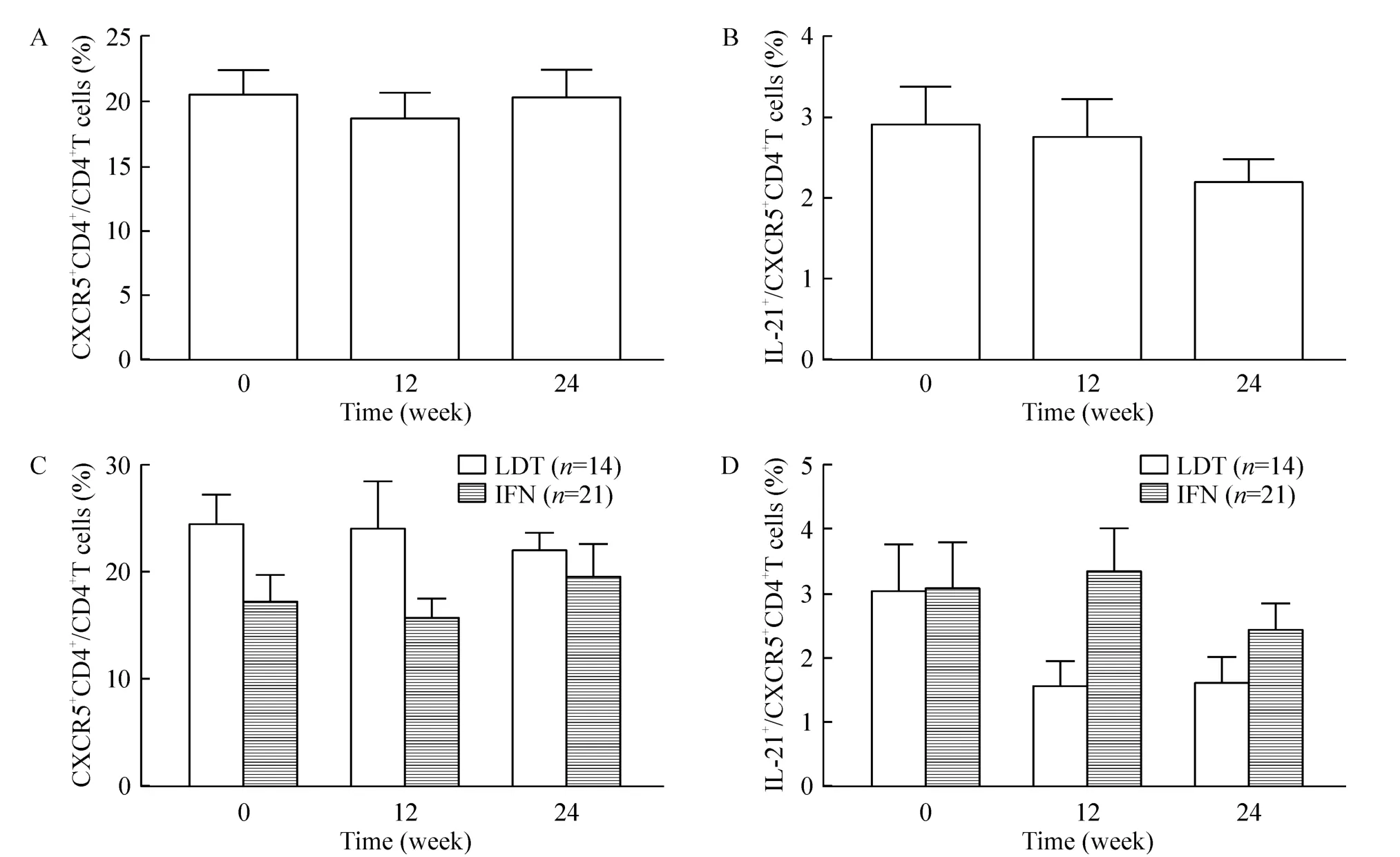
Figure 2.The levels of TFHcells(A,C)and intracellular IL-21(B,D)during antiviral therapy.A,B:overall effects of antiviral therapy(n=35);C,D:respective effects of telbivudine(LDT)and interferon(IFN).Mean±SD.图2 治疗过程中TFH细胞和胞内IL-21的变化

Figure 3.Changes of HBV-DNA(A),TFHcells(B)and intracellular IL-21(C)in virological response(VR)group(n=22)and no virological response(NVR)group(n=13)in 24 weeks.Mean±SD.*P<0.05,**P<0.01 vs NVR.图3 24周内HBV-DNA、TFH细胞和胞内IL-21水平在病毒学应答组和病毒学应答不佳组的变化
有文献报道IL-21对于控制病毒持续感染至关重要[9],在小鼠动物模型中也发现了 IL-21可促进HBV抗原清除[11]。而在本研究中发现VR组TFH细胞在治疗前、治疗12周和24周均高于NVR组,且治疗前VR组IL-21也高于NVR组,提示了治疗前高水平表达的TFH细胞及IL-21将有助于HBV的清除,从而推测TFH细胞通过分泌IL-21促进体液免疫使HBV得到控制,与前面的研究结果一致。近期有研究报道外周血CD4+CXCR5+T细胞通过IL-21使慢性HBV感染患者的e抗原血清转换受益[15]。其机制可能是由于TFH细胞持续表达CXCR5,在CXCR13的趋化下迁移到B细胞滤泡并同时高表达诱导T细胞共刺激分子、Bcl-6(B-cell leukemia/lymphoma 6 protein)和程序性死亡蛋白1,分泌IL-21,执行辅助B细胞的功能[12-15],并协助激活B细胞,调节体液免疫反应,并进一步增强HBV特异性细胞免疫反应,最终促进HBV的病毒清除。
总之,TFH细胞的表达水平与CHB抗病毒疗效相关,测定患者治疗前TFH细胞及其胞内IL-21的表达水平将有助于治疗时机的选择及疗效预测。
[1]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南(2010年版)[J].中华肝脏病杂志,2011,19(1):13-24.
[2]Janssen HL,Reijnders JG.Treatment with nucleos(t)ide analogues in chronic hepatitis B:where does the roadmap lead us?[J].J Hepatol,2009,51(1):1-3.
[3]Breitfeld D,Ohl L,Kremmer E,et al.Follicular B helper T cells express CXC chemokine receptor 5,localize to B cell follicles,and support immunoglobulin production[J].J Exp Med,2000,192(11):1545-1552.
[4]Feng J,Lu L,Hua C,et al.High frequency of CD4+CXCR5+TFHcells in patients with immune-active chronic Hepatitis B[J].PLoS One,2011,6(7):e21698.
[5]Lau GK,Piratvisuth T,Luo KX,et al.Peginterferon Alfa-2a,lamivudine,and the combination for HBeAg-positive chronic hepatitis B[J].N Engl J Med,2005,352(26):2682-2695.
[6]Buster EH,Hansen BE,Lau GK,et al.Factors that predict response of patients with hepatitis B e antigen-positive chronic hepatitis B to peginterferon-alfa[J].Gastroenterology,2009,137(6):2002-2009.
[7]邓 洪,崇雨田,韩晓燕,等.慢性乙型肝炎患者特异性细胞毒性T淋巴细胞的变化[J].中华肝脏病杂志,2006,14(10):721-724.
[8]王 姣,邓 洪,谢冬英,等.HBV特异性CTLs表面CD244和PD-1共表达与慢性乙型肝炎严重程度的相关性[J].中国病理生理杂志,2012,28(12):2254-2260.
[9]Fröhlich A,Kisielow J,Schmitz I,et al.IL-21R on T cells is critical for sustained functionality and control of chronic viral infection[J].Science,2009,324(5934):1576-1580.
[10]Ma SW,Huang X,Li YY,et al.High serum IL-21 levels after 12 weeks of antiviral therapy predict HBeAg seroconversion in chronic hepatitis B[J].J Hepatol,2012,56(4):775-781.
[11]Publicover J,Goodsell A,Nishimura S,et al.IL-21 is pivotal in determining age-dependent effectiveness of immune responses in a mouse model of human hepatitis B[J].J Clin Invest,2011,121(3):1154-1162.
[12]Kim CH,Rott LS,Clark-Lewis I,et al.Subspecialization of CXCR5+T cells:B helper activity is focused in a germinal center-localized subset of CXCR5+T cells[J].J Exp Med,2001,193(12):1373-1381.
[13]Rasheed AU,Rahn HP,Sallusto F,et al.Follicular B helper T cell activity is confined to CXCR5hiICOShiCD4 T cells and is independent of CD57 expression[J].Eur J lmmunol,2006,36(7):1892-1903.
[14]Bryant VL,Ma CS,Avery DT,et al.Cytokine-mediated regulation of human B-cell differentiation into Ig-secreting cells:predominant role of IL-21 produced by CXCR5+T follicular helper cells[J].J Immunol,2007,179(12):8180-8190.
[15]Li Y,Ma S,Tang L,et al.Circulating chemokine(C-X-C motif)receptor 5+CD4+T cells benefit hepatitis B e antigen seroconversion through IL-21 in patients with chronic hepatitis B virus infection[J].Hepatology,2013,58(4):1277-1286.
