脂肪源性干细胞无酶分离培养方法的研究*
2014-01-26史春梦胡玲莉王正国第三军医大学军事预防医学院复合伤研究所创伤烧伤与复合伤国家重点实验室重庆40008第三军医大学大坪医院野战外科研究所四室重庆40004湖北省孝感市9589部队后勤部门诊部湖北孝感4000
刘 苹,史春梦△,胡玲莉,张 波,王正国(1.第三军医大学军事预防医学院复合伤研究所/创伤、烧伤与复合伤国家重点实验室,重庆 40008;.第三军医大学大坪医院野战外科研究所四室,重庆 40004;.湖北省孝感市9589部队后勤部门诊部,湖北孝感 4000)
脂肪源性干细胞无酶分离培养方法的研究*
刘 苹1,2,史春梦1,2△,胡玲莉3,张 波2,王正国2(1.第三军医大学军事预防医学院复合伤研究所/创伤、烧伤与复合伤国家重点实验室,重庆 400038;2.第三军医大学大坪医院野战外科研究所四室,重庆 400042;3.湖北省孝感市95829部队后勤部门诊部,湖北孝感 432000)
目的探索适合临床治疗应用的脂肪源性干细胞(ADSCs)分离培养方法。方法分别采用无酶分离法和胶原酶消化法从脂肪抽吸术抽吸的人脂肪组织中分离培养细胞,对比分析分离的间充质干细胞特性。结果无酶分离法所需时间仅为胶原酶消化法的1/3,分离的细胞在细胞形态学、增殖能力、免疫表型、分化潜能等特性与胶原酶消化法分离培养的细胞一致。结论无酶分离法能够从脂肪抽吸术抽吸的人脂肪组织中分离培养出ADSCs,是一种安全可靠、适合临床应用的ADSCs分离培养方法。
脂肪源性干细胞;分离方法;无酶;胶原酶消化法;细胞,培养的;脂肪组织

王正国
脂肪源性干细胞(adipose derived stem cells,ADSCs)是一种存在于脂肪组织中的间充质干细胞(mesenchymal stem cells,MSCs),在皮下白色脂肪组织中占细胞总量的10%~20%。自Zuk等[1]从人抽吸的脂肪组织中成功分离出ADSCs以来,采用胶原酶、分散酶、胰蛋白酶、透明质酸酶等酶类消化,已经建立了多种ADSCs的分离培养方法,但不同实验室采用不同的分离培养方法获得的干细胞数量、免疫表型、功能等存在一定的差异[2],难以有效地多中心对照研究ADSCs的治疗潜能;分离用的酶类价格昂贵,且多来源于动物或细菌,易对临床应用造成病毒污染或免疫反应;而且这些分离方法耗费时间[3-4]。故建立高效、稳定可靠的、适合临床应用的ADSCs分离培养方法,将推动ADSCs的深入研究和临床治疗的广泛应用[5-7]。因此,本研究在以往分离培养ADSCs方法的基础上,探索无酶分离方法从脂肪抽吸术抽吸的人脂肪组织中分离培养ADSCs,并鉴定分析分离培养细胞的形态、增殖能力、免疫表型、分化潜能等方面指标,为下一步研究与临床应用奠定基础。
1 资料与方法
1.1 一般资料 人脂肪组织来源于临床进行脂肪抽吸术的患者腹部皮下组织,共14例,其中男3例,女11例,年龄(44.0±11.6)岁,均签署知情同意书。本实验经中国人民解放军第三军医大学大坪医院野战外科研究所伦理委员会批准。
1.2 方法
1.2.1 ADSCs的分离培养方法 (1)将收集的人脂肪组织100~300mL置于500mL的玻璃瓶,加入50mL磷酸盐缓冲液(PBS),拧紧瓶盖,用手剧烈震荡2~4min;室温静置约5min使液体与脂肪组织分离,收集瓶底的液体至50mL于离心管内;将漂浮的脂肪组织重复以上步骤漂洗2~4次,收集下层的液体,1 200r/min室温离心10min,收集沉淀。(2)加入2 mL氯化铵红细胞裂解液于沉淀组织中,轻轻吹打混匀,裂解1~2min,加入15~20mL PBS混匀,2 000r/min离心5min,弃红色上清液。(3)细胞沉淀用PBS洗涤2次,按5.0×104个/cm2的密度接种于50mL培养瓶中,加入含10% 胎牛血清(FBS)的DMEM/F12培养基,置于37℃、饱和湿度的5%CO2培养箱内培养。(4)培养24h后全量换液,弃未贴壁细胞,以后根据细胞生长情况,每3天换液1次,待细胞达到80%融合时用0.025%胰酶/乙二胺四乙酸消化传代,隔天换液;倒置相差显微镜观察记录培养细胞生长情况。同时利用0.1%胶原酶消化法分离培养ADSCs作为对照,按照以往研究的ADSCs分离方法进行操作。
1.2.2 ADSCs生物学特性检测 (1)增殖能力:将第3代ADSCs,以细胞计数法绘制细胞的生长曲线。根据公式计算细胞倍增时间:Td=t×[lg2/(lgNt-lgN0)],其中 Td代表细胞倍增时间,t代表培养时间,N0、Nt分别代表接种后及培养t小时后的细胞数,计算平均值得到细胞倍增时间。(2)免疫表型特征:取第4代脂肪组织分离细胞,利用流式细胞分析仪(FCM)检测细胞CD90、CD73、CD14、CD105、CD45等的表达。(3)分离细胞胚层来源:将分离培养的细胞用α-平滑肌动蛋白(α-SMA)抗体和波形蛋白(VIM)抗体进行免疫荧光染色,采用共聚焦激光扫描显微镜(confocal laser scanning microscope,CLSM)观察。
1.2.3 ADSCs的多向分化潜能鉴定
1.2.3.1 向脂肪细胞诱导分化 (1)以5.00×104个/mL密度将第3代ADSCs接种于预先置有盖玻片的6孔板内以制备细胞爬片。(2)细胞达到80%融合后,加入成脂条件培养基(含1μmol/L地塞米松、10mg/L胰岛素、0.50mmol/L 3-异丁基-1-甲基黄嘌呤、10%FBS的高糖DMEM培养基)2mL,置培养箱中培养。(3)隔天换液1次,共诱导28d,对照组加入含10%FBS的低糖DMEM培养液培养。(4)诱导28d后应用油红O染色法检测脂滴形成。
1.2.3.2 向成骨细胞诱导分化 (1)方法同1.2.3.1中的(1)。(2)细胞达到80%融合后,加入成骨条件培养基(含1 μmol/L地塞米松、50μg/mL 维生素 C、10mmol/Lβ-甘油磷酸钠的高糖DMEM培养基)2mL,置培养箱中培养。(3)方法同1.2.3.1中的(3)。(4)诱导28d后应用茜素红染色法检测钙沉积。
1.2.3.3 向成软骨诱导分化 (1)将消化下来的ADSCs用非完全成软骨诱导培养基2 000r/min离心5min,漂洗1次,吸弃上清液。(2)用非完全成软骨诱导培养基按照7.50×105个/mL重悬,用2 000r/min离心5min,漂洗1次,吸弃上清液。(3)将转化生长因子(transforming growth factor,TGF)-β3解冻,加至非完全成软骨诱导培养基,成为完全成软骨诱导培养基(每次使用前现配)。(4)将细胞按照5×105个/mL用完全成软骨诱导培养基重悬,按照每份0.50mL(2.50×105)分装至诱导培养用的离心管内,用2 000r/min离心5min,共做6份。(5)拧松盖子,置细胞培养箱培养;每2~3天用0.50mL完全成软骨诱导培养基换液(避免将细胞吹起)。(6)共诱导14~21d后,用甲醛固定,切片,阿辛蓝染色。
1.2.3.4 油红O染色 (1)取成脂诱导28d的细胞爬片,用PBS清洗2次,每次5min。(2)用4%多聚甲醛固定15min,PBS漂洗2次,每次5min。(3)用60%异丙醇漂洗爬片1次。(4)将油红O染液配制成2%浓度,使用前用滤纸过滤后,滴至细胞爬片上染色15min。(5)吸弃染料,蒸馏水冲洗,镜下观察脂肪细胞形态及染色情况。
1.2.3.5 茜素红染色 (1)取成骨诱导28d的细胞用4%多聚甲醛固定15min。(2)蒸馏水冲洗3次,加入0.1%茜素红Tris-HCl染液(pH 8.3),37℃下染色3~5min。(3)蒸馏水冲洗,干燥,镜下观察成骨细胞形态及染色情况。
1.2.3.6 阿辛蓝染色 (1)将固定的成软骨诱导的细胞球形体切片脱蜡至水。(2)根据需要应用不同pH的阿辛蓝染色浸染切片10~60min。(3)流水冲洗5min左右。(4)脱水,透明并封片,显微镜下观察。
1.2.4 细胞免疫荧光染色 (1)取细胞爬片,PBS漂洗2次,用无水甲醇-10℃固定10min。(2)用PBS充分漂洗3次,加含0.1%Triton-X 100的PBS破膜20min。(3)用PBS充分漂洗3次,加入含10%二抗血清的封闭液封闭30min。(4)滴加稀释适度的一抗(α-SMA抗体1∶400,VIM抗体1∶200稀释),4℃冰箱孵育过夜。(5)用PBS充分漂洗5次,滴加荧光标记的二抗,在湿盒内37℃避光孵育45min。(6)用PBS充分漂洗5次,滴加4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)染色5~10min。(7)滴加甘油封片剂封片,采用CLSM观察。
2 结 果
2.1 ADSCs的细胞形态与增殖 利用无酶分离法可从脂肪组织分离出1.10×104~8.50×104个/mL的活性细胞,需要耗费时间50min左右,而胶原酶消化分离法至少需要150min以上。在DMEM/F12培养基内培养3d左右可增殖形成集落样,第6天细胞能生长至80%~90%的融合,大部分细胞形态为梭形或三角形的成纤维细胞样细胞(图1A),有少量组织碎片;传代第2或3代后细胞形态更单一呈梭形、旋涡状生长,增殖迅速,细胞3~5d可传代,分离培养的细胞可传近8代,而未见细胞形态明显变化(图1B、C),传至10代以上的ADSCs的细胞质变得扁平,增殖速度稍有下降(图1D),但也有部分细胞能够传10代后仍可保持稳定的形态和增殖速度。与胶原酶分离培养的ADSCs未见明显差异。采用细胞计数法绘制的细胞生长曲线显示,无酶法培养条件下第3代的ADSCs有较强的增殖能力,第4、5天细胞能够长满培养板底部,7d内至少可增殖近8倍,生长曲线有明显的增殖期和平台期,计算第3代ADSCs的细胞倍增时间为(61.30±7.30)h,与胶原酶法分离的细胞相似。α-SMA和VIM的表达是中胚层来源组织细胞的重要标志。培养至第3代的ADSCs免疫荧光染色显示,绝大部分细胞均表达α-SMA和VIM(图2),表明从脂肪组织分离获得的细胞来源于中胚层。
2.2 ADSCs的免疫表型特征 无酶法分离细胞的FCM分析结果可见,传至第4代的ADSCs的干细胞或间质细胞标志CD90、CD73、CD105均为阳性,阳性率均在98.00%以上,而造血细胞相关标志CD45和CD14为阴性;CD105+CD45-的细胞在95.00%以上,CD73+CD14-的细胞达98.30%,见图3。表明分离培养获得的细胞是来源于间质的纯度较高的干细胞,并排除造血细胞的污染。
2.3 ADSCs的多向分化潜能 无酶分离法分离细胞经过28 d的成脂诱导培养后,倒置相差显微镜下可见大部分细胞变成圆形、椭圆性或短梭形,细胞质内有较多明亮的脂滴;未经诱导的细胞为长梭形,细胞质内未见脂滴,油红O染色可见成脂诱导后的细胞内有较多橙红色的脂滴(图4A),而未诱导的ADSCs的细胞质内未见脂滴出现。成骨诱导培养后,倒置相差显微镜下可见大部分细胞变成多角形或短梭形,可见沙样颗粒沉积,对照组细胞无特殊变化,茜素红染色可见成骨诱导后的细胞有较多红色矿化基质沉积(图4B),而未诱导的ADSCs未见红色沉积物。进行成软骨诱导的ADSCs第2天可肉眼发现锥形管底部形成白色颗粒,显微镜下为细胞聚集的球形体。在21d的诱导过程中,ADSCs的细胞球形体体积未见明显变化;将21d成软骨诱导分化的细胞进行阿辛蓝染色,可见大多数细胞均显示蓝色(图4C),提示诱导后细胞表达软骨细胞特异性的Ⅱ型胶原蛋白。

图1 倒置相差显微镜下观察分离培养的ADSCs细胞形态(×40)
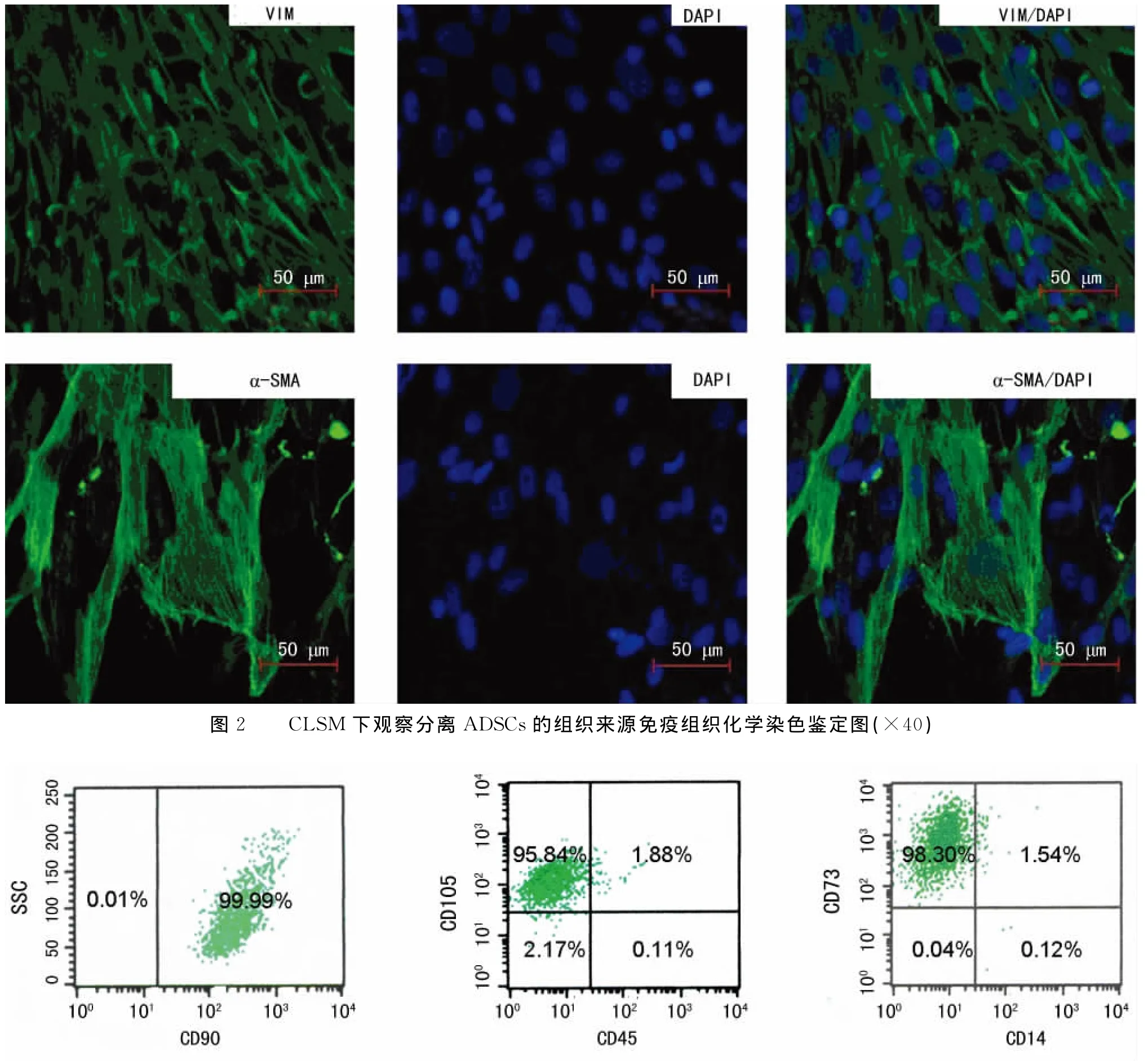
图3 第3代ADSCs免疫表型的FCM分析鉴定图
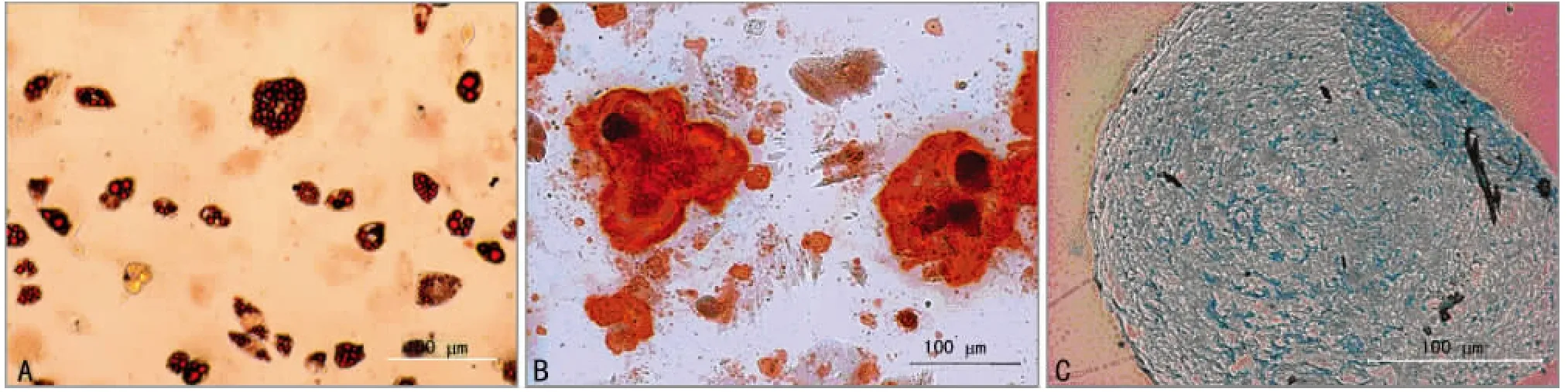
图4 培养ADSCs的多向分化潜能鉴定(×40)
3 讨 论
MSCs是中胚层来源的一类具有多向分化能力的干细胞,目前,MSCs并无特异性的表面标志物,其鉴定主要是根据细胞形态学、生长特征、多种免疫表型及多向分化潜能来综合判断[8]。细胞治疗国际协会认为评判分离的细胞是否为 MSCs的最低标准是[9]:(1)分离的细胞在标准培养条件贴壁生长,细胞形态呈成纤维细胞样细胞;(2)细胞免疫表型的CD105、CD73、CD90、CD166、CD44等分子表达必须大于 95%,而CD45、CD34、CD14或CD11b、CD79或CD19、人白细胞 DR抗原(HLA-DR)等分子表达小于2%;(3)多向分化潜能,细胞在体外特定的诱导培养条件下必须能够分化成骨细胞、脂肪细胞、软骨细胞等中胚层来源细胞。因此,本研究分别从细胞形态、增殖能力、免疫表型、胚层来源、分化潜能等5个方面鉴定采用无酶分离法从脂肪组织分离培养的细胞。
本研究结果显示,从人脂肪组织中分离培养的细胞能够在培养瓶贴壁生长,呈较为均一的成纤维细胞样细胞,与骨髓来源MSCs的细胞形态相似;细胞能传代培养近10代,并保持细胞形态与增殖能力无明显变化;第3代的ADSCs细胞生长曲线显示分离培养的细胞增殖迅速,计算细胞倍增时间为(61.30±7.30)h,与其他人分离培养 ADSCs的研究报道基本一致,与成人骨髓、脐带血、脐带组织等来源MSCs的倍增时间(60h)无明显差异[10-12]。FCM 分析结果可见分离培养细胞的干细胞或间质细胞标志物CD73、CD90、CD105等均为高表达,阳性率均超过95.00%,而造血干细胞抗原标志物CD45和CD14为阴性,提示分离的细胞群具有间充质干细胞的抗原标志而不是造血干细胞,抗体双标FCM分析显示CD105+CD45-和CD73+CD14-的细胞占95.00%以上,进一步确认从脂肪组织分离获得纯度较高的MSCs,与其他组织来源MSCs的免疫表型一致[13]。α-SMA和VIM的表达是中胚层来源组织的重要标志。分离培养的细胞免疫荧光染色结果显示分离培养的绝大部分细胞表达α-SMA和VIM,提示从脂肪组织分离培养的ADSCs来源于中胚层组织。多向分化潜能是MSCs的重要特性[9],向脂肪细胞、成骨细胞、成软骨细胞等中胚层来源细胞分化是鉴定MSCs的必备条件。本研究结果显示,从脂肪组织分离培养的细胞经成脂肪细胞诱导分化后,大部分细胞的油红O染色阳性,经成骨细胞诱导分化后的细胞形成茜素红染色阳性的钙结节,经成软骨细胞诱导分化的大部分细胞经阿辛蓝染色为阳性,提示本研究分离培养的细胞在特定的诱导培养条件下具备向脂肪细胞、成骨细胞和成软骨细胞分化等多向分化潜能。以上结果表明从脂肪组织分离的基质细胞在细胞形态与增殖能力、免疫表型和多向分化潜能上均与广泛接受的MSCs鉴定标准相符合,故无酶分离法从脂肪抽吸术抽吸的人脂肪组织中分离培养的细胞为ADSCs。
本研究结果表明采用无酶分离法从脂肪组织中分离获得的细胞在细胞形态、生长特性、免疫表型、分化潜能等特性方面与文献报道胶原酶消化法分离的ADSCs未见明显差异[14]。虽然无酶分离法分离ADSCs的细胞产量较胶原酶消化法获得的细胞产量明显减少,但耗费时间只有胶原酶消化法的1/3,同时避免了酶消化对细胞的损伤和破坏作用。更重要的是无酶分离法可排除动物或细菌来源的异源性酶类对分离细胞的临床应用造成病毒污染或免疫反应,可望为临床提供适合治疗应用的干细胞。
综上所述,无酶分离法是一种能够从脂肪抽吸术抽吸的人脂肪组织中分离培养出ADSCs的、稳定可靠的、适合临床应用的ADSCs分离培养方法。脂肪抽吸术是一种可以获得大量脂肪组织的安全“微创技术”,通过美容及整形外科去除人体多余脂肪的常用手段,可获得大量的基质干细胞,使ADSCs有望替代骨髓MSCs,而成为细胞治疗多种疾病的干细胞来源[15]。
院士简介:王正国,中国工程院首批院士,美国宾夕法尼亚大学医学院教授会成员。我国野战外科学、冲击伤、创伤弹道学、交通医学研究的主要创始人,在国际上享有较高声誉。1999作为首席科学家主持我国创伤医学研究领域和全军第一个“973”项目。2005年在北京香山会议“再生医学”主题研讨会上首次提出了研究通用型干细胞的设想和目标。先后获得以国家科技进步一等奖为代表的各类奖项20余项。1996年获军队专业技术重大贡献奖,1997年获“何梁何利”奖,1998年获美国“Michael DeBakey国际军医奖”(该奖设立以来获此殊荣的惟一亚洲人),获重庆市首届争光贡献奖,2000年获陈嘉庚奖和国际交通医学重大贡献奖,2002年获第四届中国光华工程科技奖,2009年获吴阶平奖。
[1]Zuk PA,Zhu M,Mizuno H,et al.Multilineage cells from human adipose tissue:implications for cell-based therapies[J].Tissue Eng,2001,7(2):211-228.
[2]Bourin P,Bunnell BA,Casteilla L,et al.Stromal cells from the adipose tissue-derived stromal vascular fraction and culture expanded adipose tissue-derived stromal/stem cells:ajoint statement of the International Federation for Adipose Therapeutics and Science(IFATS)and the International Society for Cellular Therapy(ISCT)[J].Cytotherapy,2013,15(6):641-648.
[3]Zeng G,Lai K,Li J,et al.A rapid and efficient method for primary culture of human adipose-derived stem cells[J].Organogenesis,2013,9(4):1-9.
[4]Mariani E,Facchini A.Clinical applications and biosafety of human adult mesenchymal stem cells[J].Curr Pharm Des,2012,18(13):1821-1845.
[5]Kurita M,Matsumoto D,Shigeura T,et al.Influences of centrifugation on cells and tissues in liposuction aspirates:optimized centrifugation for lipotransfer and cell isolation[J].Plast Reconstr Surg,2008,121(3):1033-1041.
[6]Shah FS,Wu X,Dietrich M,et al.A non-enzymatic method for isolating human adipose tissue-derived stromal stem cells[J].Cytotherapy,2013,15(8):979-985.
[7]Wu CH,Lee FK,Suresh Kumar S,et al.The isolation and differentiation of human adipose-derived stem cells using membrane filtration[J].Biomaterials,2012,33(33):8228-8239.
[8]Zimmerlin L,Donnenberg VS,Rubin JP,et al.Mesenchymal markers on human adipose stem/progenitor cells[J].Cytometry A,2013,83(1):134-140.
[9]Dominici M,Le Blanc K,Mueller I,et al.Minimal criteria for defining multipotent mesenchymal stromal cells.The International Society for Cellular Therapy position state-ment[J].Cytotherapy,2006,8(4):315-317.
[10]Lu LL,Liu YJ,Yang SG,et al.Isolation and characterization of human umbilical cord mesenchymal stem cells with hematopoiesis-supportive function and other potentials[J].Haematologica,2006,91(8):1017-1026.
[11]Alhadlaq A,Mao JJ.Mesenchymal stem cells:isolation and therapeutics[J].Stem Cells Dev,2004,13(4):436-448.
[12]Roobrouck VD,Ulloa-Montoya F,Verfaillie CM.Self-renewal and differentiation capacity of young and aged stem cells[J].Exp Cell Res,2008,314(9):1937-1944.
[13]Vidal MA,Walker NJ,Napoli E,et al.Evaluation of senescence in mesenchymal stem cells isolated from equine bone marrow,adipose tissue,and umbilical cord tissue[J].Stem Cells Dev,2012,21(2):273-283.
[14]Yu G,Floyd ZE,Wu X,et al.Isolation of human adiposederived stem cells from lipoaspirates[J].MethodsMol Biol,2011(702):17-27.
[15]Pikula M,Marek-Trzonkowska N,Wardowska A,et al.Adipose tissue-derived stem cells in clinical applications[J].Expert Opin Biol Ther,2013,13(10):1357-1370.
Study on non-enzymatic separation and culture method of adipose-derived stem cells*
LiuPing1,2,ShiChunmeng1,2△,HuLingli3,ZhangBo2,WangZhengguo2
(1.ResearchInstituteofCombinedInjuries,CollegeofPreventiveMedicine,ThirdMilitaryMedicalUniversity,StateKeyLabofTrauma,BurnsandCombinedInjury,Chongqing400038,China;2.FourthRoom,ResearchInstituteofFieldSurgery,ThirdMilitaryMedicalUniversity,Chongqing400042,China;3.OutpatientDepartmentofLogistics,Unit95829,Xiaogan,Hubei432000,China)
ObjectiveTo explore a separation and culture method of human adipose-derived stem cells(ADSCs)suitable for the clinical application.MethodsThe non-enzymatic method and the collagenase digestion method were adopted to isolate and culture the cells from the human adipose tissue in the individuals with liposuction.The characteristics of isolated mesenchymal stem cells were comparatively analyzed.ResultsThe required time in the non-enzymatic method was one third of that in the collagenase digestion method and the cellular morphology,reproductive capacity,immunophenotype and differentiation potential of the isolated cells were consistent to those isolated by the collagenase digestion method.ConclusionThe no-enzymatic method may isolate and culture ADSCs from the adipose tissue in the individual with liposuction,which is a safety and reliable isolation and culture method of human adipose tissue-derived stem cells suitable for clinical application.
adipose derived stem cells;separation method;no-enzymatic;collagenase digestion method;cells,cultured;adipose tissue
10.3969/j.issn.1671-8348.2014.10.001
A
1671-8348(2014)10-1153-04
国家重点基础研究发展计划(973)专项课题资助项目(2011CB964701);重庆市科技攻关(重点)资助项目(cstc2012GGB10003)。
刘苹(1971-),高级实验师,硕士研究生,主要从事再生医学和分子生物学研究。△
,Tel:13708396812;E-mail:shicm1010@aliyun.com。
2013-10-08
2013-12-19)
论著·临床研究
