肿瘤坏死因子α在超重者脂肪组织中的表达
2014-01-23何衡杰
何衡杰 郝 丽
安徽医科大学第二附属医院肾内科,安徽合肥 230601
近年来许多研究证实了肿瘤坏死因子与胰岛素抵抗有关,且肥胖者脂肪分泌的肿瘤坏死因子可能是正常者的数倍。但对于为数众多的超重者,相关文献相对较少。本实验旨在观察是否超重者脂肪组织也存在TNF-α基因表达增强,正常及超重者腹部皮下脂肪组织及网膜脂肪组织的TNF-α基因表达有无差异。
1 对象与方法
1.1 研究对象
均为在安徽医科大学第二附属医院普外科做手术的安徽汉族人,排除了感染、肝脏疾病及其他内分泌代谢疾病等。实验的分类标准为《中国成人超重与肥胖症预防与控制指南》,2003年该指南由中国肥胖问题工作组编写,超重组19人,BMI在24~28 kg/m2之间,年龄为22~75岁,平均年龄 48.9岁;正常组 24人,BMI在18.5~24 kg/m2之间,年龄为 33~70岁,平均年龄为51.2岁;二组年龄及性别基本匹配。
1.2 方法
1.2.1 手术时取腹部皮下、网膜脂肪组织,取样后用液氮迅速冷冻并低温保存。按QIAGEN公司提供RNeasy Mini Kit试剂盒说明书要求提取脂肪组织总RNA。紫外分光光度仪测定及琼脂糖电泳判断RNA质量。根据基因特异性cDNA序列,通过软件primer 5.0设计特异性扩增引物,扩增TNF-α基因的特异性引物,上游序列为:5ˊ-GTGACAAGCCTGTAGCCCAT-3ˊ,下游序列为:5ˊ-TAGATGGGCTCATACCAGGG-3ˊ,扩增片段长度331bp;扩增β-actin基因的引物,上游序列为:5ˊ-GCTATCCAGGCTGTGCTATC-3ˊ,下游序列为:5ˊ-CAGCACTGTGTTGGCGTACA-3ˊ,扩增片段长度495 bp。RT-PCR:总RNA2 uL,5倍逆转录反应缓冲液4 uL,Oligo(dT)18 2.5 uL,RNA酶抑制剂0.5 uL,逆转录酶AMV 2 uL,dNTP 8 uL,加DEPC处理水至 20 uL,28℃放置 10 min,42℃温育2 h,99℃5 min灭活逆转录酶。PCR反应体系中包括:模板10 uL,10倍PCR反应缓冲液5 uL,4种混合单核苷酸4 uL,肿瘤坏死因子上下游引物及β-actin上下游引物各1.0 uL,Taq酶0.7uL,加DEPC处理水至反应总体积50 uL。第一步:94℃预变性1 min;第二步:30个循环即 94℃变性 32s,59.9℃退火 40s,72℃延伸 1 min;第三步:72℃再延伸4 min[1]。1.2%的琼脂糖凝胶电泳反应产物,通过凝胶成像分析系统来测定每个单独条带的亮度,并在此基础上计算出条带的光密度比值(TNF-α/β-actin),见图1。
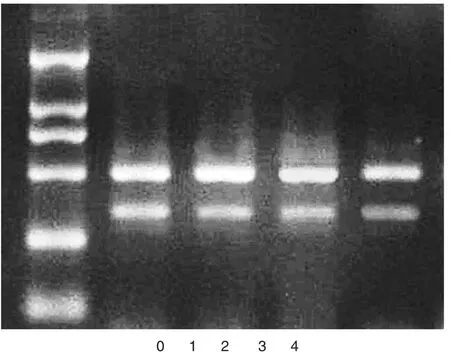
图1 PCR产物电泳图
0:分子量标准DL 2,000;1-4:腹部皮下及网膜脂肪组织中TNF-α和β-actin基因PCR产物。
1.2.2 测身高、体重,腰围(腰围测量是以腋中线肋下缘与髂骨上缘间中点水平周长)、臀围(臀围为以耻骨联合水平测量臀部的最大周长),并在以上的基础上计算腰臀比例和体重指数。
1.3 统计学处理
采用SPSS 10.0统计软件进行统计学处理,组间比较采用t检验,相关因素采用线性相关分析。
2 结果
2.1 各组光密度比值之间的两两比较
TNF-α基因在超重组的皮下脂肪组织表达变化较正常组略有增强,但差异无显著性(P>0.05);TNF-α基因在网膜脂肪组织的表达变化比正常组也略有增强,差异无显著性(P>0.05);所以说,在超重组和正常组中,皮下与网膜的基因TNF-α表达变化的差异没有统计学意义(P>0.05)。
2.2 TNF-α基因在皮下与网膜的表达与各指标的双变量相关性分析
皮下的 TNF-α 基因表达与 WC(γ=0.420,P<0.05)、WHR(γ=0.416,P<0.05)成正相关;网膜的 TNF-α 基因表达与 WC(γ=0.360,P<0.05)、WHR(γ=0.368,P<0.05)成正相关;BMI、AGE 与两种组织的TNF-α基因表达没有相关性(见表1)。
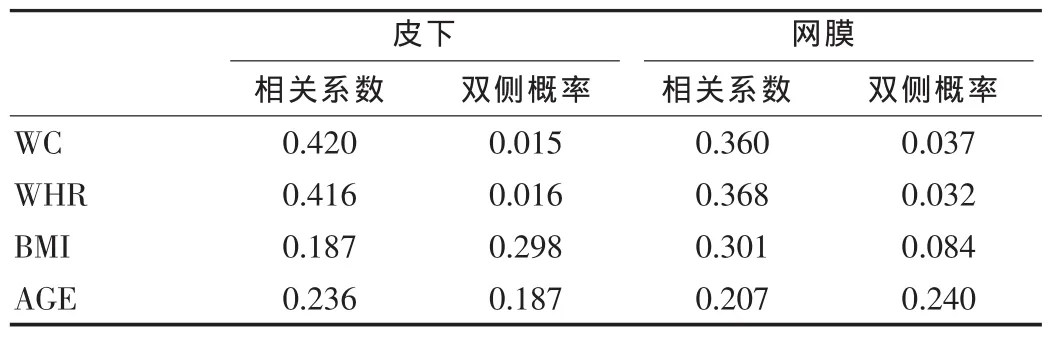
表1 皮下与网膜的TNF-α基因表达与各指标的双变量相关分析
3 讨论
脂肪组织的细胞在发生肿瘤时会表达和释放一种产物叫肿瘤坏死因子,其中TNF-α基因可能存在两种分泌途径,即旁分泌和自分泌,从而刺激脂肪细胞发生分解消失,另外会通过减少LPL的生成并减弱其活性,从而生成脂肪细胞的能力变弱,还会通过干扰诱导前脂肪细胞的分化和刺激成熟脂肪细胞逆分化两种方式来阻扰脂肪细胞发生分化,从而使得前脂肪细胞和脂肪细胞的凋亡速度加快,最终防止扩大了脂肪组织的整个体积[2-3]。
近年来,有一些关于TNF-α基因表达与肥胖和超重的研究。首先,前人发现在肥胖组的脂肪组织中TNF-α基因表达量有所增加,而随着体重的减轻,基因TNF-α表达量随之减少[4]。然而在对人类的研究上发现分歧:BMI为体重指数,其中BMI>30kg/m2为超重组,BMI<25 kg/m2为正常组,对两组对比发现,超重组的皮下和细胞中TNF-a基因会过度表达,约为对照组中TNF-a基因表达的2.5倍[5],Bullo等对96例妇女的研究表明,TNF-α基因表达与脂肪容量成比例关系[6];但也有不同的结果,前人对39位体重指数各异的人为研究对象,结论是BMI与脂肪组织中TNF-α基因表达变化呈现出正相关只限于体重指数介于27~45kg/m2者,高度肥胖者则不在此列[7];得出相反的结论是Koistinen和李晓男等的研究,显示消瘦和肥胖者皮下脂肪组织的TNF-α基因基因表达基本无差异[8-9],本实验通过对19例超重者和24例对照者的研究显示超重组皮下脂肪组织TNF-α基因表达比正常体重组略有增强,没有统计学意义,与前人结果相符。但是还存在不同的研究结果,Montague等通过试验发现人体腹部的皮下和网膜的TNF-α基因表达是一致的[10];本实验中网膜的TNF-α基因表达较正常组也略有增强,但同样无显著性差异;超重组与正常组的皮下与网膜之间的TNF-α基因表达比较发现,P值均大于0.05,差异不显著,与Montague等的结果相符。两组合并后相关分析显示WC、WHR与在皮下及网膜中表达基因TNF-α的变化相关性为正向的,与BMI、AGE与此基因无相关性。提示两种脂肪组织TNF-α基因表达随中心性肥胖体型的趋势而上升,并且和体重指数具有密切的关系。
本实验通过对超重者19例和对照者24例的比较研究显示:超重组皮下及网膜脂肪组织的TNF-α基因表达无明显增强,无论是超重组还是正常组,皮下与网膜之间的TNF-α基因表达比较,不存在统计学意义。
[1]胡国平,刘铃,王佑民,等.肥胖症患者皮下和网膜脂肪组织中PPARγ2的表达与血浆瘦素、肿瘤坏死因子α和游离脂肪酸的关系[J].安徽医学,2005(4):257-260.
[2]孙晖.生活方式干预对胰岛素抵抗大鼠脂肪组织肿瘤坏死因子α及其受体表达的影响[D].华中科技大学硕士学位论文,2007.
[3]曹艳丽.脂肪组织中肿瘤坏死因子-α与血浆纤溶酶原激活抑制物-1相关性的研究[D].安徽医科大学硕士学位论文,2008.
[4]郑娜.4-羟基异亮氨酸抑制TNF-α表达改善胰岛素抵抗[D].华中科技大学硕士学位论文,2013.
[5]Rupert Oberauer,Wolfgang Rist,Martin C.Lenter,et al.EGFL6 is increasingly expressed in human obesity and promotes proliferation of adipose tissue-derived stromal vascular cells[J].Molecular and Cellular Biochemistry,2010(343):257-269
[6]Bullo M,Garcia-Lorda P,Peinado-Onsarbe J,et al.TNF alpha expression of subcutaneous adipose tissue in obese and morbid obese females:relationship to adipocyte LPL activity and leptin synthesis[J].Int J Obes Relat Metab Disord,2002,26(5):625-628.
[7]何衡杰.肿瘤坏死因子α在超重者脂肪组织中的表达[D].安徽医科大学硕士学位论文,2005.
[8]Koistinen HA,Bastard JP,Dusserre E,et al.Subcutaneous adipose tissue expression of tumour necrosis factor-alpha is not associated with who insulin resistance in obese nondiabetic or in type-2 diabetic subjects[J].Eur J Clin Invest,2000,30(4):302-310.
[9]李晓南,陈荣华,Tommy Olsson,et al.人类皮下和网膜脂肪组织脂肪细胞因子的表达[J].江苏医药,2005(12):914-916,880.
[10]Montague CT,Prins JB,Sanders L,et al.Depot-related gene expression in human subcutaneous and omental adipocytes[J].Diabetes,199 (47):1384-1391.