纳豆芽孢杆菌和好食性脉胞霉混合固态发酵玉米黄粉饲料
2014-01-22文奇男陈伟康刘晓兰张永根郭建华
■王 燕 文奇男 陈伟康 刘晓兰 刘 骥 张永根 郭建华
(1.齐齐哈尔大学食品与生物工程学院,黑龙江齐齐哈尔 161006;2.辽宁省农牧业机械研究所有限公司,辽宁沈阳 110036;3.东北农业大学动物科技学院,黑龙江哈尔滨,150030)
我国饲料工业中蛋白饲料短缺现象比较严重,因此需要广泛开发新的蛋白质资源,利用微生物发酵法生产高蛋白饲料是解决目前饲料蛋白质资源匮乏的有效途径。我国玉米年产量达1.2×108t,约占世界总产量的22%,因此玉米加工淀粉的副产物玉米黄粉含量丰富,且玉米黄粉蛋白含量可达到60%以上,氨基酸总量高于豆粕和鱼粉,且代谢能高于玉米。但是其蛋白主要是以醇溶蛋白为主,占蛋白总量的68%,水溶性差,不易被吸收,适口性差,且氨基酸不平衡,因此限制了玉米黄粉的有效利用。
酶法和微生物发酵法都可以有效酶解玉米黄粉,但是酶法水解肽味苦,微生物发酵可以改善玉米黄粉风味,且成本较低,因此利用微生物固态发酵玉米黄粉是提高玉米附加值的必然趋势。与液态发酵相比,固态发酵设备构造简单、投资少、能耗低、便于推广。庞铮采用好食性脉孢霉发酵玉米黄粉制作发酵饲料,显著提高可溶性蛋白含量,并饲喂鹌鹑,降低了饲料成本。李秀梅通过诱变筛选出产蛋白酶高的纳豆芽孢杆菌发酵玉米黄粉,以鹌鹑为试验动物,得出在全价配合饲料中添加45%的纳豆杆菌浓醪发酵玉米黄粉可以提高鹌鹑的生长性能,降低饲料成本。闫亚婷等采用纳豆芽孢杆菌发酵玉米黄粉显著提高蛋白质溶解度和可溶性糖含量,从而改善玉米黄粉的饲用品质。郑喜群等通过对纳豆杆菌发酵玉米黄粉产生抗氧化活性肽的研究,确定了纳豆杆菌发酵玉米黄粉的适宜工艺条件,使玉米黄粉的可溶性蛋白质含量达到23.67 mg/ml。
许多研究表明,微生物发酵饲料对菌种依赖性较大,因此需要选育优质菌株。菌株的选择要从菌株特性(分类、来源、纯度、发酵特性)、安全性资料(毒理、药理)、健康效应及研究结果等方面综合考虑。由于微生物酶系互补,因此复合菌种发酵效果优于单菌种发酵。好食性脉孢霉是本实验室自主研发的一类对底物和环境要求较低,且能利用多种碳源的高产蛋白酶的安全菌株,目前已申请发明专利。王晓杰等用好食性脉孢霉对玉米酒糟进行固态发酵,料液比1∶1.2,接菌量1×106个孢子/g干基,初始pH值7.5,温度为30℃,发酵96 h,测定发酵浸提液蛋白溶出率为36.30%,比发酵前提高28.96%,粗纤维含量减少30.32%。
纳豆芽孢杆菌,具有较强的抗菌活性,但是却能与其他益生菌搭配使用以提高发酵饲料性能。将纳豆芽孢杆菌与3株乳酸菌混菌发酵进行体外厌氧培养研究,结果表明纳豆芽孢杆菌通过产生过氧化氢酶和枯草蛋白酶促进乳酸杆菌的生长和活性。牛丽亚等研究发现,纳豆芽孢杆菌和啤酒酵母混菌发酵麦麸、玉米黄粉和豆粕的混合物比单菌株发酵产物稳定。
本课题以玉米黄粉为主要原料,麸皮为辅助原料,以好食性脉孢霉和纳豆芽孢杆菌为菌株,采用单因素法对发酵玉米黄粉的条件进行优化,最大限度地提高玉米黄粉的蛋白溶解性,提高玉米黄粉的附加值,为缓解资源短缺和提高原料利用率做贡献。
1 材料和方法
1.1 试验菌种
纳豆芽孢杆菌和好食性脉孢霉由齐齐哈尔大学生物工程实验室提供。
1.2 培养基
纳豆菌液体种子培养基:葡萄糖2%,K2HPO40.1%,MgSO40.05%,5%(v/v)的土豆汁(20%比例配制),pH值7.0。
脉孢霉液体种子培养基:K2HPO40.05%,10%(v/v)的土豆汁(20%比例配制),pH值6.4。
发酵培养基:玉米黄粉∶麸皮=8∶2,料水比=1∶1.6,pH值自然。
1.3 试验方法
1.3.1 纳豆杆菌种子生长曲线的确定
本试验在温度为37℃、装液量为50 ml(250 ml锥形瓶)、摇瓶转速为200 r/min的条件下培养,每4 h取一次样,在560 nm波长下测定吸光度,再根据菌体浓度标准曲线算出菌体浓度。以时间为横坐标,菌体浓度为纵坐标,作图。
1.3.2 脉孢霉种子生长曲线的确定
在玉米浆10%(v/v),K2HPO40.05%(w/w),摇床转速180 r/min,锥形瓶装样量60 ml/250 ml,接菌量6.0×106个/ml,30℃,初始pH值6.4的条件下培养。每4 h取样一次,用重量法测出它的菌体浓度。以培养时间为横坐标,菌体浓度为纵坐标,绘制种子培养基中菌体的生长曲线。
1.3.3 发酵培养基的优化
以8 g玉米黄粉+2 g麸皮为发酵底物,料水比=1∶1.6,菌体混合比(w/w,纳豆菌∶脉孢霉)=5∶5,两种菌同时接到发酵底物上,接种量0.23%(w/w),30℃,pH值自然,培养时间40 h。以上述条件为基础,采用单因素试验优化料水比、菌体混合比、接菌先后顺序及间隔、接种量、发酵温度、发酵时间。
2 结果与分析
2.1 纳豆杆菌生长曲线的确定(见图1)
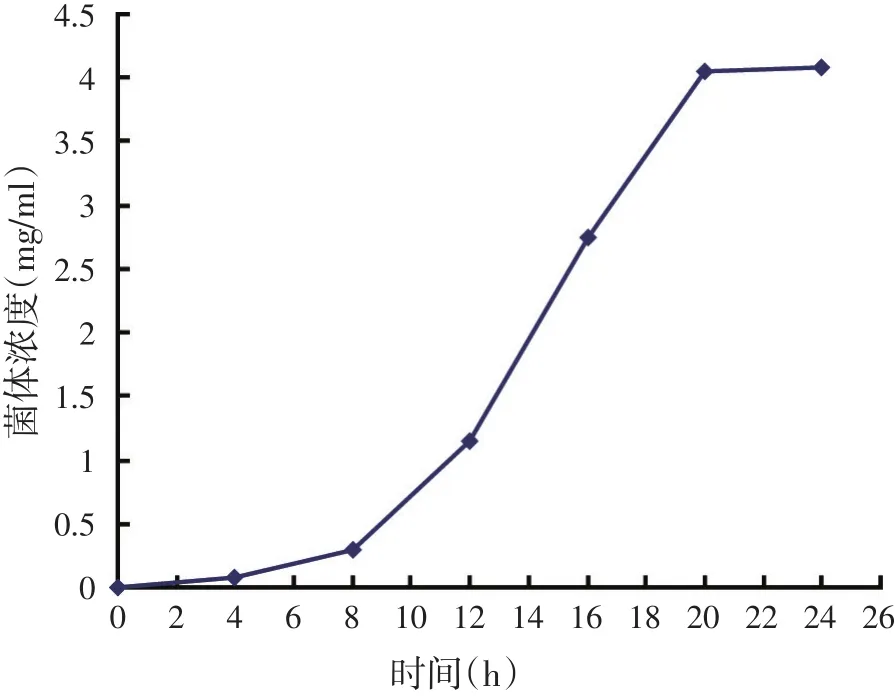
图1 纳豆菌的生长曲线
由图1可知,在0~8 h,纳豆芽孢杆菌处于适应期,从第8 h开始,纳豆菌开始快速生长,直到20 h,纳豆菌开始进入稳定期。对数期的菌体生长迅速,对环境适应力强,适合接种。对数期后期也符合这个条件,而且有较高的菌体浓度,能缩短在发酵培养基中的培养时间。综上所述,纳豆杆菌的适宜种龄为19 h,此时菌体浓度为3.96 mg/ml。
2.2 好食性脉孢霉生长曲线(见图2)
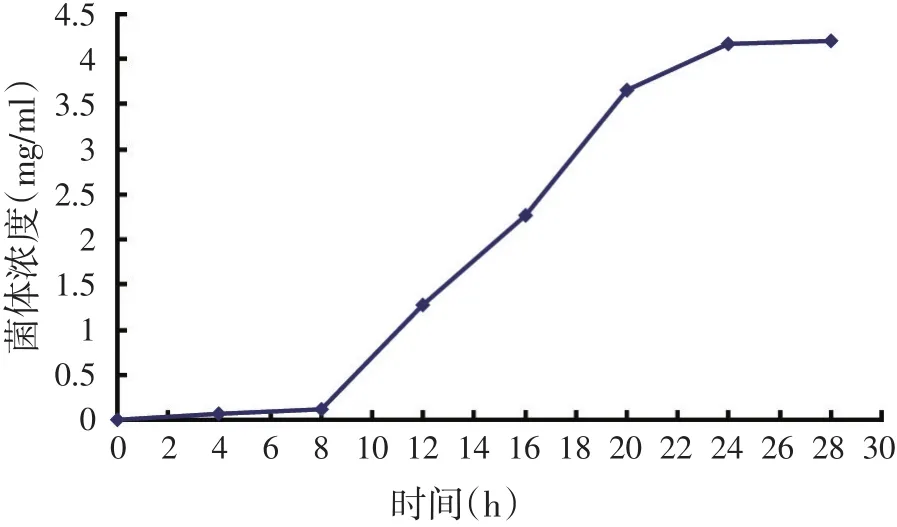
图2 好食脉孢霉的生长曲线
由图2可以很明显看出,在0~8 h脉孢霉处于生长适应期,主要是菌体吸水膨胀,子囊消失的过程。从第8 h开始,菌体生长迅速,进入生长对数期,一直到20 h。20~24 h菌体生长依然比较快,可能由于菌体浓度过高,营养物质变少,菌体之间的竞争性抑制开始变得显著,菌体浓度增长趋于平缓。从24 h开始,菌体浓度几乎没有变化,进入了生长稳定期。综上所述,因此选择20 h为脉孢霉最佳种子培养时间,此时菌体浓度为3.65 mg/ml。
2.3 混菌发酵培养基的优化
2.3.1 发酵培养基培养时间的优化
在微生物发酵过程中,产物浓度会有所变化,培养到一定时间会使产率达到最大,继续培养,产率则会减小。因此要获得发酵产物,需根据不同菌种和不同底物来确定最佳发酵时间。以8 g玉米黄粉加2 g麸皮为发酵底物,料水比=1∶1.6,菌体混合比(w/w,纳豆菌∶脉孢霉)=5∶5,两种菌同时接到发酵底物上,接种量0.23%(w/w),30℃,pH值自然,培养时间分别为0、12、22、32、40、46、58、70、82 h。充分拍打发酵锥形瓶,使发酵培养基松散,再往发酵锥形瓶中分别加50 ml生理盐水,浸提4 h,然后测定可溶性蛋白含量,并计算出蛋白增加量(选择用可溶性蛋白增加量来衡量培养条件的好坏,可忽略底物不同而引起的培养基蛋白含量不一致的问题)。试验结果如图3。
从图3可知,0~12 h,可溶性蛋白增加缓慢,12~40 h,可溶性蛋白增加量比较大,当培养40 h时,可溶蛋白为9.9 mg/ml。到了40 h以后,由于营养物质消耗比较多,40~58 h可溶性蛋白增加量降低。但58~70 h时,发酵浸提液中可溶性蛋白增加量又增多,并在70 h时达到最大,为10.4 mg/ml,这可能是由于菌体出现了二次生长的原因,再次利用了发酵底物中的氮源,合成新的蛋白质。培养基在35 h后,开始依稀有纳豆的味道,70 h时,有大量乳白菌丝生成,培养基有异香。

图3 培养时间对可溶性蛋白增加量的影响
由于培养40 h和70 h可溶性蛋白含量增加量差别不大,考虑到工业上需要控制生产成本和提高设备利用率,选择培养时间为40 h。
2.3.2 发酵底物中麸皮与玉米黄粉添加比例优化
培养基是微生物发酵的基础,它为微生物提供生长繁殖所必需的营养物质。玉米黄粉营养丰富,但成粉末状,加水易结块,不利于空气流动和菌体发酵。麸皮价格低廉,添加它能降低成本,并且能使发酵培养更松散,透气性更好,需要研究它的添加比例。
在250 ml锥形瓶中装入麸皮和玉米黄粉共10 g,麸皮∶玉米黄粉分别为1∶9,2∶8,3∶7,4∶6,5∶5,料水比=1∶1.6,菌体混合比(w/w,纳豆菌∶脉孢霉)=5∶5,两种菌同时接到底物上,接种量0.23%(w/w),30℃,pH值自然,培养时间40 h。振荡发酵锥形瓶,使发酵培养基松散,再往锥形瓶中分别加50 ml生理盐水,浸提4 h,然后测定可溶性蛋白含量,并计算出蛋白增加量。试验结果如图4所示。

图4 不同比例辅料添加对可溶性蛋白增加量的影响
麸皮的蛋白含量比玉米黄粉蛋白少很多,因此可被菌体利用的营养物质少,大量添加降低发酵产物营养成分,所以它只能作为辅料少量添加。从图4可知,当麸皮∶玉米黄粉为3∶7或者更高时,可溶性蛋白增加较少。当麸皮∶玉米黄粉为2∶8时,可溶性蛋白增加量最多。此时的培养基营养物质比较丰富,而且透气性好,适合作为发酵底物配方。当玉米黄粉∶麸皮为9∶1时,加水后易结块,透气性不好,因而影响菌体发酵。
2.3.3 菌体混合比例的优化
纳豆芽孢杆菌繁殖速度要比好食性脉孢霉快,好食性脉孢霉的芽孢个体要比纳豆芽孢杆菌个体大,因此最适培养条件有一定差别。要让它们在相同的培养条件下,更好更快的利用底物来发酵,需要一个适宜的菌体混合比。
菌体混合比(w/w,纳豆菌∶脉孢霉)分别为1∶9,3∶7,5∶5,7∶3,9∶1,2 g麸皮+8 g玉米黄粉,料水比=1∶1.6,两种菌同时接到发酵培养基中,接种量0.23%(w/w),30 ℃,pH值自然,培养时间40 h。振荡发酵锥形瓶,使发酵培养基松散,再往锥形瓶中分别加50 ml生理盐水,浸提4 h,然后测定可溶性蛋白含量,并计算出蛋白增加量。试验结果如图5所示。
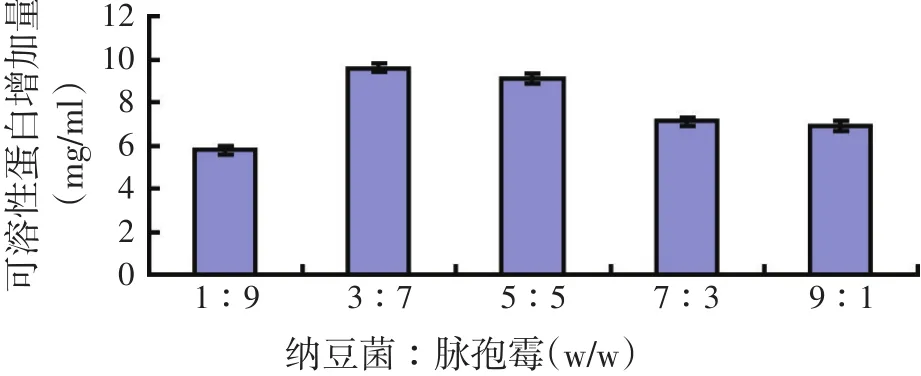
图5 菌体混合比例对可溶性蛋白增加量的影响
培养基中的微生物协同互生发酵,菌体繁殖较快,代谢旺盛,又能分泌不同的蛋白酶类,能充分利用发酵底物中的氮源来合成蛋白。由图5可知,在纳豆芽孢杆菌和好食性脉孢霉比例为3∶7和5∶5的情况下,可溶性蛋白增加量较多。当纳豆菌∶脉孢霉(w/w)为3∶7时,增加的最多,是最适宜的比例。
2.3.4 接种量的优化
发酵时,综合产物的得率和生产成本,会有一个适宜的接种量。本试验是混菌发酵,还要考虑到菌株之间的竞争性,更有必要对其适宜接菌量进行确定。
试验选择接菌量分别为:0.15%(w/w),0.23%(w/w)、0.31%(w/w)、0.39%(w/w)、0.47%(w/w),两种菌同时接到发酵培养基中,菌体混合比(w/w,纳豆菌∶脉孢霉)为3∶7,2 g麸皮+8 g玉米黄粉,料水比=1∶1.6,30℃,pH值自然,培养时间40 h。振荡发酵锥形瓶,使发酵培养基松散,不粘瓶,再往锥形瓶中分别加50 ml生理盐水,浸提4 h,然后测定可溶性蛋白含量,并计算出蛋白增加量。试验结果如图6所示。
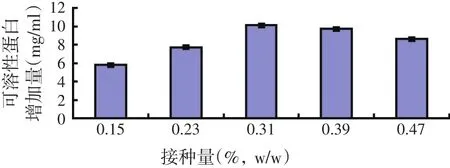
图6 接菌量对可溶性蛋白增加量的影响
从图6可知,随着接菌量的增加,可溶性蛋白含量呈现先增大后减小的趋势。不难看出,接菌量大,可溶性蛋白含量增加的多,但当接菌量过大时,会使菌体稠密,营养物质和氧气供应不足,不利于发酵。另外,从控制生产成本的角度考虑,也应选择接菌量为0.31%(w/w)。
2.3.5 培养温度的优化
一切生化反应都与温度有关,它是影响微生物发酵的重要因素之一。由于蛋白质、核酸等机体组成物质对温度敏感,因此温度对菌体生长、产物合成都有很大影响,甚至能决定微生物生物发酵的方向。因此,需确定一个适宜温度,使发酵按设想方向进行。
纳豆芽孢杆菌的适宜生长温度为28℃,好食性脉孢霉适宜生长温度为37℃。本试验选择的发酵温度分别为25、28、30、32、34 ℃,菌体混合比(w/w,纳豆菌∶脉孢霉)为3∶7,两种菌同时接到培养基中,接菌量为0.31%(w/w),2 g麸皮+8 g玉米黄粉,料水比=1∶1.6,pH值自然,培养时间40 h。充分振荡发酵锥形瓶,使发酵培养基松散,不成块,再往锥形瓶中分别加50 ml生理盐水,浸提4 h,然后测定可溶性蛋白含量,并计算出蛋白增加量。试验结果如图7所示。

图7 发酵温度对可溶性蛋白增加量的影响
由图7可知,当温度为30~34℃时,发酵效果比较好,培养基中的可溶性蛋白增加量比较多。但此时的温度不是纳豆芽孢杆菌和好食性脉孢霉各自的最佳生长温度,说明在此温度下,两种微生物尽管个体生长未达到最好,但此温度适合混菌生产可溶性蛋白。而32℃可溶性蛋白增加量最多,为最适培养温度。
2.3.6 料水比的优化
固态发酵最大的特点就是培养基含游离态水少甚至不含游离态水,因此无废水排放,且易保存,发酵产品能直接饲喂。水对菌体生产和产物合成都有较大影响,当培养基中含水量多会使氧气含量减少,从而影响发酵,如果含水量过少则无法满足菌体的代谢需要,抑制产物合成。因此需要根据不同的菌株和底物来确定一个合适的料水比。
本试验选择的料水比分别是1∶1.2、1∶1.6、1∶2.0、1∶2.4、1∶2.8,发酵温度为32 ℃,菌体混合比(w/w,纳豆菌∶脉孢霉)为3∶7,两种菌同时接到发酵培养基中,接菌量为0.31%(w/w),2 g麸皮+8 g玉米黄粉,pH值自然,培养时间40 h。充分振荡发酵锥形瓶,使发酵培养基松散,不成块,再往锥形瓶中分别加50 ml生理盐水,浸提4 h,然后测定可溶性蛋白含量,并计算出蛋白增加量。试验结果如图8所示。

图8 料水比对可溶性蛋白增加量的影响
在试验开始前,料水比1∶1.6,1∶2.0物料和水混合比较好,1∶1.2较松散,但是1∶2.4,1∶2.8较紧密。由图8可知,当料水比为1∶2.0时,可溶性蛋白增加最多,而且发酵培养基比较松散,结块现象不明显。
2.3.7 接菌顺序及间隔时间的优化
两种菌混合发酵时,总会有一个相对优势和一个相对弱势的菌株,它们对发酵培养基的适应时间和发酵时间都会有些差别。对本试验来说,霉菌的菌体生长比纳豆菌慢,发酵所需时间也较纳豆菌长,因此需要对接菌顺序和间隔时间进行优化。
本试验接菌先后和间隔时间分别为:A:先往培养基中加脉孢霉,24 h后再接入纳豆菌;B:先加脉孢霉,12 h后再加纳豆菌;C:纳豆菌和脉孢霉同时接入;D:先加纳豆菌,12 h后再加脉孢霉;E:先加纳豆菌,24 h后再加脉孢霉。菌株混合后再继续培养40 h,其他条件分别为,菌体混合比(w/w,纳豆菌∶脉孢霉)为3∶7,2 g麸皮+8 g玉米黄粉,料水比=1∶2.0,接种量0.31%(w/w),32℃,pH值自然。培养完成后,振荡发酵锥形瓶,使发酵培养基松散,再往锥形瓶中分别加50 ml生理盐水,浸提4 h,然后测定可溶性蛋白含量,并计算出蛋白增加量。试验结果如图9所示。

图9 接菌顺序及时间间隔对可溶性蛋白增加量的影响
由图9可知,先接入脉孢霉接再入纳豆菌,然后继续培养的效果要强于先加纳豆菌或者两种微生物同时添加。脉孢霉的培养时间长,先接脉孢霉能让菌体先快速生长,到一定数量时,再接入纳豆菌,此时它们协同发酵,甚至互相利用对方所合成营养物质,可溶性蛋白含量增加明显。A脉孢霉总共培养了64 h,纳豆菌培养了40 h,B脉孢霉培养了52 h,纳豆菌培养了40 h,这两种情况下可溶性蛋白增加接近,为了提高设备利用率选择B较合适(从设备利用率考虑,C最佳,工业上可以考虑用C条件),可溶性蛋白增加11.8 mg/ml。
3 结论
混菌发酵玉米黄粉的发酵条件:发酵培养基组成为麸皮∶玉米黄粉=2∶8,料水比=1∶2,接菌顺序及时间为:先接脉孢霉,12 h后再接纳豆菌,接种量为0.31%(w/w),培养温度为32℃,pH值自然,培养40 h,可溶性蛋白增加11.8 mg/ml。
(参考文献12篇,刊略,需者可函索)
