姜黄素衍生物B06对2型糖尿病大鼠心肌的保护作用及其机制探讨*
2014-01-22林中民焦立卓王晓雅刘网网徐梦菲姬秀焕陈三妹陈国荣
林中民,焦立卓,郑 怡,王晓雅,王 玲,刘网网,徐梦菲,姬秀焕,陈三妹,陈国荣Δ
糖尿病心肌病变是在糖脂代谢紊乱基础上合并发生的心肌慢性病变。已有研究表明心肌能量代谢的变化、心肌纤维化和脂质过氧化作用参与糖尿病心肌病变的发展[1,2],而姜黄素已被证实具有降血糖、降血脂、抗氧化、抗炎等[3]广泛的药理活性,但其是否具有抗糖尿病心肌病变的作用鲜有报道。本研究通过光镜和透射电镜观察姜黄素衍生物B06对高脂饮食及2型糖尿病大鼠心肌的病理变化,并测定心肌腺苷酸活化蛋白激酶 ɑ(AMP-activated proteinkinaseɑ,AMPKɑ)和磷酸化腺苷酸活化蛋白激酶 ɑ(phosphorylated AMP-activated protein kinaseɑ,p-AMPKɑ)的蛋白表达水平,探讨B06对2型糖尿病心肌病变的防治机制。
1 材料与方法
1.1 动物分组及处理
雄性SD大鼠35只(温州医学院实验动物中心提供),体重 160~200 g,随机均分为 5组(n=7):正常对照组(NC组)、高脂组(HF组)、高脂治疗组(FT组)、糖尿病组(DM组)和糖尿病治疗组(DT组),NC组以常规饲料喂养,后四组以高脂饲料喂养[4](饲料组成:10.0%猪油,20.0%蔗糖,2.5%胆固醇,1.0%胆酸盐,66.5%常规饲料)。高脂喂养4周后,DM组及DT组在禁食12 h后按30 mg/kg的剂量腹腔注射链脲佐菌素(streptozocin,STZ,溶于 0.1 mmol/L枸橼酸缓冲液内,配成浓度为 6 mg/ml的溶液,pH 4.0),72 h后尾静脉测血糖,血糖>16.7 mmol/L为造模成功,NC组、HF组及FT组腹腔注射等容积枸橼酸缓冲液。成模后,后四组均继续高脂饲料喂养,FT组和 DT组按 0.2 mg/kg·d的剂量灌胃 B06(温州医学院药学院梁广教授惠赠,B06溶于1%羧甲基纤维素钠),其余组灌胃等量的1%羧甲基纤维素钠,每天一次,并且每天称体重一次,持续8周。
1.2 血生化指标和血胰岛素水平的检测
禁食12 h后,股动脉放血处死大鼠,收集血清,用微量血糖仪测定血糖,全自动生化分析仪测定血脂,双抗体夹心ABC-ELISA法测定血胰岛素水平,并计算胰岛素抵抗指数(Insulin resistance index,IRI=血糖×血胰岛素/22.5)。ELISA试剂盒购于上海西唐生物科技有限公司。
1.3 光镜标本制备
取左室心肌,10%中性福尔马林固定,常规脱水并石蜡包埋,制成3μm厚的切片,心肌 Masson染色,光镜下观察心肌胶原纤维分布。
1.4 透射电镜标本制备
取左室心肌,大小1 mm×1 mm×1 mm,2.5%戊二醛固定,PBS漂洗,锇酸后固定,丙酮梯度脱水,环氧树脂浸润包埋,半薄切片定位,超薄切片,H-7500型透射电镜下观察心肌超微结构。
1.5 Western blot法检测心肌组织 AMPKɑ和 p-AMPKɑ的蛋白表达水平
取100 mg心肌组织常规提取心室肌组织蛋白,以BCA试剂盒做蛋白定量。蛋白样品行电泳,转膜,抗AMPKɑ和抗p-AMPKɑ一抗室温孵育,TBST溶液洗涤后HRP标记的二抗室温孵育,化学发光,显影定影,扫描后用GelPro32图像分析软件进行灰度扫描分析。以目的蛋白条带与β-Actin条带累积光密度(IOD)之比作为反映蛋白表达水平的相对指标。抗 AMPKɑ和抗 p-AMPKɑ一抗购于美国 Cell Signaling Technology,二抗购于北京中杉金桥生物技术有限公司。
1.6 统计学处理
所有数据以均数±标准差(¯x±s)表示,统计处理用SPSS 17.0软件分析,两组比较用两个独立样本t检验,多组组间比较采用单因素方差(one-way ANOVA)分析,组内两两比较采用LSD法。
2 结果
2.1 各组体重比较
12周末,HF组体重显著高于NC组(P<0.01),DM组体重显著低于 HF组(P<0.01),FT组和 DT组体重分别与HF组和DM组比较无显著差异(表1)。
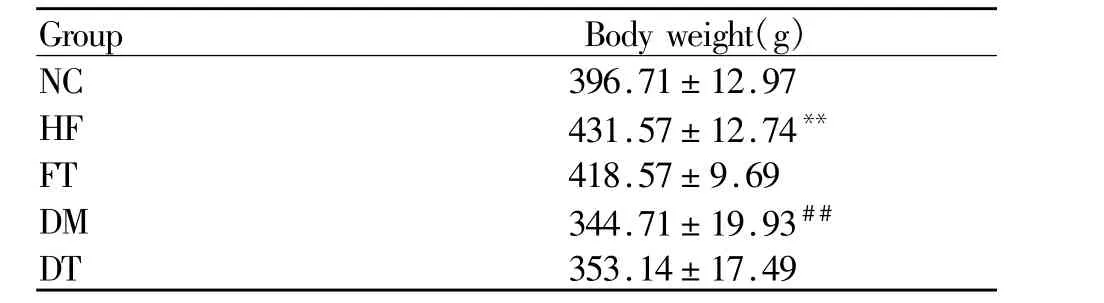
Tab.1 Comparison of body weight among five groups after 12 weeks(¯x±s,n=7)
2.2 B06对血糖、血胰岛素、IRI及血脂水平的影响
HF组血糖、血胰岛素、胰岛素抵抗指数(insulin resistance index,IRI)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)及低密度脂蛋白/高密度脂蛋白(low density lipoprotein/high density lipoprotein,LDL/HDL)显著高于 NC组(P<0.05,P<0.01),经B06治疗后,FT组血糖、血胰岛素、IRI及 TG较 HF组显著下降(P<0.05,P<0.01),TC、LDL/HDL无显著差异;DM组血糖、IRI、TG、TC及 LDL/HDL显著高于HF组(P<0.01),经 B06治疗后,DT组血糖、血胰岛素、IRI、TG、TC及 LDL/HDL较 DM组显著下降(P<0.01,表 2)。

Tab.2 Effect of B06 on serum glucose,blood insulin,IRI and serum lipid levels(¯x±s,n=7)
2.3 光镜观察
心肌Masson染色显示,NC组大鼠心外膜、血管壁周围见少量浅绿色的纤维成分(图1A),其余部位未见胶原纤维存在;HF组(图1B)和FT组(图1C)血管壁周围见少量绿色的胶原纤维,心肌细胞间未见明显胶原纤维形成,与NC组无明显差异;DM组见大量绿色的胶原纤维存在,广泛分布于心肌细胞间(图1D),相互连接缠绕成纤维化区域,血管壁周围也可见胶原纤维增生;DT组心肌细胞间纤维化区域明显减少,少量散在分布(图1E,图1见彩图页Ⅱ)。
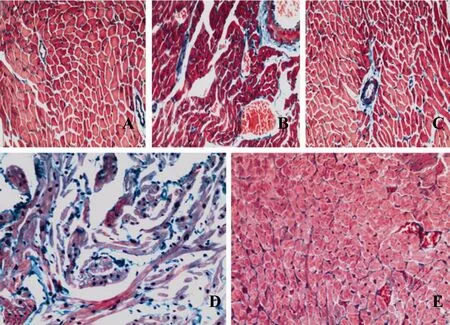
Fig. 1 Light micrography of myocardium in rats(Masson Staining ×200)A:A little collagenous fiber distributed around the blood vessel from NC group;B:A small amount of collagenous fiber arranged with the blood vessel from HF group;C:A small quantity of collagenous fiber existed surrounding the blood vessel from FT group;D:Proliferation of collagenous fiber in the interstitium of myocardium from DM group;E:Fibrosis ameliorated in the interstitium of myocardium from DT group
2.4 透射电镜观察
心肌细胞超微结构显示,NC组心肌细胞线粒体丰富,粗细肌丝排列整齐,闰盘部位明显;HF组心肌细胞内线粒体略肿胀,线粒体嵴紊乱,粗细肌丝间隙增宽,排列尚整齐(图2A),FT组与NC组心肌细胞电镜下观察基本一致(图2B);DM组心肌细胞内线粒体肿胀明显,线粒体嵴紊乱、部分消失,粗细肌丝间隙增宽,排列紊乱,部分肌丝扭曲变形,甚至溶解,闰盘消失(图2C),另见部分区分布大量胶原纤维,提示心肌细胞纤维化存在(图2D);DT组心肌细胞见线粒体肿胀减轻,粗细肌丝排列略有变形,闰盘较明显,未见明显胶原纤维(图2E)。
2.5 B06对心肌组织AMPKɑ和p-AMPKɑ蛋白表达的影响
Western blot结果分析显示,HF组心肌组织AMPKɑ、p-AMPKɑ表达较 NC组明显下降(P<0.05,P<0.01),经 B06治疗后,FT组与 HF组相比,心肌组织 p-AMPKɑ表达显著升高(P<0.01),AMPKɑ表达无差异;DM组心肌组织p-AMPKɑ表达较HF组显著下降(P<0.01),AMPKɑ呈下降趋势,无显著差异,经B06治疗后,DT组与DM组相比,心肌组织AMPKɑ、p-AMPKɑ表达明显升高(P<0.05,P<0.01,图 3、表 3)。
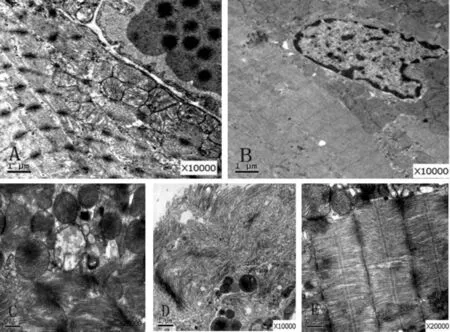
Fig.2 Transmission electron microscopy of myocardium in rats A:Expansion of myocardium mitochondria from HF group(×10k);B:Plenty of myocardium mitochondria and aligned myofilament from FT group(×10k);C:Expansion of myocardium mitochondria,disarrangement of cristae,widened and distorted myofilament clearance from DM group(×20k);D:Plenty of disarrangement of collagen fiber from DM group(×10k);E:Expansion of myocardium mitochondria lightened,slightly distorted myofilament from DT group(×20k)
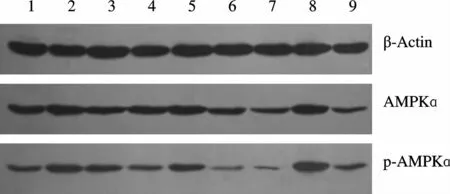
Fig.3 Effect of B06 on cardiac AMPKɑand p-AMPKɑprotein expression1,2:FT group;3,4:HF group;5:NC group;6,7:DM group;8,9:DT group

Tab.3 Effect of B06 on cardiac AMPKɑand p-AMPKɑprotein expression
3 讨论
胰岛素抵抗介导的心肌代谢紊乱是导致糖尿病心肌病发生的主要机制之一,不同的因素,包括心肌胰岛素抵抗、葡萄糖摄取降低和脂肪酸氧化利用障碍,都可能参与糖尿病心肌病的发生。研究证实,高糖、高胰岛素均能促进心肌成纤维细胞内胶原蛋白合成及其基因的表达,其机制与促进转化生长因子(TGF-β1)基因表达增加密切相关[5]。胶原生成增加和降解减少将导致心肌间质纤维化,使心肌顺应性下降,并出现泵功能障碍。因此,胰岛素敏感性和糖脂代谢的正常化已经被认为能够减缓糖尿病心肌并发症的发生。而能量代谢是维持心肌细胞结构完整和功能正常的重要支柱。作为“能量代谢调节器”,AMPKɑ1分布广泛,AMPKɑ2主要分布于心肌、骨骼肌和肝脏,AMPK能对心肌细胞内AMP/ATP比例的变化迅速产生反应,而糖尿病时心肌AMPK活性下降。在缺血、缺氧、葡萄糖缺乏、饥饿等情况下,细胞内AMP/ATP比例增加,继而AMPKɑ亚基的苏氨酸172位点发生磷酸化修饰后激活而具有生物活性。p-AMPK可磷酸化下游的信号分子发挥能量代谢的调控作用,可通过胰岛素非依赖机制促进心肌葡萄糖摄取,可能与诱导葡萄糖转运体4(GLUT4)的转位及其基因的表达增加相关[6]。另外,AMPK可直接磷酸化激活糖酵解的限速酶磷酸果糖激酶2,产生2,6-二磷酸果糖,从而促进糖酵解。同时还能减少糖异生酶的表达,抑制糖异生[7]。而高脂血症在胰岛素抵抗和糖尿病的发生中起重要作用,羟甲基戊二酸CoA还原酶和乙酰CoA羧化酶(ACC)分别是胆固醇和脂肪酸合成的关键酶,且均为AMPK的重要底物。p-AMPK使两者磷酸化失活,而分别抑制胆固醇和脂肪酸合成。同时,ACC是丙二酰CoA合成的限速酶,而后者又可变构抑制肉碱酯酰转移酶I,进而促进长链脂酰CoA转运入线粒体进行脂肪酸有氧氧化[8]。因此,激活的 AMPK可通过增加GLUT4的转位、增强脂肪酸的氧化利用和降低脂质聚集,从而改善心肌胰岛素敏感性。Viollet等[9]研究同样表明,AMPKɑ2基因剔除与葡萄糖耐受不良和胰岛素分泌降低相关,并可诱导胰岛素抵抗的发生,而AMPK特异性激活剂具有胰岛素增敏效应。以往的研究表明,高糖高脂可引起心肌细胞损伤和凋亡,影响心肌细胞结构完整和功能正常。本研究结果显示,HF组出现高糖高脂,心肌细胞超微结构紊乱并伴有心肌AMPKɑ和p-AMPKɑ的表达下降;而糖尿病本身就存在糖脂代谢紊乱,本研究中DM组血糖血脂均较HF组升高,胰岛素抵抗明显,心肌细胞超微结构紊乱,纤维化增多并伴有心肌 p-AMPKɑ的表达显著下降,表明糖尿病可引起严重的心肌损伤,这与我们以往的研究[10]中证实的糖尿病导致心肌损伤的结论一致,而本研究表明心肌AMPK活性的下降将导致心肌糖脂代谢障碍和胰岛素敏感性下降。国内外众多研究指出,姜黄素能够改善糖尿病状态下的高血糖,其机制可能与降胆固醇、抗氧化特性和自由基清除能力有关[3];另外,姜黄素可能通过影响脂肪酸转运和氧化相关酶和蛋白的表达而发挥降血脂的作用[11]。Kim等[12]研究表明,姜黄素可通过增加肝细胞的p-AMPK活性,而抑制肝糖异生起到降血糖的效应。而姜黄素衍生物B06是一种单羰基姜黄素类似物,其性质更稳定,生物利用度更高。我们的研究显示,FT组和DT组心肌AMPKɑ及 p-AMPKɑ的表达分别较HF组和DM组明显升高,表明姜黄素衍生物B06可增加心肌AMPK的活性,并改善心肌糖脂代谢及胰岛素抵抗,同时减轻DT组的心肌间质纤维化。
综上所述,增强AMPK活性目前已成为治疗2型糖尿病的一个新策略。但是,在心肌病变中被激活的AMPK,主要延缓不良后果的开始和发展,不足以完全防止不良后果[13]。基于此,一种潜在的治疗方法是药理性的AMPK激活来加强或延长心肌保护作用。B06对糖尿病心肌有一定的保护作用,可改善糖脂代谢、胰岛素敏感性并减轻心肌纤维化,可能与增强心肌AMPKɑ及p-AMPKɑ活性有关,但其确切机制尚待进一步研究。
[1] Lee JE,Yi CO,Jeon BT,et al.α-Lipoic acid attenuates cardiac fibrosis in Otsuka Long-Evans Tokushima Fatty rats[J].Cardiovasc Diabetol,2012,11(1):111.
[2] 李旭升,陈国荣,李剑敏,等.银杏叶提取物对糖尿病大鼠心肌损伤的防护作用[J].中国应用生理学杂志,2005,21(2):176-178.
[3] Aggarwal BB,Harikumar KB.Potential therapeutic effects of curcumin,the anti-inflammatory agent,against neurodegenerative,cardiovascular,pulmonary,metabolic,autoimmune and neoplastic diseases[J].Int J Biochem Cell Biol,2009,41(1):40-59.
[4] 王蓉蓉,谢 琳,吴晓烨,等.银杏叶提取物对实验性2型糖尿病大鼠肝脏的保护作用[J].中国病理生理杂志,2007,23(3):566-569.
[5] Tokudome T,Horio T,Yoshihara F,et al.Direct effects of high glucose and insulin on protein synthesin in cultured car-diac myocytes and DNA and collagen synthesis in cardiac fibroblasts[J].Metabolism,2004,53(6):710-715.
[6] McGee SL,Hargreaves M.Exercise and skeletal muscle glucose transporter 4 expression:molecular mechanisms[J].Clin Exp Pharmacol Physiol,2006,33(4):395-399.
[7] Russell RR 3rd,Li J,Coven DL,et al.AMP-activated protein kinase mediates ischemic glucose uptake and prevents postischemic cardiac dysfunction,apoptosis,and injury[J].J Clin Invest,2004,114(4):495-503.
[8] Folmes CD,Lopaschuk GD.Role of malonyl-CoA in heart disease and the hypothalamic control of obesity[J].Cardiovasc Res,2007,73(2):278-287.
[9] Viollet B,Andreelli F,Jorgensen SB,et al.Physiological role of AMP-activated protein kinase(AMPK):insights from knockout mouse models[J].Biochem Soc Trans,2003,31(1):216-219.
[10]陈国荣,刘 毅,毛孙忠,等.黄芪对糖尿病性肾病大鼠心肌脂质过氧化作用及一氧化氮水平的影响[J].中国应用生理学杂志,2001,17(2):186-188.
[11]陈 培,张玉领.姜黄素防治2型糖尿病的研究进展[J].价值工程,2011,30(22):319.
[12] Kim T,Davis J,Zhang AJ,et al.Curcumin activates AMPK and suppresses gluconeogenic gene expression in hepatoma cells[J].Biochem Biophys Res Commun,2009,388(2):377-382.
[13] Horman S,Beauloye C,Vanoverschelde JL,et al.AMP-activated protein kinase in the control of cardiac metabolism and remodeling[J].Curr Heart Fail Rep,2012,9(3):164-173.
