羧氨基葡聚多糖钠对胃癌脱落细胞种植转移的抑制作用
2014-01-21俞士勇刘兆龙
俞士勇,阎 波,刘兆龙
(1同济大学医学院,上海200331;2上海市浦东新区人民医院)
胃癌是常见的消化道恶性肿瘤,临床发现、手术治疗的胃癌绝大部分为进展期癌。尽管胃癌的规范性根治术能够很大程度清扫淋巴途径的转移,但其5年生存率只能提高到60%左右[1]。进展期胃癌腹腔内脱落细胞种植转移是导致预后不良的重要因素之一[2,3]。胃癌根治术后腹腔内常残留游离癌细胞或残余微小癌灶,腹膜表面的间皮下结缔组织的裸露又为癌细胞的增殖创造了条件,导致术后腹膜播散、复发和转移。研究显示,羧氨基葡聚多糖钠具有抑制胃癌肿瘤细胞生长和促进肿瘤细胞凋亡的作用[4]。2012年8月~2013年7月,我们通过体外试验研究羧氨基葡聚多糖钠对胃癌细胞MGC-803细胞生物学行为的影响。现报告如下。
1 材料与方法
1.1 材料 人胃癌MGC-803细胞株购自上海中科院细胞所,培养基为DMEM,10%小牛血清培养于37℃、5%CO2培养箱中。羧氨基葡聚多糖钠由山西皮尔复生物技术有限公司提供。Vybrant凋亡检测试剂盒购自Invitrogen公司。
1.2 方法
1.2.1 细胞增殖检测 采用MTT法。将胃癌细胞按(2 ~3)×103/孔铺于96 孔板,实验组为12.5、25、50 mol/L三种浓度羧氨基葡聚多糖钠(以氨基葡萄糖含量计算)处理 0、24、48、72 h,对照组加入生理盐水。检测前4 h加入MTT 5 mg/mL,按10 μL/100 μL培养基,培养4 h;弃培养基,加入150 μL DMSO,37℃孵育10 min,于570 nm波长处测OD值。
1.2.2 细胞周期检测[5]将胃癌细胞按5×105/孔铺于6孔板,分别加入羧氨基葡聚多糖钠12.5、25、50 mol/L 处理 0、24、48、72 h,对照组加入生理盐水。PBS冲洗,70%乙醇固定过夜;PBS冲洗,0.1%Triton打孔20 min;加入RNA酶20 μmol/L反应20 min,PI标记,流式细胞仪检测细胞周期分布情况。
1.2.3 细胞凋亡检测[6]将胃癌细胞按5×105/孔铺于6孔板,分别加入羧氨基葡聚多糖钠12.5、25、50 mol/L处理24 h,对照组加入生理盐水,PBS冲洗,AnnexinV标记,PI标记,流式细胞仪检测细胞凋亡率。
1.2.4 细胞迁移检测[7]将胃癌细胞经胰蛋白酶消化5 min后,加入2 mL 0.1%BSA+DMEM吹打均匀,计数。取100 μL含5×104胃癌细胞加入小室上层,下层小室(即24孔板内)加入500 μL 10%FBS+DMEM;分别加入 12.5、25、50 mol/L 羧氨基葡聚多糖钠后培养12~24 h;取出小室,4%多聚甲醛固定;用棉签将膜上层微穿过的细胞擦掉,PBS轻洗上层小室,置于结晶紫或台盼蓝中染色,显微镜下观察,计数5~10个随机视野中的细胞数,取平均值。
1.2.5 统计学方法 运用SPSS统计软件,计量资料以±s表示,采用非配对t检验,计数资料以百分数表示,采用χ2检验。P≤0.05为差异有统计学意义。
2 结果
2.1 羧氨基葡聚多糖钠对胃癌细胞增殖的影响MTT 检测显示,与对照组相比,12.5、25、50 mol/L羧氨基葡聚多糖钠均可显著抑制胃癌细胞增殖(P<0.05 或 <0.01),50 mol/L 效果更显著(P <0.01)。见表1。
表1 羧氨基葡聚多糖钠对胃癌细胞增殖的影响(%,±s)

表1 羧氨基葡聚多糖钠对胃癌细胞增殖的影响(%,±s)
注:与对照组比较,*P <0.05,**P <0.01
组别细胞增殖率0 h 24 h 48 h 72 h对照组1.25 ±0.10 1.23 ±0.25 1.20 ±0.30 1.22 ±0.20实验组12.5 mol/L 1.01 ±0.13** 0.95 ±0.10* 0.95 ±0.13* 0.90 ±0.15*25 mol/L 0.75 ±0.14** 0.75 ±0.16** 0.73 ±0.10** 0.70 ±0.20**50 mol/L 0.42 ±0.15** 0.40 ±0.12** 0.38 ±0.14** 0.36 ±0.20**
2.2 羧氨基葡聚多糖钠对胃癌细胞细胞周期的影响 流式细胞仪结果显示,羧氨基葡聚多糖钠各组G0/G1期细胞明显增多,与对照组相比,12.5、25、50 mol/L 羧氨基葡聚多糖钠 G0/G1期细胞分别增加9.7%、17.8% 和 23.4%(P均 <0.01),G2/M 期细胞分别减少 11.73% 、21.11%和25.03% 。
2.3 羧氨基葡聚多糖钠对胃癌细胞凋亡率的影响流式细胞仪结果显示,羧氨基葡聚多糖钠处理24 h后,12.5、25、50 mol/L 组的细胞凋亡率分别为10.76%、17.72%、25.36%,均显著高于对照组的1.17%(P 均 <0.01)。
2.4 羧氨基葡聚多糖钠对胃癌细胞迁移的影响Transwell小室结果显示,对照组细胞迁移数目为(1.00 ±0.11)×103个,观察组 12.5、25、50 mol/L处理组的细胞迁移数目分别为(0.52±0.12)×103、(0.23 ±0.13)×103、(0.08 ±0.11)×103个,与对照组相比,羧氨基葡聚多糖钠处理组迁移的细胞数目明显减少(P均<0.01)。
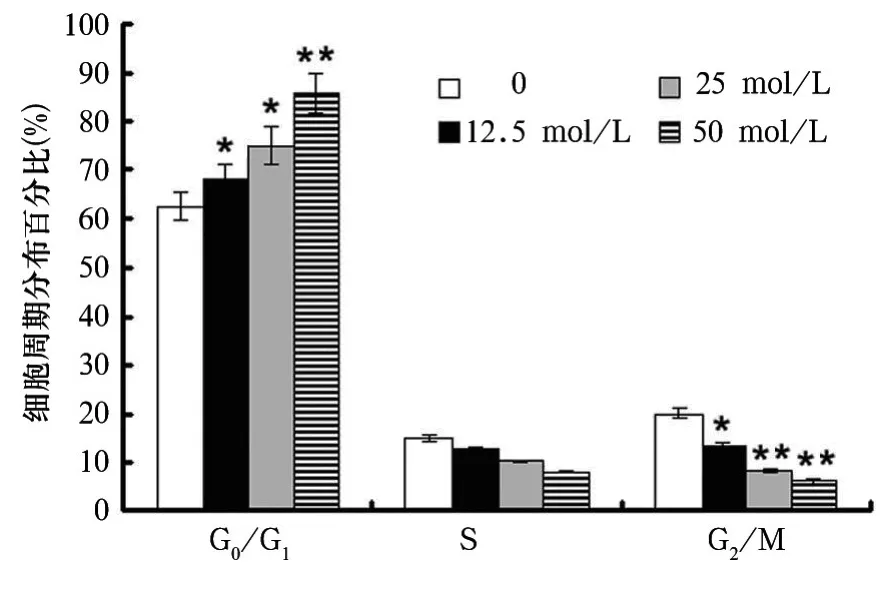
图1 羧氨基葡聚多糖钠对胃癌MGC-803细胞周期的影响
3 讨论
胃癌居恶性肿瘤死因的第2位[8],以40~60岁多见,能手术者仅为40%,切除后5年生存率约为60%,复发转移率高达80%[9],Ⅲ期胃癌5年生存率约30%[10],晚期胃癌生存期仅6~10个月。侵袭和转移是恶性肿瘤细胞最重要的生物行为,与预后密切相关。肿瘤细胞的转移是多因素、多基因综合作用的结果,除了肿瘤细胞基因间的相互作用、肿瘤细胞与宿主细胞间的相互作用外,还包括细胞外基质在肿瘤细胞侵袭与转移过程中起到防御作用[11]。针对进展期胃癌脱落细胞种植转移,目前国内外均采用腹腔灌注化疗,即手术结束时使用5-FU腹腔及切口冲洗、腹腔内灌注保留化疗来达到阻断脱落癌细胞种植转移的目的,然而效果并不令人满意。羧氨基葡聚多糖钠生物胶体液属于壳聚糖类生物,为无色透明或微黄色澄清液体,无悬浮物或沉淀,无菌、无热源、无细胞毒性、无致敏、无刺激性[12],常用于促进组织修复、保持器官表面光滑的外科创面冲洗和换药。理论上讲,高分子类衍生物可与肿瘤细胞、病毒、细菌表面结构物质结合形成抗原,从而提高抗原提呈细胞识别率并促进抗体与表面抗原结合,激活免疫系统[13],杀伤和破坏腹腔脱落胃癌细胞。
本研究显示,羧氨基葡聚多糖钠可显著抑制胃癌细胞增殖,并呈剂量依赖性。进一步探讨羧氨基葡聚多糖钠对胃癌细胞生长抑制作用的机制,结果显示,低剂量(12.5 μmol)即可引起细胞周期 G1/S期阻滞,中、高剂量(25、50 μmol/L)的阻滞作用更明显。流式细胞仪结果显示,羧氨基葡聚多糖钠可诱导胃癌细胞凋亡,并呈剂量依赖形式。以往研究发现,PI3K、Akt/PKB活化mTOR后,激活其下游因子S6K1和4EBP-1,导致细胞周期G1/S阻滞,并伴随着停留在G1期细胞发生凋亡[14]。因此认为,羧氨基葡聚多糖钠在胃癌细胞周期从G1期向S期转换过程中起重要作用,其可诱导细胞周期G1/S期阻滞,诱导细胞凋亡。
转移是恶性肿瘤的基本生物学特征,也是肿瘤患者死亡的主要原因。肿瘤转移是一个复杂的过程,受多种因素的调控。本研究采用Transwell小室实验观察,结果显示,实验组胃癌细胞迁移数目明显减少。从而推断经不同浓度羧氨基葡聚多糖钠冲洗处理后的胃癌细胞远处转移能力明显减弱,并呈浓度依赖性,因此认为羧氨基葡聚多糖钠在抑制胃癌脱落细胞种植转移中起重要作用。
综上所述,羧氨基葡聚多糖钠可显著抑制胃癌脱落细胞的增殖和迁移,诱导胃癌细胞凋亡,并呈剂量依赖性,可作为进展期胃癌根治术后的腹腔冲洗液。
[1]Meyer HJ,Wilke H.Treatment strategies in gastric cancer[J].Dtsch Arztebl Int,2011,108(41):698-705.
[2]程兆明,周永静,张尤历,等.吴茱萸碱对人胃癌细胞SGC7901细胞增殖、侵袭和保罗样激酶-1基因表达的影响[J].江苏大学学报,2011,21(1):69.
[3]Yamamoto M,Baba H,Kakeji Y,et al.Prognostic significance of tumor markers in peritoneal lavage in advanced gastric cancer[J].Oncology,2004,67(1):19-26.
[4]邱衍哲,孙刚,毕建威.胃癌术后应用术尔泰冲洗的临床研究[J].中国实用外科杂志,2013,33(1):31-33.
[5]梁智辉,朱慧芬,陈九武.流式细胞术基础原理及实用技术[M].武汉:华中科技大学出版社,2008:75-76.
[6]Michallet MC,Saltel F,Flacher M,et al.Cathepsin-Dependent apoptosis triggered by supraoptimal activation of T lymphocytes:a possible mechanism of high dose tolerance[J].J Immunol,2004,172(9):5405-5414.
[7]Peng TL,Chen J,Mao W,et al.Aryl hydrocarbon receptor pathway activation enhances gastric cancer cell invasiveness likely through a c-Jun-dependent induction of matrix metalloproteinase-9[J].BMC Cell Biol,2009,10:27.
[8]冯丽丽,张爱平,董银平.半夏泻心汤在胃癌防治中的应用[J].中国实验方剂学杂志,2012,185(2):258.
[9]金懋林,陈强,程风岐,等.奥沙利铂联合亚叶酸钙和5-氟尿嘧啶治疗晚期胃癌的研究[J].中华肿瘤杂志,2003,25(2):172.
[10]吴蓉,吴小翎.胃癌全身化疗进展[J].现代医药卫生,2005,21(5):546.
[11]阮叶萍,刘云霞,姚立.益气补肾方对胃癌细胞侵袭转移能力的影响[J].中医杂志,2012,53(2):148.
[12]钱亚峰.术尔泰在腹盆腔手术中的应用[J].中国医疗前沿,2009,4(2):57.
[13]Hiemstra PS,Maassen RJ,Stolk J,et al.Antibacterial activity of antileukoprotease[J].Infect Immun,1996,64(11):4520-4524.
[14]Baldo P,Cecco S,Giacomin E,et al.mTOR pathway and mTOR inhibitors as agents for cancer therapy[J].Curr Cancer Drug Targets,2008,8(8):647-665.
