分子印迹技术在药物残留检测中的应用
2014-01-20张成博李兆周侯玉泽李道敏李松彪李志康张小帆张腊梅
张成博,李兆周,侯玉泽,李道敏,李松彪,李志康,张小帆,张腊梅,吕 璞
分子印迹技术在药物残留检测中的应用
张成博,李兆周,侯玉泽*,李道敏,李松彪,李志康,张小帆,张腊梅,吕 璞
(河南科技大学食品与生物工程学院,河南 洛阳 471003)
作为一种新型、高效的分离与分子识别技术,分子印迹因其制备简单、特异性识别能力强、具有较好的化学和物理稳定性,近几年广泛应用在药物残留检测领域。本文重点对分子印迹技术在固相萃取、色谱分离、膜分离和传感器等方面的研究进行了总结,并分析目前该技术存在的缺点和改进方向,为更好地将分子印迹技术应用于药物残留分析提供了参考。
分子印迹;药物残留检测;食品安全
近年来,食品安全事件频频发生,药物残留是主要原因之一,对食品中的药物残留进行监测是食品安全与质量控制的一个重要环节。目前在药物残留分析中,常采用高效液相色谱法(high performance liquid chromatograph,HPLC)、液相色谱-质谱联用法(liquid chromatograph-mass spectrometry,LC-MS)、气相色谱法(gas chromatography,GC)、气相色谱-质谱联用法(gas chromatography-mass spectrometry,GC-MS)、微生物法和免疫法等[1]。其中,仪器分析法的检测虽然具有较高的精确性,但操作繁琐、设备昂贵、对样品处理要求较高;微生物法操作简单,但假阳性率较高,检测耗时长,不适宜对现场样品进行检测;免疫学检测方法快速,可以进行现场检测,但制备特异性抗体较为复杂和繁琐,且生物性抗体的稳定性较差,保存期较短[1-4]。因此,开发具有特异性识别性且简便实用的新方法迫在眉睫。
分子印迹技术(molecular imp rinting technique,MIT)是一种近些年发展起来的基于高分子与超分子化学的分离与分子识别技术[2-4]。分子印迹聚合物(molecular imprinted polymers,MIPs)对目标化合物具有特异识别能力,制备简单,适用范围广,化学和物理性质稳定,对极端环境耐受性好[2-4]。在固相萃取[5-15]、色谱分离[16-21]、膜分离[22-24]和传感器[25-26]等领域得到了广泛应用。本文对MIT在药物残留检测中的应用进行了综述,对该技术目前存在的缺陷和改进方向进行了分析。
1 分子印迹技术
1.1 分子印迹的原理
由Pauling抗体形成理论出发,在一定条件下,模板分子与功能单体组装成某种可逆的复合物;加入交联剂将其固定或“冻结”得到高聚物;将模板分子抽提出来,聚合物中就形成了与模板分子在空间和结合位点上相匹配的具有多重作用位点的空穴,这样的空穴对模板分子具有专一性识别作用[4],具体过程见图1。
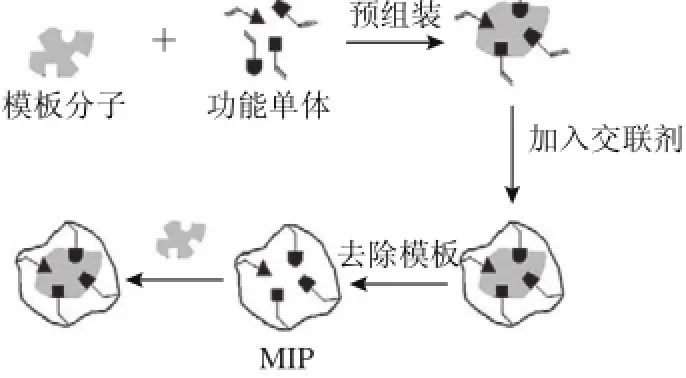
图1 分子印迹的聚合及识别[55]Fig.1 Synthesis of molecularly imprinted polymers (MIPs) and their selective recognition to target molecules[5]
1.2 分子印迹聚合物的表征
目前,MIPs的表征手段主要沿用了固体聚合物的表征方法,表1分别从形貌表征、化学表征、识别行为和性能表征等几个方面对MIPs的表征技术和表征目的进行了总结[3]。

表1 MIPs的表征[3]TTable 11 ChaCrhaacrtaecrization of molecularly imprinted polymers[3]
2 分子印迹技术在药物残留检测中的应用
由于各种化学药物在食品生产和加工过程中大量使用,这些药物在生物体内富集,经过食物链进入人体,对人类的健康造成了严重的危害[1]。目前,MIT在药物残留分析中主要应用于四环素类、大环内脂类、磺胺类、青霉素类和喹诺酮类等药物,聚合方法主要采用本体聚合、悬浮聚合、沉淀聚合和原位聚合等,具体方法和应用见表2。
本体聚合操作简单,合成条件易于控制;但后处理繁琐,研磨过程可能会破坏识别位点,研磨的颗粒大小不均一,形状不规则,影响对目标分子的选择性和吸附效果[9]。而悬浮聚合可以制备出大小均一的微球,但由于聚合反应在分散相中进行,印迹效果会受分散剂的影响,并且聚合物的结构和交联密度很难控制,使得MIPs对模板分子的识别能力较差[10]。沉淀聚合也可以制备单分散的印迹微球,且具有聚合组分简单、操作简便、比表面积较大和吸附能力较强等优点,但制备过程中需要大量的溶剂,所得微球的粒径多在纳米级和亚微米级,限制了其应用范围[7]。原位聚合法多用于整体柱的制备,聚合物的合成和装柱同时进行,提高了空间的利用率,缩短了实验进程,但柱效和柱容量较低,难以克服“壁流”等问题[15-22]。

表2 MIPs的聚合和应用Table 2 Synthesis and application of molecularly imprinted polymers
上述4种聚合方法印迹的识别位点大都在聚合物的内部,洗脱时会出现模板“包埋”过深不易洗脱的情况;在识别过程中也会因为MIPs内部的扩散阻力,使得目标物与MIPs的识别孔穴结合率降低[3]。表面分子印迹技术解决了这一问题,它将分子识别位点建立在基质材料的表面,来提高识别位点和印迹分子的结合速度,进一步加强印迹材料吸附分离效率[14];该技术分为表面修饰印迹技术和表面模板印迹技术[3]。较常见的表面修饰印迹技术是硅胶表面修饰,利用粒子的机械稳定性,通过粒子本身性能的调节来适应应用需要[3]。表面模板印迹技术由于结合位点在聚合物表面,所以MIPs与印迹分子结合速度较快,模板利用率较高;缺点是只能印迹水溶性的化合物,且结合容量较小,只适用于定性分析,而用于制备性分离较困难[3]。这5种聚合方法适用于大多数的情况,但制备MIPs化学传感器时选择电聚合更合适,且效果较好[25-26]。
由表2可知,目前功能单体的种类较少,难以满足实验的需要,开发新型单体是今后研究的一个重要方向。MIPs在固相萃 取和整体 柱方面应用较多,技术相对成熟,效果较好,其中固相萃取柱有商品化的产品,已成为最具商业前景的领域。而分子印迹膜[22-24]和分子印迹传感器[25-26]的研究相对较少,今后仍将是研究的热点。
2.1 固相萃取
固相萃取(solid phase extraction,SPE)是一种吸附萃取分离的过程,在萃取分离时易受到共萃取物质的干扰[3]。分子印迹固相萃取柱(molecular imprinted polymers- solid phase extraction,MISPE)检测替米考星的回收率为93.3%,相对标准偏差(relative standard deviation,RSD)为4.5%;而C18SPE柱回收率为77.3%,RSD为5.6%[11]。与市售C18SPE柱相比,MIS PE回收时间和试剂用量分别为它的l/3和1/ 4[35];并且采用MIPs为固相萃取的吸附材料能有效地除去样品基质复杂所带来的内源性干扰问题[36]。合成对四环素类抗生素(四环素、土霉素、金霉素)具有特异性识别能力的MIPs,李倩[7]选择强力霉素为模板分子使用沉淀聚合法制备MIPs,并发现当模板、功能单体和交联剂的物质的量比为1∶8∶16时识别性能最好,稳定性最佳。但是这种基于有机功能单体的聚合物在溶液中较易溶胀,其材料学性能并不能满足分析的需要。Lü Yunkai等[6]开发了一种新型有机-无机杂化复合材料的MIPs,结合溶胶-凝胶技术检测牛奶中的四环素类抗生素。它的富集因子达到了18.8,其中检测限是4.8~12.7 μg/kg,定量限是16.0~42.3 μg/kg,平均回收率为80.9%~104.3%,RSD在1.5%~5.0%。该方法提高了其对目标物的吸附能力和选择性,还可以通过调整模板与功能单体的比例来改变硬度和韧性,减少溶胀效应。
当模板分子难以获得或在 印迹体系中不稳定时,可以选择与 模板分子化学结构相似的化合物作为虚拟模板。Zhang Lei等[13]通过分子建模的方法模拟分析出最佳虚拟模板异丙甲草胺,采用化学计量学和量子化学计算方法设计合成MIPs。该方法能够从食物样本中提取氯乙酰胺类除草剂,回收率为83.4%~106.7%,RSD<13%。虚拟模板也可以有效降低模板泄露对分析过程的干扰,Du Wei等[12]选取沙丁胺醇作为虚拟模板,采用原位聚合的方法合成对盐酸莱克多巴胺具有选择吸附性的MIPs以避免模板泄漏的发生。色谱法测得MIPs对盐酸莱克多巴胺有较强的吸附能力,饱和吸附量为90.9 μg/g。
在固相微萃取中,商品化的萃取头有不耐有机溶剂、易出现过饱和和涂层剥落等现象,司丽丽[15]利用MIT制备的磺胺二甲嘧啶分子印迹固相微萃取整体柱克服了上述缺点。并建立了磺胺二甲嘧啶的检测方法,该方法的灵敏度高、重现性好,在0~10.0 μg/mL间有很好的线性关系(r=0.999 4),检测限为0.06 μg/mL,适用于检测样品中的痕量磺胺二甲嘧啶和其类似物[15]。
2.2 色谱分离
色谱分离(chromatographic resolution,CR)是一种能有效分离复杂混合物中各个组分的方法。MIPs因为易制备和重现性高,被广泛用于柱色谱中。分子印迹色谱柱的制备步骤简单、操作方便,针对性强,不需复杂的样品前处理[37]。Wang Shanshan等[18]选择DAUTA为虚拟模板,采用本体聚合方法制备出能同时测定环丙氨嗪和三聚氰胺的色谱柱。色谱评价结果显示,分子印迹色谱柱对三聚氰胺和环丙氨嗪具有特异性识别能力,而对其他化合物的交叉反应性较低。三聚氰胺的检测限和线性范围分别为0.12 μg/mL和0.12~10 μg/mL(r>0.999 4),而对环丙氨嗪的检测限和线性范围分别为0.05 μg/mL和0.05~10 μg/mL(r>0.998 6)。
本体聚合法制备的MIPs需要复杂的后处理工艺,且颗粒大小不均一,印迹位点可能会被破坏,从而会影响目标分子的选择性和吸附效果。原位聚合法能最大程度地减少印迹位点的破坏,李志伟等[17]采用原位聚合的方法制备了三聚氰胺MIPs整体柱,模板分子、功能单体和交联剂的物质的量比为1∶5∶20,三聚氰胺在1.0~100.0 μg/mL范围内线性关系良好,r=0.998 7 。加样回收率为87.0%~100.5%,RSD<5.0%(n=6)。该方法制备简单,试剂消耗量减少,并且印迹位点空间结构完整,是制备色谱柱的首选方法。与传统方法进行比较:用HPLC C18柱检测甲氧苄啶,在0.05~5.0 μg/mL(r=0.999 9)有较好的线性关系,回收率在80%~87%,RSD<7%[38];而分子印迹整体柱检测的线性范围是5.05~101 μg/mL(r=0.999 6),回收率是90%~104%,RSD在0.19%~0.74%[39],优于C18柱。
2.3 膜分离
分子印迹膜(molecular imprinted membrane,MIM)将膜分离的可连续化操作和MIPs的高选择性相结合,分为填充膜、整体膜和复合膜3种。MIM的制备方法包括原位聚合[22]、相转化[24]、表面修饰[41]和电化学聚合[42]等,具有处理量大、选择性高和容量大的优点[40-42],解决了目前的商售膜如超滤、微滤及反渗透膜等都无法实现单个物质的选择性分离的问题。但是MIM的膜通透量相较传统方法还是有一定的差距:红霉素采用超滤和纳滤相结合时膜通量为100 L/(m2·h)[43],而采用MIM达到最佳分离效果时的膜通量为64.69 L/(m2·h)[24]。
原位聚合法制备的MIM,操作简便、对模板分子识别的特异性较高,蔡良根等[22]以苏丹红Ⅰ为模板分子,聚偏氟乙烯微孔滤膜为支撑膜,二甲基甲酰胺和聚乙二醇20000为致孔剂,采用紫外光引发制备分子印迹复合膜。苏丹红Ⅰ与 MAA之间主要通过氢键相互作用,形成了对苏丹红Ⅰ具有较强特异性结合能力的识别位点。经过表征发现,该MIM表面呈多孔状,并且对模板分子及其结构类似物具有良好的选择性和渗透性能,可以在温度为30~80 ℃、pH值为1.5~10的条件下稳定使用。它具有结合速率快,吸附容量高,稳定性好的特点,能有效地选择性分离目标分子的优点,缺点是膜通透量较低。
为了提高MIM的特异识别性能和通透量,赵艳艳[41]制备了对手性物质具有识别和分离作用的新型有机-无机杂化MIM,实现了水相中手性氨基酸和氨基酸类似物的高效拆分。采用富含羟基和羧基的天然手性化合物海藻酸钠为功能单体,以D-苯丙氨酸为模板分子,通过相转化法制备了D-苯丙氨酸分子印迹膜。同时,以3-氨丙基三乙氧基硅烷为硅烷前驱体,采用原位溶胶-凝胶法制备了MIM,分离因子达到2.87,较好地实现了水相中混合物的拆分。
MIM的聚合方法还有电化学聚合方法,该方法多用于制备MIM传感器。Li Huaifen等[42]对核-壳印迹纳米粒子-甲基噻吩磺隆使用电化学发光方法进行选择 性识别。甲基噻吩磺隆分子复合膜的吸附效果为空白印迹膜的2.7 倍,电化学发光的强度与空白对照的发光强度相比提高显著。该传感器的最低检测限为0.32 mol/L,线性范围为5.0× 10-10~1.0×10-7mol/L,具有灵 敏度高,识别速度快、特异性和稳定性好等优点。
2.4 传感器
传感器是由信号转换器和识别元件构成,决定传感器检测性能的关键因素是识别元件,已有的识别元件在识别过程中选择性很高,但它们的制备成本较高、稳定性差、对环境要求高[44]。离子选择性电极测定四环素类药物,当样品浓度极低时(一般<10-6mol/L),会出现敏感膜中的待测离子向待测样品溶液中扩散的离子通量、内参比溶液中的待测离子的跨膜离子通量,导致敏感膜表面的待测离子浓度高于本体溶液浓度;而分子印迹整体柱四环素选择电极的检测限为6×10-9mol/L,且选择性、精密度和准确度较好,干扰性较小[45]。MIPs作为识别元件还具有耐高温、高压、酸碱和有机溶剂,不易被降解,可重复使用等优点[3]。
根据转换器的测量原理不同,传感器可分为光学传感器、电化学传感器和质量式传感器[44]。其中电化学传感器与MIT结合的研究较多,它的制备常使用膜分离和传感器技术结合,具有灵敏度高、选择性好、制备简单且成本低的优点[25-26]。并且在电极材料上的选择也有一定的区别,邵义娟等[25]采用循环伏安法在玻碳电极表面通过电聚合法合成了MIM,并以此作为识别元件制备了电流型烟酰胺分子印迹电化学传感器,结果表明在烟酰胺浓度在0.01~1.1 mol/L的范围内呈良好的线性关系。检测限达4.5×10-9mol/L。赵畅等[46]采用电化学法,在充蜡石墨电极上制作了传感器,通过原位修饰制备了一种基于三聚氰胺/纳米银/聚槲皮素的类分子印迹-纳米多孔膜。形态学表征发现,分子印迹-纳米多孔膜为三维网状结构。该纳米多孔膜修饰电极对三聚氰胺显示良好的选择性富集作用,氧化峰(0.17 V)电流和三聚氰胺的浓度在1×10-7~1×10-5mol/L范围内呈良好线性关系,检测限为1×10-8mol/L,有较好的抗干扰能力。Prasad等[47]用溶胶-凝胶合成复合陶瓷多壁碳纳米管电极并采用“表面接枝法”修改MIM,还对于电极表面修改引发转移终止剂(N, N-二乙基二硫代氨基甲酸苄)。在水溶液中检测多巴胺,检测限为0.143~0.154 ng/mL,没有出现干扰和假阳性,线性范围为0.994~14.855 ng/mL,并具有稳定性好,灵敏度高,可重复性使用等优点。
3 结 语
随着MIT的发展,该技术在药物残留检测中的应用越来越多,但是还有很多问题亟待解决:1)MIT除了上述聚合方法,还有一些新技术,例如:磁性MIPs,在外磁场条件下即可和溶液分离,缩短分离时间[48];微波辅助聚合技术可利用微波加热的方式引发聚合[49];量子化学模拟作为一种利用Gaussian软件模拟聚合过程的方法,由于计算准确度较高,对于分子印迹体系的理论与实验研究具有指导意义[34];嵌段共聚物的自组装技术由于自组装形成的“核-壳”结构的胶束尺寸属于纳米级,现已成为纳米材料研究的又一方向[42];可逆加成断裂链转移聚合,可以控制聚合物的分子质量及分布,实现活性/可控自由基聚合[50]。随着研究的深入,开发出更多关于聚合方 法的新技术是一个重要的课题。2)目前制备MIPs使用的功能单体种类较少,制备过程中不能满足某些模板的需要,开发和研究一些新型功能单体是一个急需解决的问题;3)大部分MIPs聚合过程只能在有机相下进行,
局限性较大,研究如何在水相下进行仍是一大难题;4)MIPs色谱柱的柱效还需要进一步的提高;5)模板渗漏问题虽然比以前有所改观,但仍未彻底解决;6)MIM的研究与传感器结合的较多,开发更多的MIM的应用方法是一个需要直面的问题,并且MIM的通透量还有待进一步提高;7)目前制备的传感器大多数是与MIM结合的电聚合的方式,如何开发新型分子印迹传感器也是一个重点;等等。尽管存在这些问题,MIT作为一门交叉学科仍然受到人们的广泛关注,并且MIT的产业化也将是一种趋势,SPE柱已经有产品面向市场。今后随着MIT的不断发展,研究中面临的困难也将一一解决,MIT的应用领域也会越来越广阔。
[1] 王秉栋. 食品卫生检验手册[ M]. 上海: 上海科学技术出版社, 2003: 94-203.
[2] 吴世康, 汪鹏飞. 分子印迹学: 从基础到应用[M]. 北京: 科学出版社, 2006: 6-13.
[3] 郑平, 姚剑, 徐业平. 分子印迹固相萃取技术及其在食品安全分析中的应用[M]. 合肥: 合肥工业大学出版社, 2011: 1-92.
[4] 谭天伟. 分子印迹技术及应用[M]. 北京: 化学工业出版社, 2010: 7-64.
[5] HE Chiyang, LONG Yuanyuan, PAN Junlan, et al. Application of molecularly imprinted polymers to solid-phase extraction of analytes from real samples[J]. Journal of Biochemical and Biophysical Methods, 2007, 70(2): 133-150.
[6] LÜ Yunkai, WANG Liming M, YANG Lei, et al. Synthesis and application of molecularly imprinted poly(methacrylic acid)-silica hybrid composite material for selective solid-phase extraction and high-performance liquid chromatography determination of oxytetracycline residues in milk[J]. Journal of Chromatography A, 2012, 1227(3): 48-53.
[7] 李倩. 四环素类分子印迹聚合物的合成及其识别性能的研究[D].北京: 中国农业科学院, 2010.
[8] PRADA A G V A D, RUIZ P M, REVIEJO A J, et al. Solid-phase molecularly imprinted on-line preconcentration and voltammetric determination of sulfamethazine in milk[J]. Analytica Chimica Acta, 2005, 539(1): 125-132.
[9] HU Shuguo, LI Li, HE Xiwen. Comparison of trimethoprim molecularly imprinted polymers in bulk and in sphere as the sorbent for solid-phase extraction and extraction of trimethoprim from human urine and pharmaceutical tablet and their determination by highperformance liquid chromatography[J]. Analytica Chimica Acta, 2005, 537(1/2): 215-222.
[10] SHI Xizhi, SONG Suquan, QU Guorun, et al. Water compatible molecularly imprinted polymer microspheres for extraction of ampicillin in foods[J]. Analytical Letters, 2010, 43(5): 757-767.
[11] ZHENG Yaqiu, LIU Yahong GUO Hongbin, et al. Molecularly imprinted solid-phase extraction for determination of tilmicosin in feed using high performance liquid chromatography[J]. Analytica Chimica Acta, 2011, 690(2): 269-274.
[12] DU Wei, FU Qiang, ZHAO Gang, et al. Dummy-template molecularly imprinted solid phase extraction for selective analysis of ractopamine in pork[J]. Food Chemistry, 2013, 139(1/4): 24-30.
[13] ZHANG Lei, HAN Fang, HU Yanhun, et al. Selective trace analysis of chloroacetamide herbicides in food samples using dummy molecularly imprinted solid phase extraction based on chemometrics and quantum chemistry[J]. Analytica Chimica Acta, 2012, 729(6): 36-44.
[14] ZHANG Zhaohui, YANG Xiao, ZHANG Huabin, et al. Novel molecularly imprinted polymers based on multi-walled carbon nanotubes with binary functional monomer for the solid-phase extraction of erythromycin from chicken muscle[J]. Journal of Chromatography B, 2011, 879(19): 1617-1624.
[15] 司丽丽. 磺胺二甲嘧啶分子印迹整体固相微萃取棒的制备及应用[D]. 广州: 中山大学, 2010.
[16] SUN Xiangli, HE Xiwen, ZHANG Yukui, et al. Determination of tetracyclines in food samples by molecularly imprinted monolithic column coupling with high performance liquid chromatography[J]. Talanta, 2009, 79(3): 926-934.
[17] 李志伟, 刘佳, 霍云霞, 等. 分子印迹整体柱用于测定奶制品中的三聚氰胺[J]. 食品科学, 2010, 31(12): 203-205.
[18] WANG Shanshan, LI Daomin, HUA Zhendong, et al. Molecularly imprinted monolith coupled on-line with high performance liquid chromatography for simultaneous quantitative determination of cyromazine and melamine[J]. Analyst, 2011, 136(18): 3672-3679.
[19] ZHENG Minmin, GUO Rui, ZHAO Xing, et al. Selective sample pretreatment by molecularly imprinted polymer monolith for the analysis of fluoroquinolones from milk samples[J]. Journal of Chromatography A, 2010, 1217(14): 2075-2081.
[20] LÜ Yunkai, ZHAO Mige, ZHANG Dong, et al. Enrofl oxacin-imprinted monolithic HPLC columns synthesized by in situ copolymerization for chromatographic separation[J]. Journal of Liquid Chromatography and Related Technologies, 2011, 34(9): 705-718.
[21] LIU Xianjun, LIU Jinzhong, ZHAO Rui, et al. Preparation of molecularly imprinted monolith for trimethoprim molecule and its chromato-graphic property[J]. Chemical Journal of Chinese Universities, 2007, 28(10): 1878-1880.
[22] 蔡良根, 徐小艳, 庞杰, 等. 苏丹红多孔分子印迹复合膜的制备及其性能研究[J]. 食品科学, 2013, 34(18): 70-74.
[23] 郭亚楠. 环丙沙星分子印迹膜的制备及其电化学检测体系研究[D].杭州: 浙江大学, 2012.
[24] 郝明燕. 红霉素分子印迹聚合物膜的制备及性能研究[D]. 西安: 西北工业大学, 2007.
[25] 邵义娟, 陈升龙, 李建平. 烟酰胺分子印迹电化学传感器研制及饮料中烟酰胺的测定[J]. 食品科学, 2013, 34(22): 332-335.
[26] GUERREIRO J R L, SALES M G F, MOREIRA F T C, et al. Selective recognition in potentiometric transduction of amoxicillin by molecularly imprinted materials[J]. European Food Research and Technology, 2011, 232(1): 39-50.
[27] 耿立媛. 兽药分子印迹微球的制备及应用研究[D]. 北京: 北京化工大学, 2011.
[28] LAI Jiaping, CAO Xianfeng, WANG Xiuling, et al. Chromatographic characterization of molecularly imprinted microspheres for the separation and determination of trimethoprim in aqueous buffers[J]. Analytical and Bioanalytical Chemistry, 2002, 372(2): 391-396.
[29] CEDERFU J, PEI Y X, MENG Z H, et al. Synthesis and screening of a molecularly imprinted polymer library targeted for penicilling[J]. Journal of Combinatorial Chemistry, 2003, 5(1): 67-72.
[30] 史西志, 杨华, 孙爱丽, 等. 氯霉素 分子印迹聚合物微球的制备及色谱性能评价[J]. 食品科学, 2010, 31(18): 95-98.
[31] 权英, 薛兴杰, 陈梦玲, 等. 沙拉沙星分子印迹聚合物的制备及其性能研究[J]. 食品科学, 2012, 33(12): 28-31.
[32] 杨挺, 皇甫伟国, 谢显传. 农药氯氰菊酯的分子印迹聚合物的合成及其结合性能研究[J]. 食品科学, 2009, 30(9): 85-88.
[33] GUO Hongsheng, HE Xinwen. Study of the binding characteristicsof molecular imprinted polymer selective for cefalexin in aqueous media[J]. Fresenius Journal of Analytical Chemistry, 2000, 368(5): 461-465.
[34] 刘俊渤, 石杨, 孙佳妮, 等. 三聚氰胺与丙烯酰胺单体分子印迹相互作用的理论研究[J]. 食品科学, 2012, 33(17): 96-101.
[35] 王颜红, 霍佳平, 张红, 等. 阿特拉津分子印迹固相萃取柱的制备及应用[J]. 分析化学研究简报, 2010, 38(5): 678-682.
[36] 闫宏远, 杨更亮. 分子印迹固相萃取技术在动物源食品中药物残留检测中的应用进展[J]. 色谱, 2011, 29(7): 572-579.
[37] LIU Haiyan, ROW K H, YANG Gengliang. Monolithic molecularly imprinted columns for chromatographic separation[J]. Chromatographia, 2005, 61(9/10): 429-432.
[38] 梅光明, 陈雪昌, 张小军, 等. 高效液相色谱法测定水产品中残留的甲氧苄啶[J]. 食品科学, 2010, 31(6): 248-251.
[39] 张红武, 史美丽, 李康, 等. 类模板分子印迹整体柱测定甲氧苄啶的研究[J]. 分析测试学报, 2011, 30(11): 1283-1289.
[40] 姜忠义, 喻应霞, 吴洪. 分子印迹聚合物膜的制备及其应用[J]. 膜科学与技术, 2006, 26(1): 78-84.
[41] 赵艳艳. 分子印迹膜分离手性氨基酸的研究[D]. 天津: 天津大学, 2007.
[42] LI Huaifen, XIE Chenggen, FU Xucheng. Electrochemiluminescence sensor for sulfonylurea herbicide with molecular imprinting core-shell nanoparticles/chitosan composite fi lm modifi ed glassy carbon electrode[J]. Sensors and Actuators B: Chemical, 2013, 181(1/4): 858-866.
[43] HE Yasan, CHEN Gang, JI Zhijuan, et al. Combined UF-NF membrane system for fi ltering erythromycin fermentation broth and concentrating the filtrate to improve the downstream efficiency[J]. Separation and Purifi cation Technology, 2009, 66(2): 390-396.
[44] BARRIOS C A, CARRASCO S, FRANCESCA M, et al. Molecularly imprinted polymer for label-free integratedoptical waveguide bio (mimetic) sensors[J]. Sensors and Actuators B: Chemical, 2012, 161(1): 607-614.
[45] 郭智勇, 盖盼盼, 段静, 等. 基于分子印迹整体柱的高灵敏度四环素选择电极的研究[J]. 药物分析杂志, 2010, 30(10): 1904-1908.
[46] 赵畅, 余波, 陈振兴, 等. 类分子印迹纳米多孔膜修饰电极制备三聚氰胺电化学传感器[J]. 食品科学, 2012, 33(4): 214-218.
[47] PRASAD B B, KUMAR D, MADHURI R, et al. Sol-gel derived multiwalled carbon nanotubes ceramic electrode modified with molecularly imprinted polymer for ultra trace sensing of dopamine in real samples[J]. Electrochimica Acta, 2011, 56(20): 7202-7211.
[48] CHEN Ligang, LIU Jun, ZENG Qinglei, et al. Preparation of magnetic molecularly imprinted polymer for the separation of tetracycline antibiotics from egg and tissue samples[J]. Journal of Chromatography A, 2009, 1216(18): 3710-3719.
[49] ZHANG Yi, LIU Ruijin, HU Yuling, et al. Microwave heating in preparation of magnetic molecularly imprinted polymer beads for trace triazines analysis in complicated samples[J]. Analytical Chemistry, 2009, 81(3): 967-976.
[50] PAG C, FS M. Molecularly imprinted polymer synthesis using RAFT polymerisation[J]. Sains Malaysiana, 2013, 42(4): 529-535.
Application of Molecular Imprinting Technology in the Detection of Drug Residues
ZHANG Cheng-bo, LI Zhao-zhou, HOU Yu-ze*, LI Dao-min, LI Song-biao, LI Zhi-kang, ZHANG Xiao-fan, ZHANG La-mei, LÜ Pu
(College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471003, China)
Molecular imprinting is a novel technique for efficient separation and molecular recognition. Owing to its simple preparation, specific recognition to the template molecule and good chemical and physical stabiity, it has been widely used in drug residue analysis in recent yeas. This paper focuses on recent app lications of molecular imprintin g technique in solid phase extraction, chromatographic separation, membrane separation and sensor. Furth ermore, the shortcomings and improvement directions are discussed. We expect that this paper could provide references for better applications of molecular imprinting in drug residue analysis.
molecular imprinting; drug residue detection; food safety
S859.84
A
1002-6630(2014)09-0323-06
10.7506/spkx1002-6630-201409063
2013-06-28
河南省教育厅2009年自然科学研究计划项目(2009A550003)
张成博(1986—),女,硕士研究生,研究方向为食品安全检测。E-mail:438977137@qq.com
*通信作者:侯玉泽(1956—),男,教授,硕士,研究方向为食品质量与安全。E-mail:huoyuze@126.com
