响应面法优化黑曲霉深层发酵产内切型菊粉酶工艺
2014-01-20曹泽虹高明侠高兆建靳卫涛张晨杰林占胜李雪晴
李 娟,曹泽虹,李 超,高明侠,高兆建,王 春,陈 阔,靳卫涛,张晨杰,林占胜,李雪晴,王 娟
响应面法优化黑曲霉深层发酵产内切型菊粉酶工艺
李 娟,曹泽虹*,李 超,高明侠,高兆建,王 春,陈 阔,靳卫涛,张晨杰,林占胜,李雪晴,王 娟
(江苏省食品资源开发与质量安全重点建设实验室,江苏省食品与生物工程实验中心,徐州工程学院食品(生物)工程学院,江苏 徐州 221008)
以黑曲霉菌种作为菌源,利用深层发酵法生产内切型菊粉酶。通过测定发酵液酶活力,从20株黑曲霉菌株筛选得到产菊粉酶活力最高的1 株黑曲霉菌株,酶活力为3.05 U/mL。通过单因素试验对最佳工艺条件进行研究,结果表明:培养基装液量为100 mL/250 mL、培养温度30 ℃、接种量1 cm2/250 mL、转速180 r/min、pH 5.0。在单因素试验的基础上,采用中心组合试验原理设计响应面法优化工艺条件,得到最佳工艺条件为:发酵液装液量 99 mL/250 mL、接种量0.99 cm2/250 m L、培养温度31 ℃、转速 180 r/min、pH 5.0。在此条件下,测得内切型菊粉酶的酶活力为 6.43 U/mL,比初始酶活力提高了 111%。
菊粉酶;黑曲霉;深层发酵;响应面法;工艺优化
低聚果糖(fructooligosaccharides)是在蔗糖分子的果糖残基上以β-1,2-键结合1~3 个果糖的低聚糖。它是一种良好的双歧因子和水溶性膳食纤维,低聚果糖甜度高、易溶解、能避免由蔗糖、葡萄糖引起的龋齿。其发热量少,是功能食品原料之一[1-2]。工业上生产低聚果糖有两种方法,一种是由蔗糖经β-果糖转移酶(β-fructosyl transferase)或转化酶(invertase)的转果糖基反应而生成的蔗果糖类,其产品中副产物葡萄糖和蔗糖多,反应不易控制。另一种是由内切型菊粉酶水解菊粉而成,产物为低聚果糖和少量果糖,与传统的以蔗糖作为原料生产低聚果糖的工艺相比,具有工艺简单、生产成本低、低聚果糖含量高(70%~90%)等优点。微生物产生的菊粉酶是低聚果糖工业化生产的主要酶制剂。霉菌所产菊粉酶的最适温度高、热稳定性好、适宜偏酸性的环境,对于菊粉酶用于低聚果糖工业化生产及防止生产中的污染十分有利[3]。
目前,我国对于该项研究重点是高产菊粉酶菌株的筛选和发酵条件的确定。目前外切型菊粉酶的报道较多,而对于内切型菊粉酶的研究报道较少。华侨大学的罗颠辉[4]从腐烂的牛蒡根际土壤中筛选出1菌株,为黑曲霉AC1,利用牛蒡菊糖为原料生产低聚果糖,酶活力可达26.41 U/mL。湖北工业大学的陈雄[5]利用固体发酵筛选得到1 株克鲁维酵母S120高产菊粉酶菌株,酶活力达118.28 U/g干质量。河北农业大学的祝彦忠等[6]用黑曲霉Ur-2利用紫外线和60Co ɣ射线诱变选育出菊粉酶高产菌株,其酶活力达180.33 ømol/(min·mL)。在我国,中国农业科学院饲料研究所、湖北大学、大连轻工业学院、西北农业大学等已经开展研究,利用菊芋、雪莲果等植物中的菊粉作为原料,通过黑曲霉、酵母等微生物产生的菊粉酶进行酶法生产低聚果糖,并申请了相关的国家发明专利。但利用菊糖生产低聚果糖的生产却仍未实现[7]。
本实验以徐州工程学院食品与生物工程实验中心酶工程实验室保藏的黑曲霉菌种作为菌源,利用深层发酵法生产内切型菊粉酶;利用单因素试验和响应面法对内切型菊粉酶发酵生产工艺进行优化,以期获得内切型菊粉酶生产的最佳工艺条件, 为利用牛蒡生产低聚果糖的工业化生产奠定一定的理论基础。
1 材料与方法
1.1 材料、试剂与培养基
牛蒡 徐州市百惠佳美时超市;菊糖 美国Sigma公司。
20 株黑曲霉菌株为徐州工程学院食品与生物工程实验中心酶工程实验室保藏。
初筛培养基:牛蒡汁3 mL(0.2g/mL)、蛋白胨1 g、酵母膏1 g、琼脂2 g、水100 mL,pH值自然。诱导培养基:牛蒡汁10 mL(0.2 g/mL)、酵母膏1 g、磷酸氢二钾1.5 g、琼脂 2g、水100 mL,pH值自然。发酵培养基:牛蒡汁2 mL(0.2 g/mL)、牛肉膏1.6 g、磷酸氢二钾0.5 g、磷酸氢二铵1.6 g、氯化钠0.5 g、琼脂2 g、水100 mL,pH值自然[4-7]。以上培养基配制好后,在121 ℃温度条件下高压灭菌30 min。
1.2 仪器与设备
7230G型可见分光光度计、FA2104N电子天平 上海精密科学仪器有限公司;PC-1000数显式电热恒温水浴锅、GZX-DH-600电热恒温干燥箱 上海跃进医疗器械厂;HYG型回旋式恒温调速摇瓶机 上海欣蕊自动化设备有限公司;YXQ-SG46-280S手提式压力蒸汽灭菌锅 上海博迅实业有限公司医疗设备厂;250D恒温光照培养箱 常州国华电器有限公司;SW-CJ-IF洁净工作台 苏州安泰空气技术有限公司;BCD-13OH TB海尔冰箱 青岛海尔股份有限公司。
1.3 方法
1.3.1 牛蒡汁的制备
取鲜牛蒡去皮、洗净,称取湿质量300 g加入沙冰机中,加适量水搅碎,用四层纱布过滤,滤渣适量加水重复压滤,滤液浓度为300 g牛蒡出300 mL汁(即为0.2 g/mL牛蒡汁),pH值自然,0.1 MPa灭菌30 min备用。
1.3.2 内切型菊粉酶酶活力的测定[3-8]
内切型菊粉酶酶活力的测定方法:发酵液经过6 000 r/min离心10 min,取一定浓度的酶液1.0 mL,加4.0 mL的牛蒡菊糖溶液,50 ℃条件下反应10 min,用3,5-二硝基水杨酸法测定产生还原糖的量,即向各管中加入3,5-二硝基水杨酸1.5 mL混匀,置于沸水浴中加热5 min,取出立即用自来水冷却至室温,加蒸馏水定容至25 mL,充分混匀,在540 nm波长处测定各管的OD540nm值,以葡萄糖含量为横坐标和OD540nm值为纵坐标绘制出标准曲线,获得回归方程y=0.018x-0.004 9(R2=0.999 1),计算酶活力。内切型菊粉酶活力单位定义为:在pH 5、50 ℃条件下每分钟水解菊糖生成1 μmol还原糖所需的酶量为1 个酶活力单位。
1.3.3 黑曲霉菌株的活化与筛选[6-14]
活化3 代,将保藏的20 株菌株分别接种于初筛培养基斜面培养基上,30 ℃恒温培养3 d;待黑曲霉孢子长出后,再接种于初筛培养基斜面上30℃恒温培养2 d;待黑曲霉孢子长出后,再接种于诱导培养基在培养皿上30 ℃恒温培养2 d。待黑曲霉孢子长出后,取1 cm2的孢子及培养基接种于装有80 mL发酵培养基的250 mL三角瓶中,置于摇瓶中,在30 ℃、180 r/min的条件下培养4 d,发酵液过滤后,取1 mL测定发酵液的酶活力,筛选出酶活力最高的菌株。
1.3.4 内切型菊粉酶发酵生产工艺单因素试验[3-6,10]
1.3.4.1 最佳发酵培养基装瓶量的选择
在250 mL的锥形瓶中分别加入60、80、100、120、140 mL的发酵培养基,将酶活最高的菌株接种于发酵培养基中,接种量为1.0 cm2的孢子及培养基/250 mL,在30 ℃、180 r/min条件下摇瓶培养4 d后,测定发酵液的酶活力,确定最佳发酵培养基装瓶量。
1.3.4.2 最佳接种量的选择
在250 mL的锥形瓶中加入100 mL的发酵培养基,再分别加入0.2、0.6、1.0、1.4、1.8 cm2的孢子及培养基,在30 ℃、180 r/min条件下摇瓶培养4 d后测定发酵液的酶活,确定最佳菌种接种量。
1.3.4.3 最佳发酵温度的选择
在250 mL的锥形瓶中加入100 mL的发酵培养基,再接入1.0 cm2的孢子及培养基,分别在24、27、30、33、36 ℃温度下,在180 r/min条件下摇瓶培养4 d后,测定发酵液的酶活,确定最佳发酵温度。
1.3.4.4 最佳转速的选择
在250 mL的锥形瓶中加入100 mL的发酵培养基,再接入1.0 cm2的孢子及培养基,分别用120、150、180、210、240 r/min的转速,在30 ℃条件下摇瓶培养4 d后,测定发酵液的酶活,以确定最佳转速。
1.3.4.5 最佳pH值的选择
在250 mL的锥形瓶中加入100 mL的发酵培养基,再接入1.0 cm2的孢子及培养基,分别在pH 4.0、4.5、5.0、5.5和6.0条件下,30 ℃、180 r/min条件下摇瓶培养4 d后,测定酶活力,确定最佳pH值。
1.3.5 响应面法优化发酵工艺条件[15-22]
在单因素试验结果基础上,采用中心组合试验(central composite design,CCD)原理设计方案,对装液量(X1)、接种量(X2)和温度(X3)进行曲面响应试验设计,并以+1、0、-1分别代表变量的水平,按方程xi=(Xi-X0)/ΔX对自变量进行编码,其中,xi为变量的编码值,Xi为变量的真实值,X0为试验中心点变量的真实值,ΔX为变量的变化步长,酶活力为响应值(Y)。采用SAS对实验数据进行回归分析。
1.3.6 黑曲霉的菌种鉴定[23-25]
将菌样寄给生工生物工程(上海)股份有限公司进行菌种鉴定,对菌种的18S rDNA进行全序列分析,然后利用基因库进行比对,最后建立系统进化树,确定菌种所属。
2 结果与分析
2.1 黑曲霉菌株的活化与筛选
以牛蒡汁为碳源,20 株黑曲霉菌株在发酵培养基中产生的酶活力结果如表1所示。菌株08013的酶活力最高,为3.05 U/mL,后期实验以08013菌株作为实验菌株。
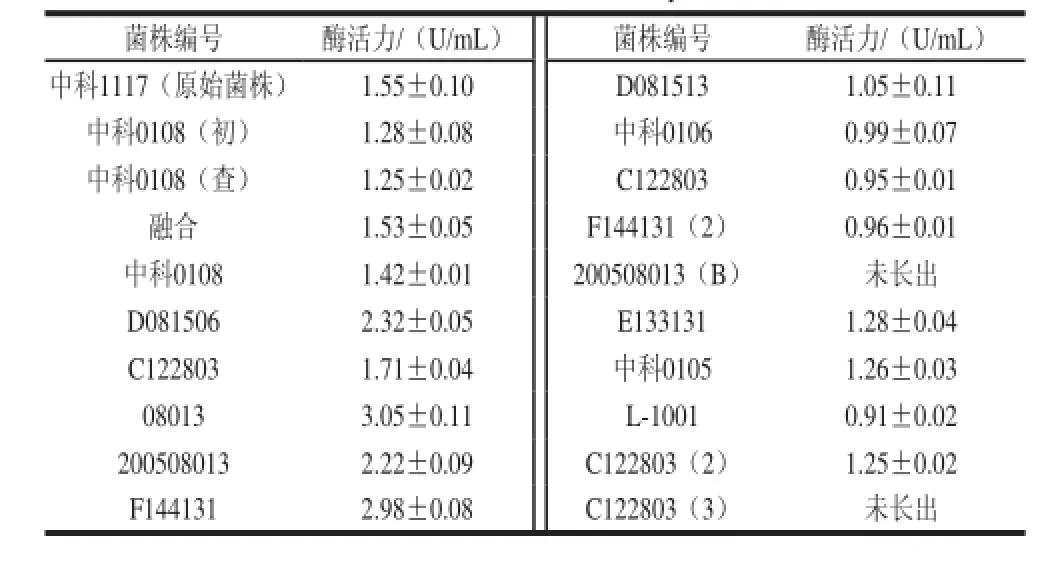
表1 20 株黑曲霉菌株的酶活力Table 1 Endoinulinase activities of twenty Aspergillus niger strains
2.2 内切型菊粉酶发酵工艺条件单因素试验
2.2.1 最佳发酵培养基装瓶量的确定

图1 发酵培养基装瓶量对内切型菊粉酶活力的影响Fig.1 Effect of culture medium volume on the endoinulinase activity
如图1所示,当发酵培养基的装瓶量从60 mL/250 mL到 100 mL/250 mL时,内切型菊粉酶的酶活力呈上升趋势,当发酵培养基的装瓶量为100 mL/250 mL时,内切型菊粉酶的酶活力最高,为6.27 U/mL;当装瓶量继续增加时,内切型菊粉酶的酶活力呈下降趋势,说明在100 mL/250 mL时,发酵培养基中的营养物质的量与微生物的接种量达到最合适的比例,因此内切型菊粉酶的酶活达到最高。
2.2.2 最佳菌种接种量的确定
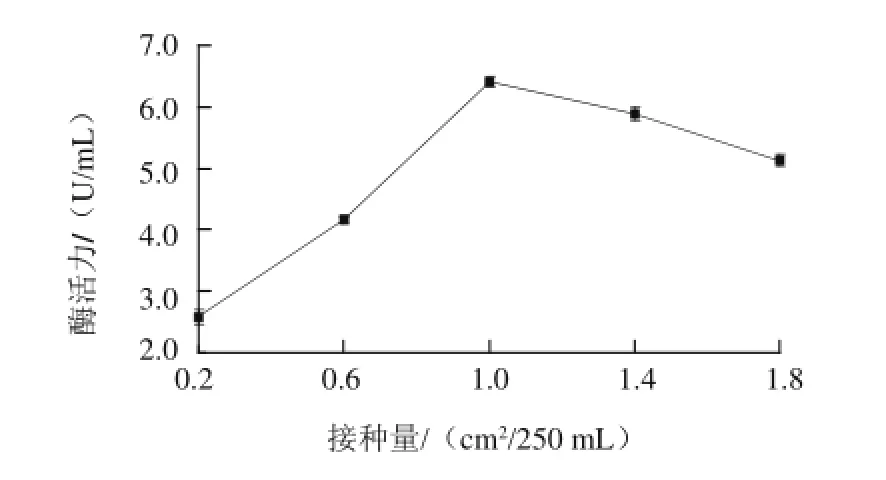
图2 菌种接种量对内切型菊粉酶活力的影响Fig.2 Effect of inoculum concentration on the endoinulinasec activity
如图2所示,当菌种接种量从0.2 cm2/250 mL到1 cm2/250 mL时,内切型菊粉酶的酶活力呈上升趋势,当菌种接种量为1 cm2/250 mL时,内切型菊粉酶的酶活力最高,为6.41 U/mL;当菌种接种量从1.0 cm2/250 mL到1.8 cm2/250 mL时,内切型菊粉酶的酶活力呈下降趋势,说明在菌种接种量为1 cm2/250 mL时,菌种数量和培养基的营养物质的量达到最适合的比例,因此内切型菊粉酶的酶活力达到最高。
2.2.3 最佳发酵温度的确定
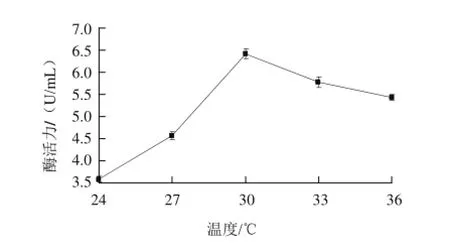
图3 发酵温度对内切型菊粉酶活力的影响Fig.3 Effect of culture temperature on the endoinulinase activity
如图3所示,当发酵温度从24 ℃升至30 ℃时,内切型菊粉酶的酶活力呈上升趋势,当发酵温度为30 ℃时,内切型菊粉酶的酶活力最高,为6.42 U/mL;当发酵温度从30 ℃升至36 ℃时,内切型菊粉酶的酶活力呈下降趋势,说明在30 ℃时,菌株的生长达到最佳状态,酶活力达到最高。
2.2.4 最佳转速的确定
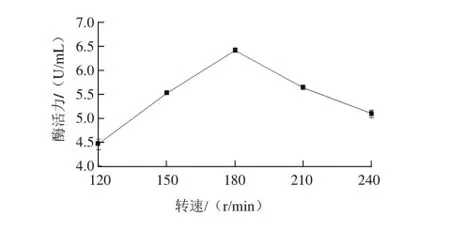
图4 摇瓶机转速对酶活力的影响Fig.4 Effect of shaking speed on the endoinulinase activity
如图4所示,当摇瓶机转速从120 r/min升至180 r/min时,内切型菊粉酶的活力呈上升趋势,当摇瓶机转速为180 r/min时,内切型菊粉酶的活力最高,为6.42 U/mL;当转速继续升高时,内切型菊粉酶的活力呈下降趋势,说明当摇瓶机转速为180 r/min时,培养基中的含氧量最适合菌种的发酵生产,酶活力也最高。
2.2.5 最佳pH值的确定
如图5所示,当发酵培养基pH值从4.0升至5.0时,内切型菊粉酶的活力呈上升趋势;当pH值为5.0时,内切型菊粉酶的活力最高,为6.28 U/mL;当pH值从5.0升至6.0时,内切型菊粉酶的活力呈下降趋势,说明该酶适合在偏酸性条件下发挥作用。
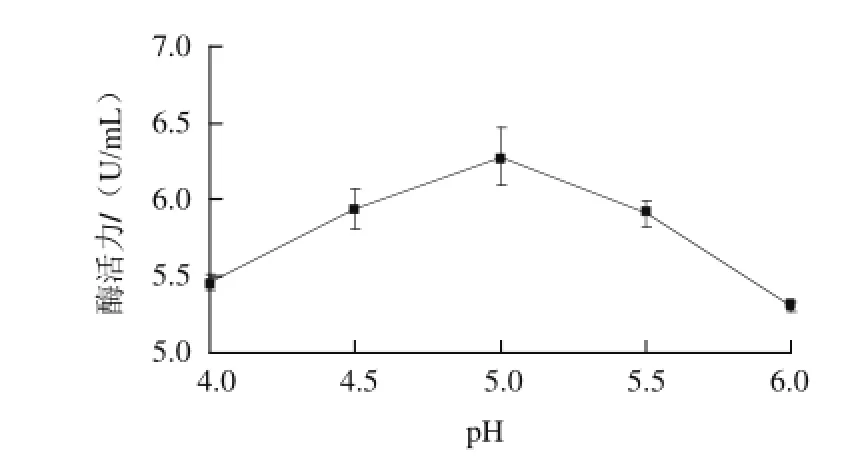
图5 pH值对内切型菊粉酶活力的影响Fig.5 Effect of medium pH on the endoinulinase activity
2.3 响应面法优化发酵工艺条件
2.3.1 模型的建立及其显著性检验
根据以上单因素试验结果,选取发酵培养基装瓶量、菌种接种量和发酵温度这3 个影响比较大的因素为主要因素,采用CCD响应面试验设计方案,试验结果和方差分析如表2、3所示。
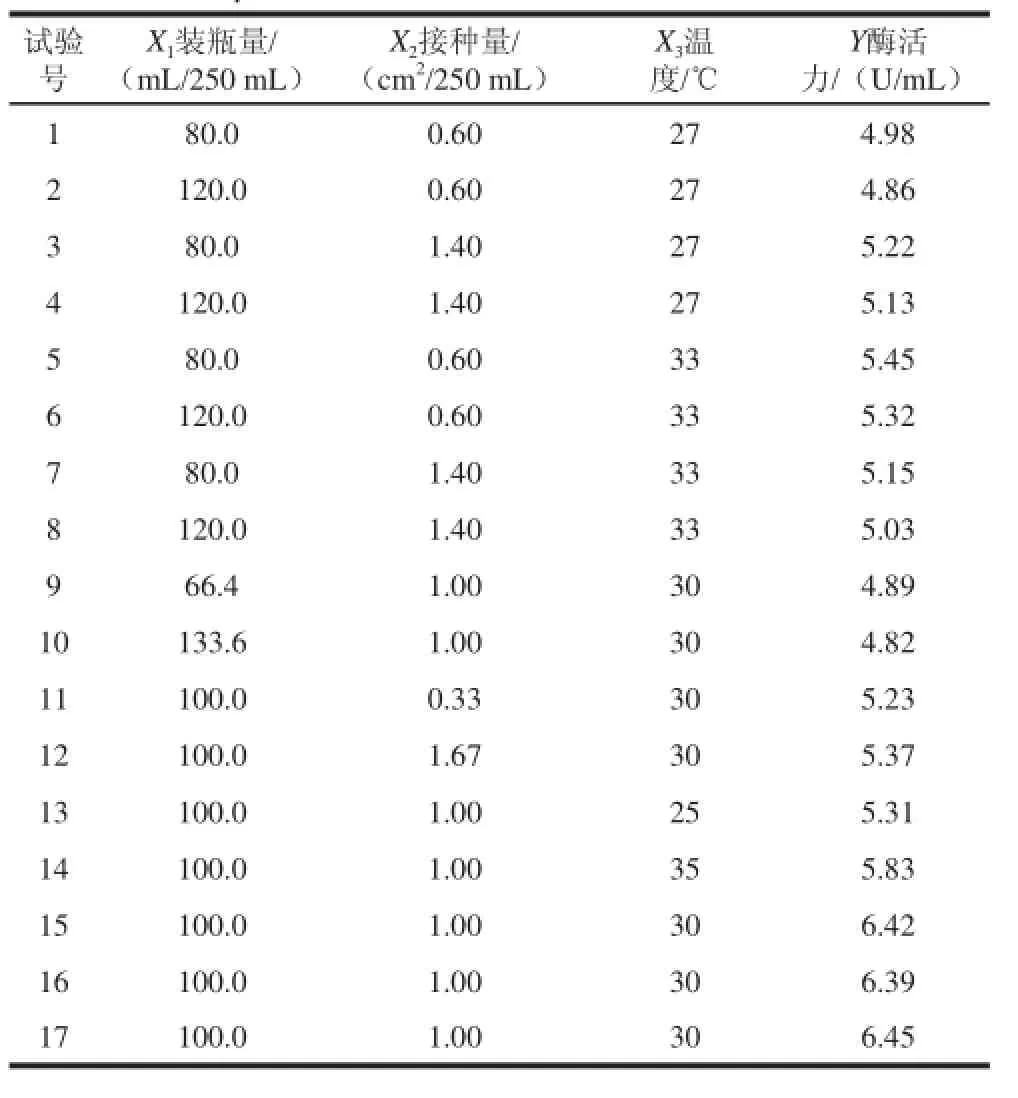
表2 CCD优化试验设计方案及结果Table 2 Central composite design scheme and results for the optimization of fermentation conditions
由表3可知,模型具有极显著性(P<0.01),失拟项(P>0.05)不显著以及R2Adj=0.985和信噪比(RSN)为33.292,远大于4,可知回归方程拟合度和可信度均很高,试验误差较小,说明模型相关度很好,自变量与响应值之间存在线性关系,模型是非常显著的,因此,回归方程可以较好地描述各因素与响应值之间的真实关系,可以用于最佳发酵工艺条件的优化,所以可以使用该模型来分析响应值的变化。

表3 回归方程的方差分析Table 3 Analysis of variance for the regression equation
2.3.2 响应曲面分析与优化
根据回归分析结果,作出相应曲面图和等高线图,如图6所示。响应值存在最大值,各参数间的等高线呈椭圆形,相互作用显著,而且能清晰地看到最高点。说明装瓶量与接种量之间、装瓶量与温度之间、温度与接种量之间的相互作用显著,所以可以对装瓶量、接种量、温度3 个作用比较显著的因素进行分析计算,从而得出最佳发酵工艺条件。
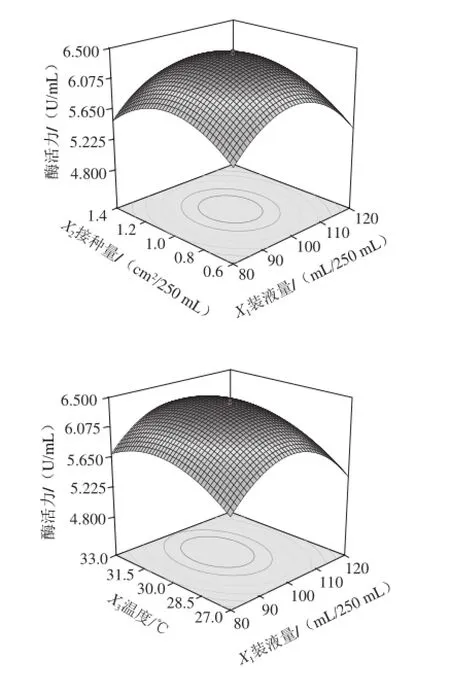
经SAS软件分析计算,得到最佳发酵工艺条件为:发酵培养基装瓶量99 mL/250 mL、菌种接种量0.99 cm2/250 mL、温度31 ℃,此时酶活力可达6.43 U/mL,比初始菌株的酶活力提高了111%。
2.3.3 验证实验
为检验CCD试验设计所得结果的可靠性,在上述最优条件下进行3 次平行实验,实际测得的平均酶活力为6.42 U/mL,与预测值基本相符,因此基于CCD验设计所得的最佳发酵工艺条件准确可靠,具有实用价值。
2.4 黑曲霉菌株的鉴定
通过对实验菌株08013的18S rDNA进行全序列分析,得到1 308 bp长的序列。将该序列用GenBank进行比对,根据同源性分析表,建立系统进化树如图7所示。08013菌株与GU226429菌株黑曲霉(Aspergillus niger)的同源性达到99%,所以鉴定菌株08013为黑曲霉(Aspergillus niger)。
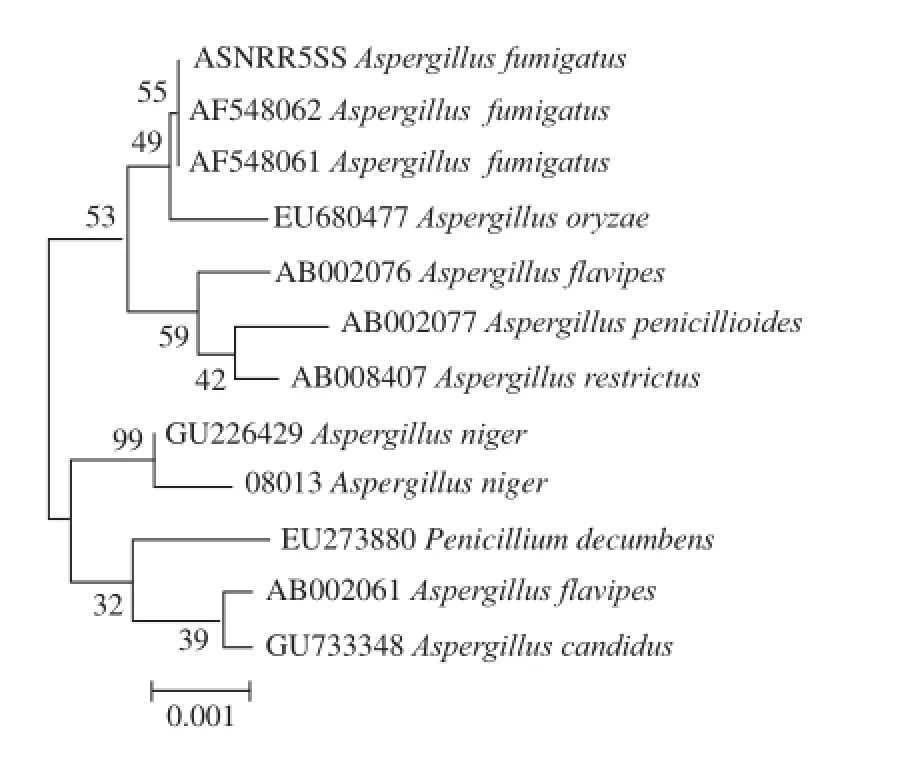
图7 黑曲霉菌株的系统发育进化树Fig.7 Phylogenetic tree of Aspergillus niger strains
3 结 论
对实验室原有保藏的20 株黑曲霉菌株活化和发酵,通过测定发酵液酶活,筛选出1 株编号为08013的内切型菊粉酶菌株,其酶活力为3.05 U/mL。通过对08013菌株的发酵生产工艺的单因素试验,得出各单因素的最佳条件:最佳发酵培养基装瓶量为100 mL/250 mL,最佳温度为30 ℃,最佳菌种接种量为1 cm2/250 mL;最佳转速为180 r/min;最佳pH值为5.0。在单因素试验的基础上,采用CCD响应面法软件优化工艺条件,得到最佳工艺条件为:发酵液装瓶量99 mL/250 mL、菌种接种量 0.99 cm2/250 mL、温度31 ℃、转速180 r/min、pH 5.0,在此条件下,测得内切型菊粉酶的酶活为 6.43 U/mL。通过对发酵工艺条件的优化,使最终酶活力比初始酶活(3.05 U/mL)提高了111%。
通过对实验菌株08013的18S rDNA进行全序列分析,再进行基因库比对,建立系统进化树,得知08013菌株为黑曲霉(Aspergillus niger)。
[1] VISWANATHAN P, KULKARNI P R. Full factorial design to study fermemtative production of inulinases using inulin from kuth (saussurealappa) root powder by Aspergillus niger van teighemu UV11 mutant[J]. Bioresource Technology, 1995, 54: 117-121.
[2] GOUDA M K. Some properties of inulinase from Aspergillus fumigatus[J]. Biological Sciences, 2002, 5(5): 589-593.
[3] 李文利, 曹泽虹, 董玉玮, 等. 黑曲霉原生质体诱变选育内切型菊粉酶生产菌株的研究[J]. 食品科学, 2012, 33(9): 144-148.
[4] 罗巅辉, 王昭晶. 利用牛蒡菊糖筛选产菊糖酶菌株的研究[J]. 福建师范大学学报: 自然科学版, 2006, 22(4): 88-96.
[5] 陈雄. 内切型菊粉酶高活力菌株的筛选[J]. 湖北农业科学, 2003(3): 93-94.
[6] 祝彦忠, 贾英民, 桑亚新, 等. 黑曲霉Uγ- 2菊粉酶发酵条件的研究[J]. 中国食品学报, 2006, 6(4): 58-60.
[7] 华承伟, 王建华, 滕达, 等. 菊粉化学和微生物菊粉内切酶研究进展[J].中国食品学报, 2004, 4(4): 103-108.
[8] CASTRO G R, BAIGORI M D, SINERIZ F. A plate technique for screening of inulin degrading microorganisms[J]. Microbiological Methods, 1995, 22: 51-56.
[9] CASTRO G R, BAIGORI M D, SINERIZ F. A plate technique for screening of inulin degrading microorganisms [J]. Microbiological Methods, 1995, 22: 51-56.
[10] 唐艳斌, 许波, 唐湘华, 等. 产菊粉酶曲霉菌株的筛选和发酵条件的优化[J]. 饲料研究, 2008(7): 32-35.
[11] FLOOD A E, RUTHERFORD P P, WESTON E W. Effects of 2,4-dichlorophenoxyacetic acid on enzyme systems in Jerusalem artichoke tubers and Chicory roots[J]. Nature, 1967, 214: 1049-1053.
[12] 李云雁, 胡传荣. 试验设计与数据处理[M]. 2版. 北京: 化学工业出版社, 2009: 199-201.
[13] 北京大学生物系生物化学教研室. 生物化学实验指导[M]. 北京: 高等教育出版社, 1979: 122-241.
[14] 袁玉荪, 朱婉华, 陈钧辉. 生物化学实验[M]. 2版. 北京: 高等教育出版社, 1988: 118-121.
[15] 孙子羽, 迟乃玉, 李兵, 等. 响应面法优化产低温生淀粉糖化酶发酵培养基[J]. 食品工业科技, 2008, 29(4): 50-89.
[16] 陶跃中, 姜辉, 舒志愚, 等. 响应面法优化茯苓菌丝体多糖的提取工艺研究[J]. 安徽农业科学, 2010, 38(17): 9095-9097; 9364.
[17] 田智斌, 董超, 史延茂, 等. 纳豆激酶固态发酵工艺参数的两种不同设计方法优化[J]. 食品与发酵工业, 2013, 39(1): 134-141.
[18] 吴现芳, 赵成爱, 余梅燕, 等. 响应面法优化八宝景天叶总黄酮的超声提取工艺[J]. 食品工业科技, 2013, 34(1): 224-228.
[19] 杨晓红, 王元秀, 郑明洋. 响应面法优化啤酒酵母海藻糖提取工艺[J].济南大学学报: 自然科学版, 2013, 27(3): 270-274.
[20] 葛静微, 罗均, 李小定, 等. 响应面分析法优化血红素提取工艺[J].食品科学, 2010, 31(8): 60-64.
[21] 杨涛, 盛欢欢, 李岩. 星点设计-响应面法优化穿心莲提取工艺[J]. 中国药学杂志, 2011, 46(3): 208-213.
[22] 黄元红, 卫天喜, 张发生, 等. 星点设计-响应面法优选丹参提取工艺[J].中国实验方剂学杂志, 2010, 16(17): 28-31.
[23] 李秀婷, 孙宝国, 宋焕禄, 等. 一株高产木聚糖酶的枝链霉菌的分离鉴定及产酶[J]. 微生物学通报, 2010, 37(6): 791-797.
[24] 李辉, 刘光全, 程池. 2株酸梅汤饮料污染霉菌的分离与鉴定研究[J].中国食品学报, 2009, 9(6): 182-186.
[25] 汪鹏荣, 刘伟芬, 陈文静, 等. 1株高产多糖红曲霉菌株的分离鉴定及生物学特性研究[J]. 微生物学杂志, 2011, 31(2): 13-16.
Optimization of Submerged Fermentation Conditions by Response Surface Analysis for Endoinulinase Production by Aspergillus niger
LI Juan, CAO Ze-hong*, LI Chao, GAO Ming-xia, GAO Zhao-jian, WANG Chun, CHEN Kuo, JIN Wei-tao, ZHANG Chen-jie, LIN Zhan-sheng, LI Xue-qing, WANG Juan
(Jiangsu Key Construction Laboratory of Food Resource Development, Quality and Safety, Jiangsu Experiment Center of Food and Biological Engineering, College of Food (Biology) Engineering, Xuzhou Institute of Technology, Xuzhou 221008, China)
Aspergillus niger 08013, showing the highest endoinulinase activity of 3.05 U/mL was screened from 20 Aspergillus niger strains conserved in our laboratory. The results of one factor-at-a-time experiments showed that the appropriate fermentation conditions were 100 mL of medium in a 250-mL triangular flask, 30 ℃, an inoculum size of 1 cm2/250 mL, shaking at a speed of 180 r/min and pH 5.0. The optimal fermentation conditions were determined by central composite design and response surface methodology to be 99 mL of medium in a 250-mL triangular flask, 31 ℃, an inoculum size of 0.99 cm2/250 mL, shaking at a speed of 180 r/min and pH 5.0. Under the optimized conditions, the activity of endoinulinase produced by the strain 08013 was 6.43 U/mL, which was increased by 111% as compared to the initial activity before the optimization, 3.05 U/mL.
inulinase; Aspergillus niger; submerged fermentation; response surface analysis; optimization
TS201.3
A
1002-6630(2014)09-0207-06
10.7506/spkx1002-6630-201409041
2013-09-29
江苏省高校自然科学研究计划项目(07KJD550202);徐州市科技发展指导性计划项目(XZZD1204);徐州工程学院校级培育课题(XKY2011109);2013年度国家星火计划项目(2013GA690418);江苏省高校自然科学研究项目(13KJD550006);徐州市科技计划项目(XF12C028);江苏省大学生实践创新训练计划项目(XCX2014039)
李娟(1991—),女,本科,研究方向为食品加工技术。E-mail:82484948@qq.com
*通信作者:曹泽虹(1963—),女,副教授,本科,研究方向为食品生物技术与酶工程。E-mail:czh001001@163.com
