荧光光谱法研究牛血清白蛋白与柠檬黄和日落黄的相互作用
2014-01-20刘志栋韩德权杨卫卫李雪茹邵淑双孙庆申
刘志栋,韩德权,杨卫卫,李雪茹,邵淑双,孙庆申
荧光光谱法研究牛血清白蛋白与柠檬黄和日落黄的相互作用
刘志栋,韩德权,杨卫卫,李雪茹,邵淑双,孙庆申*
(黑龙江大学生命科学学院,黑龙江省微生物高校重点实验室,教育部农业微生物工程中心,黑龙江 哈尔滨 150080)
用紫外-可见光吸收光谱、荧光发射光谱法研究牛血清白蛋白与柠檬黄和日落黄之间的相互作用;用Stern-Volmer方程处理实验数据,得到310 K时的动态猝灭速率常数(KQ)分别为2.51×105L/mol和1.42×105L/mol;用Lineweaver-Burk双倒数函数方程处理实验数据,得到310 K时静态猝灭常数(KLB)依次为5.79×105L/mol和5.56×105L/mol;用lg((F0-F)/F)=lgK0+nlgρ处理实验数据,得到结合位点数(n)分别为0.556 95、0.640 56。并且两种色素在质量浓度为0~3 μg/mL范围内其含量与荧光猝灭强度具有良好的线性关系。
牛血清白蛋白;柠檬黄;日落黄;荧光猝灭
牛血清白蛋白(bovine serum albumin,BSA)是用于研究荧光猝灭过程最常用的模型蛋白之一[1-4],研究小分子物质与BSA的色氨酸或者酪氨酸相互作用导致这些氨基酸周围环境发生改变,从而引发蛋白质的荧光强度发生改变,借此来探讨小分子物质对蛋白质的荧光猝灭机制,并对小分子物质进行定量分析具有重要的理论及应用价值[4-8]。食用人工合成类色素物质与人类的生活息息相关[9-10],其中柠檬黄、日落黄等色素经常被添加到饮料中,这些物质添加过量会对身体造成伤害,因此研究这些色素与BSA之间相互作用的机理,并进一步建立色素与BSA的定量关系,有望为国家有关职能部门完成对饮料市场中色素含量的监测提供一种参考方法,并且为国家相关职能部门制定食品中色素类物质的添加标准提供理论参考,以便完成饮料中色素含量的快速检测。
荧光光谱分析法具有高灵敏度、高准确度和高选择性的特点[9],应用荧光光谱分析进行食品色素检测,可提高检测水平,为食品工业生产和食品安全监管提供帮助。本实验用紫外-可见光吸收光谱、荧光发射光谱研究了BSA与柠檬黄、日落黄的相互作用,初步建立了两种色素与牛血清白蛋白作用的线性方程关系。
1 材料与方法
1.1 材料、试剂与仪器
牛血清白蛋白(储备液质量浓度为0.1 mg/mL,使用时稀释成0.01 mg/mL)、柠檬黄与日落黄(储备液质量浓度为0.1 mg/mL,使用时稀释成0.01 mg/mL) 上海楷洋生物技术有限公司;实验用水为二次蒸馏水。
RF-5301型荧光分光光度计、UV-2550型可见-紫外分光光度计 日本岛津公司。
1.2 方法
用移液器移取1.0 mL质量浓度为0.1 mg/mL的BSA、柠檬黄、日落黄溶液分别于3 支10 mL的具塞比色管中,用二次蒸馏水定容至10 mL。37 ℃水浴20 min,取出后迅速进行紫外-可见光谱检测。扫描范围250~600 nm,采样间隔1 nm,扫描速度:Super,灵敏度:High,响应时间:Auto,记录紫外-可见吸收光谱。
用移液器移取1.0 mL质量浓度为0.1 mg/mL的BSA溶液于10 mL的具塞比色管中,加入一定量的柠檬黄、日落黄色素溶液,用二次蒸馏水定容至10 mL。37 ℃水浴20 min,取出后迅速进行荧光光谱检测。固定激发波长283 nm,扫描发射波长300~400 nm,荧光发射与激发狭缝宽度均为5 nm[1,5,7-8],记录其荧光发射光谱。
2 结果与分析
2.1 最佳激发波长的选取

图1 2 mg/mL BSA紫外-可见光吸收扫描光谱图Fig.1 UV-visible absorption spectrum of 2 mg/mL BSA

图2 0.01 mg/mL柠檬黄紫外-可见光吸收扫描光谱图Fig.2 UV-visible absorption spectrum of 0.01 mg/mL lemon yellow
由图1~3可知,牛血清白蛋白、柠檬黄、日落黄的最佳吸收波长依次为283、482、428 nm。上述物质虽然最佳吸收波长不同,但是就整个光谱而言还是存在着很大程度的光谱叠加,因而不同波长条件下检测这两种色素含量的方法使用就会受到限制。通过本部分实验,可以初步了解被测试物的质量浓度与其吸光度A之间的关系;由于荧光光谱法的灵敏度是紫外吸收光谱法的100 倍左右,也为后期荧光猝灭光谱实验条件的选择提供了指导。此外,为了更好的研究色素质量浓度与BSA内源性荧光的猝灭关系,选取BSA的最佳激发波长283 nm作为后续实验的测试条件。
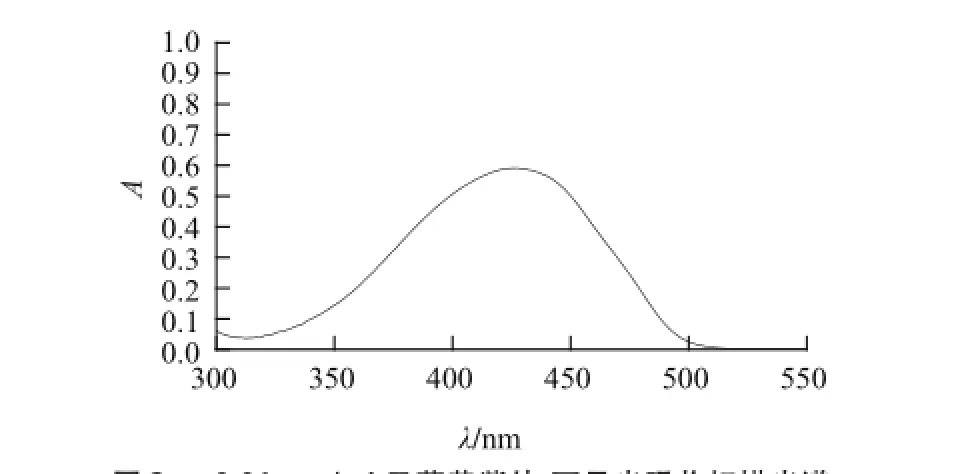
图3 0.01 mg/mL日落黄紫外-可见光吸收扫描光谱Fig.3 UV-visible absorption spectrum of 0.01 mg/mL sunset yellow
2.2 动态猝灭速率常数(KQ)的计算
动态猝灭遵循Stern-Volmer方程F0/F=1+KSVρ= 1+KQτ0ρ[11-12],式中:F0与F分别表示猝灭剂存在前后荧光分子的荧光强度;KSV表示动态猝灭常数;KQ表示动态猝灭速率常数;τ0为生物大分子的荧光寿命,约为10-8s[13];ρ为猝灭剂即柠檬黄、日落黄的质量浓度/(μg/mL)。假设图4、5所示的荧光猝灭现象是分子碰撞引起的动态猝灭,按Stern-Volmer方程,以(F0/F)-ρ作出该体系的Stern-Volmer曲线,见图6,动态猝灭相关参数见表1。

图4 柠檬黄对BSA的荧光猝灭光谱图Fig.4 Fluorescence quenching spectra of lemon yellow against BSA

图5 日落黄对BSA的荧光猝灭光谱图Fig.5 Fluorescence quenching spectra of sunset yellow against BSA
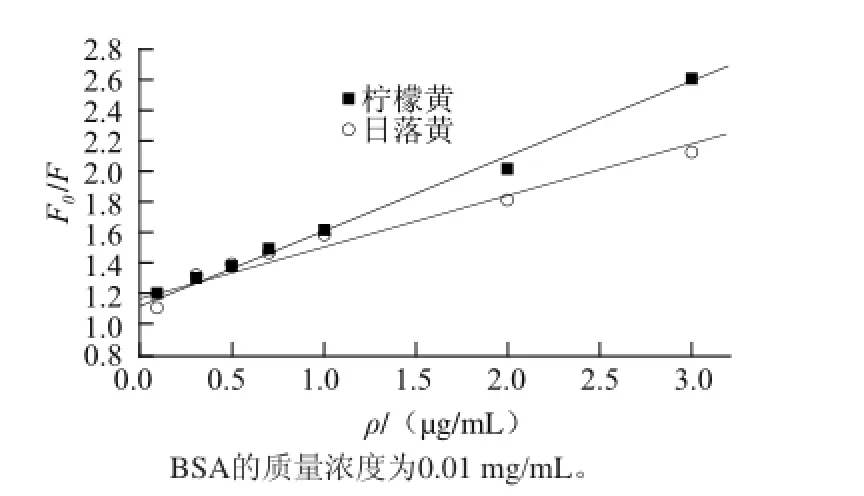
图6 不同色素对BSA的动态猝灭曲线Fig.6 Dynamic quenching curves of BSA in the presence of different pigments

表1 动态猝灭相关参数Table 1 Dynamic quenching equation parameters
由表1可知,在310 K条件下KQ依次为 2.51×1013、1.42×1013L/(mol·s)。由于各类猝灭剂对生物大分子的最大扩散碰撞猝灭速率常数为2.0×1010L/(mol·s)[14],显然,柠檬黄、日落黄对BSA荧光猝灭速率常数KQ远大于这一值,可见动态碰撞猝灭不是该体系的主要猝灭原因,即各类色素对BSA内源性荧光猝灭的主要原因不是分子间的碰撞引起的[15]。
2.3 静态猝灭常数(KLB)的计算
若体系为静态猝灭,静态猝灭可用Lineweaver-Burk双倒数函数1/(F0-F)=1/F0+1/KLBF0ρ[16-17],式中:F0为BSA本身的荧光强度;F为添加不同质量浓度柠檬黄、日落黄后BSA的荧光强度;KLB为静态猝灭常数;ρ为猝灭剂即柠檬黄、日落黄的质量浓度/(μg/mL)。由实验数据以(F0/(F0-F))-1-1/ρ作图得到310 K的条件下Lineweaver-Burk双倒数函数曲线(图7),其线性方程及相关参数见表2。
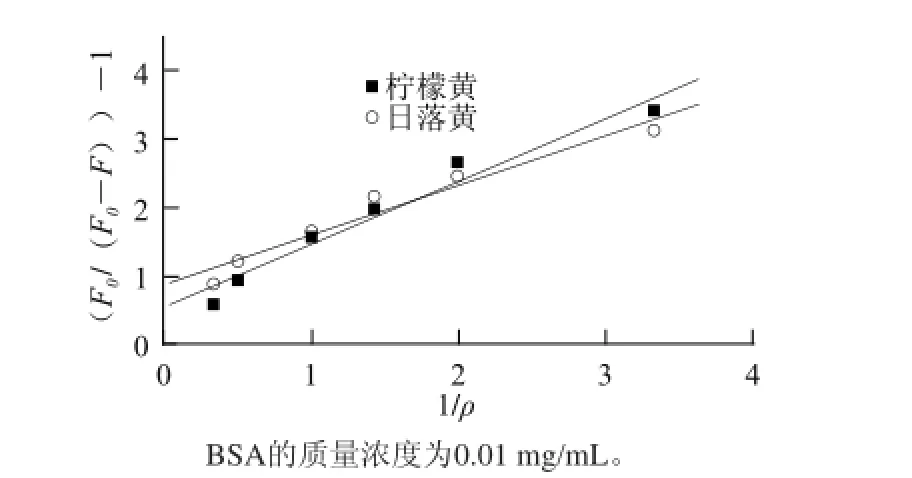
图7 不同色素对BSA的静态猝灭曲线Fig.7 Static quenching curves of BSA in the presence of different pigments

表2 静态猝灭相关参数Table 2 Static quenching equation parameters
综合考虑动态、静态拟合方程的相关系数及由其计算得到的反应速率常数,可知实验数据的拟合更适合于静态方程,即该体系更符合荧光静态猝灭规律,各类色素对BSA的荧光猝灭的原因是二者之间形成了络合物或复配物[18]。
2.4 结合位点数n值的计算
有机小分子与蛋白质等生物大分子相互作用的结合位点数可由lg((F0-F)/F)=lgK0+nlgρ计算。式中:F0、F分别为未加入和加入猝灭剂后荧光物质的荧光强度;K0为猝灭反应的表观结合常数;n为结合位点数;ρ为柠檬黄、日落黄的质量浓度/(μg/mL)。由实验数据,绘制的BSA与柠檬黄、日落黄的lg((F0-F)/F)-lgρ的曲线见图8、9。

图8 柠檬黄与BSA作用的lg((F0-F)//F)--llggρ图Fig.8 lg((F0-F)/F) vs. lgρ graph describing the interaction between lemon yellow and BSA
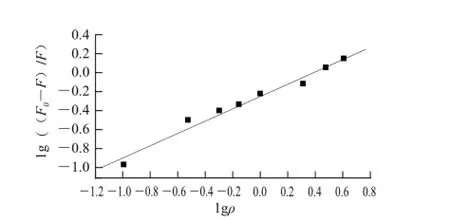
图9 日落黄与BSA作用的lg((F0-F)//F)--llggρ图Fig.9 lg((F0-F)/F) vs. lgρ graph describing the interaction between sunset yellow and BSA
由实验数据计算出图8、9中直线的斜率,依次为0.556 95、0.640 56,即1个BSA分子可以与1个柠檬黄分子结合或者1个日落黄分子结合。
3 结 论
通过在310 K条件下,考察柠檬黄、日落黄对BSA有的荧光猝灭作用机制可知,两种色素分子与BSA之间存在静态猝灭过程,并且当色素质量浓度分别在0~3 μg/mL时拟和强度较好。
参考文献:
[1] 邓世星, 杨季冬. 荧光法研究牛血清白蛋白与中性红的相互作用[J].分析科学学报, 2007(2): 177-180.
[2] 黄英, 王娟, 郭改英, 等. 光谱法研究硫鸟嘌呤与七元瓜环及牛血清白蛋白的超分子相互作用[J]. 高等学校化学学报, 2013, 34(2): 375-380.
[3] ZHANG Min, DANG Yongqiang, LIU Tianying, et al. Pressure-induced fluorescence enhancement of the bsa-protected gold nanoclustersand the corresponding conformational changes of protein[J]. The Journal of Physical Chemistry C, 2013, 117(1): 639-647.
[4] 刘冷, 李建晴, 郭芬, 等. 紫外分光光度法同时测定柠檬黄和日落黄[J].光谱实验室, 2007(3): 423-427.
[5] 王安萍, 丁勇, 张国文, 等. 荧光光谱法研究磺胺噻唑与牛血清白蛋白的相互作用[J]. 南昌大学学报: 工科版, 2007(3): 225-228; 248.
[6] 曹团武, 杨季冬. 孔雀石绿与牛血清白蛋白的相互作用[J]. 物理化学学报, 2008(4): 715-719.
[7] 马康, 陈晓青, 陈景文. 荧光光谱法研究三种黄酮类化合物与BSA的相互作用[J]. 光谱实验室, 2008(4): 662-668.
[8] 陈韵, 孔祥荣, 沈星灿, 等. 尼古丁与BSA相互作用的光谱研究[J].光谱学与光谱分析, 2005(10): 118-123.
[9] 陈鹏, 王微, 孙红, 等. 荧光光谱法快速测定饮料中的亮蓝[J]. 光谱实验室, 2012, 29(6): 3849-3852.
[10] 李海燕, 乔建芬. 浅谈常用食品添加剂的性能特点及应用[J]. 食品工程, 2011(4): 13-16.
[11] WANG Ziqiang, LI Ying, WANG Jun, et al. Spectroscopic analyses on sonocatalytic damage to bovine serum albumin(BSA) induced by ZnO/ hydroxylapa tite (ZnO/HA) composite under ultrasonic irradiation[J]. Spectrochimica Acta Part A, 2012, 94: 228-234.
[12] 于兵川, 吴洪特, 周培疆, 等. 五氯酚对牛血清白蛋白的荧光猝灭作用[J]. 环境科学, 2006(5): 977-980.
[13] 杨卫卫, 蔡喜平, 孙庆申, 等. 光谱法研究壳聚糖与溶菌酶的相互作用[J]. 黑龙江大学: 自然科学学报, 2013, 30(3): 410-414.
[14] TIAN F, JIANG F, HANG X, et al. Synthesis of a novel hydrazone derivative and biophysical studies of its inte ractions with bovine serum albumin by spectroscopic, electrochemical, and molecular docking methods[J]. The Journal of Physical Chemistry B, 2010, 114: 14842-14853.
[15] 李娜, 魏永巨. 药物分子与血清白蛋白结合反应的荧光法研究进展[J].河北师范大学学报, 2003(2): 176-180.
[16] SOARES S, MATEUS N, FREITAS V. Interaction of different polyphenols with bovine serum albumin (BSA) and human salivary β-amylase (HSA) by fluorescence quenching[J]. Journal of Agricultural and Food Chemistry, 2007, 55: 6726-6735.
[17] 乐薇, 吴小霞. 荧光法研究芦丁-Cu~(2+)/Co~(2+)-BSA的相互作用[J].分子科学学报, 2011(1): 66-70.
[18] ZHANG Yezhong, DAI Jie, ZHANG Xiaoping, et al. Studies of the interaction between Sudan I and bovine serum albumin by spectroscopic methods[J]. Journal of Molecular Structure, 2008, 888(1/3): 152-159.
Interactions of Bovine Serum Albumin with Lemon Yellow and Sunset Yellow Studied by Fluorescence Spectroscopy
LIU Zhi-dong, HAN De-quan, YANG Wei-wei, LI Xue-ru, SHAO Shu-shuang, SUN Qing-shen*
(Key Laboratory of Microbiology of Heilongjiang Province, Engineering Research Center of Agricultural Microbiology Technology, Ministry of Education, College of Life Science, Heilongjiang University, Harbin 150080, China)
Interactions between bovine serum albumin (BSA) and lemon yellow or sunset yellow were studied by UV-visible absorption spectroscopy and fluorescence emission spectroscopy. The dynamic quenching rate constants at 310 K were calculated according to Stern-Volmer equation to be 2.51 × 105and 1.42 × 105L/mol for lemon yellow and sunset yellow, respectively. The static quenching constants at 310 K were calculated according to Lineweaver-Burk double-reciprocal equation to be 5.79 × 105and 5.56 × 105L/mol, respectively. The number of binding sites at 310 K was calculated according to lg((F0-F)/F)=lgK0+nlgρ to be 0.556 95 and 0.640 56, respectively. A good linear relationship was observed between lemon yellow or sunset yellow concentration in the range of 0 – 3 μg/mL and fluorescence quenching intensity.
bovine serum albumin; lemon yellow; sunset yellow; fluorescence quenching
TS201.6
A
1002-6630(2014)09-0128-04
10.7506/spkx1002-6630-201409026
2013-07-03
黑龙江省教育厅面上项目(11551360);国家自然科学基金青年科学基金项目(31000773)
刘志栋(1989—),男,硕士研究生,研究方向为食品加工与安全。E-mail:744063752@qq.com
*通信作者:孙庆申(1977—),男,副教授,博士,研究方向为功能保健食品,食品加工与安全。E-mail:kejiansqs@163.com
