端粒保护蛋白复合体在氧化应激中作用
2014-01-19陈连祥朱小伟邢骏姚明玲叶静陆一鸣
陈连祥 朱小伟 邢骏 姚明玲 叶静 陆一鸣

DOI:10.3760/cma.j.issn.1671-0282.2014.12.029
基金项目:国家自然科学基金(81270433,81171846,81372099)
作者单位:200025 上海,上海交通大学医学院附属瑞金医院中法生命科学和基因组研究中心急诊科
通信作者: 陆一鸣,E-mail:luyiming@rjh.com.cn;
叶静,E-mail:yj11254@gmail.com
端粒特异性保护蛋白复合体(shelterin)是与端粒结合的六蛋白复合体,包括:TRF1, TRF2, TIN2, Rap1, TPP1和 POT1。6种成分以不同的方式参与维持端粒的结构和功能稳定:(1)TRF1和TRF2负性调节端粒长度。(2)TRF2介导t-环结构形成<sup>[1-2]</sup>以及稳定 t-环结构<sup>[3]</sup>,与拓扑异构酶II相互作用维持端粒的拓扑结构<sup>[4]</sup>。(3)POT1、Rap1等维持3 悬臂稳定。(4)Shelterin盖帽作用抑制DNA损伤系统激活<sup>[5]</sup>。(5)shelterin还能募集大量非端粒特异性蛋白成员,包括ERCC1/XPF,Apollo等形成端粒蛋白网络,共同协同参与端粒保护和端粒复制延伸<sup>[6]</sup>。正是由于shelterin的作用,使得端粒得以躲过DNA损伤反应 (DNA Damgae Response, DDR)体系的攻击,并在维护染色体稳定、避免染色体末端受核酸酶降解和基因重排中起重要作用。大量研究表明shelterin除保护端粒作用外,其可参与细胞多种反应过程,本文将重点讲述shelterin在氧化应激进程中作用。
1端粒是氧化应激重要靶点
氧化应激在细胞内普遍存在,主要有活性氧簇(reactive oxygen species,ROS)及活性氮簇(reactive nitrogen species,RNS),参与体内炎症、代谢等重要生命过程,维护正常生命活动。正常机体处于氧化与抗氧化的均衡体系中,当系统失衡时ROS可直接或间接氧化损伤DNA,诱发基因突变,导致多种疾病发生,如重症急性胰腺炎<sup>[7]</sup>,脓毒症<sup>[8]</sup>,肺损伤<sup>[9]</sup>等。有关ROS是如何激活炎症介质,引发全身炎症反应和脏器功能衰竭的机制目前仍是未知。
端粒位于染色体末端的定位特点以及富含G-基因重复序列和3悬突(G tail)的结构特点,使得端粒成为潜在“脆弱位点”,比其他部位更易受到氧化应激损伤。端粒的结构性损伤影响shelterin与端粒的结合稳定性<sup>[10]</sup>和表达,为其参与氧化应激进程提供可能。以上提示,在ROS介导的炎性反应和脏器功能衰竭中,端粒和shelterin很可能是中心靶点。
2端粒保护蛋白复合体在抑制氧化损伤中的作用
2.1TRFs通过招募PARPs参与氧化应激
聚腺苷二磷酸-核糖聚合酶(poly-ADP-ribose polymerases,PARPs)在体内发挥基因组监视和保护作用, TRFs与端粒的结合受到PARPs的调节。其中PARP1,PARP2影响TRF2 <sup>[11]</sup>, PARP5与TRF1相互作用<sup>[12]</sup>。PARP2与TRF2有高度的亲和力,通过共价结合和非共价结合两种方式作用负性调节TRF2与端粒的结合。
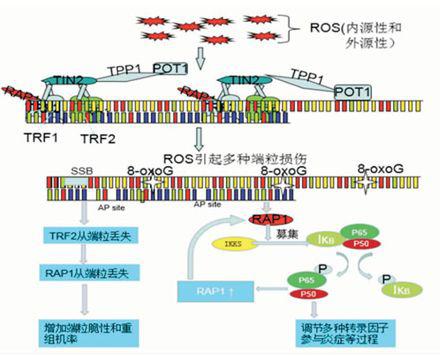
ROS可以激活PARPs,在氧化损伤区域可以观察到PARPs的聚集。氧化应激产生8oxoG,其有效修复需要PARP1的参与,主要通过碱基切除修复(base excision repair, BER)途径<sup>[13]</sup>。PARPs能够募集BER相关蛋白,如XRCC1,在敲除PARP2的MEFs中可明显观察到染色体和染色质的断裂增加以及端粒重复序列丢失增加。发生氧化应激时端粒区域内PARPs的聚集,负性TRFs与端粒结合,引起TRFs丢失,从而引起一系列反应。此途径如图1。
内源性和外源性的ROS可以造成端粒DNA的各种损伤,如单链损伤,8-oxoG等等。端粒DNA的损伤能够抑制TRFs与端粒的结合。另外在端粒损伤时,相关修复蛋白在损伤处聚集,如PARPs。 PARPs能够负性调节TRFs与DNA的结合能力,最终导致TRFs在端粒的丢失。端粒失去保护而引起端粒的缩短和失功能,诱发DNA损伤反应,可以造成细胞的凋亡和细胞周期停滞以及多种疾病如肿瘤发生。
图1TRFs 在端粒氧化损伤中作用
2.2RAP1调控NF-κB参与氧化应激
由于本身缺乏DNA结合能力,RAP1必须通过结合于TRF2而间接定位于端粒<sup>[14]</sup>,从而发挥保护端粒作用,避免发生非同源末端的融合<sup>[15]</sup>。在氧化应激中,由于TRF2的结合减少,可以导致RAP1的丢失,增加端粒的重组和脆性。
最近研究显示,RAP1可以通过与端粒外TTAGGG序列结合发挥调节基因表达的重要作用,此部分RAP1称之为胞浆RAP1<sup>[5]</sup>。RAP1通过NF-κB途径参与调节组织的氧化损伤。NF-κB涉及到体内一系列的基因表达的调控, DNA结合的NF-κB是一个杂化二聚体,分别为50 000(p50)和65 000(p65)的两个多肽亚基,但是仅p65具有激活转录活性<sup>[16]</sup>。NF-κB的活性主要受到抑制亚基IκB的控制<sup>[17]</sup>。IκB阻断NF-κB与DNA的结合,进而限制NF-κB对于损伤的反应速率,这是NF-κB反应的限速步骤。当IκB磷酸化后脱离NF-κB,从而解除其抑制作用。而IκB的磷酸化受到IκB激酶(IκB kinases,IKKs)的调节,包括IKK1和 IKK2<sup>[18]</sup>。证据表明RAP1作为IKKs的适配器,RAP1与IKKs的结合是激活NF-κB以来基因表达的关键<sup>[19]</sup>。 在哺乳动物,RAP1能够增强募集IKKs复合体到p65,进而使p65在ser536磷酸化,从而激活NF-κB途径。而激活的NF-κB又可以增加RAP1的表达。此途径如图2。
氧化应激引起端粒损伤如8oxoG。一方面,由于TRF2的丢失造成端粒RAP1的丢失,增加端粒的脆性和重组机率。另一方面,RAP1参与到NF-κB途径。氧化损伤时,RAP1可以募集IKKs到IκB,从而使IκB磷酸化进而解除对于NF-κB抑制,同时使p65磷酸化而具背激活转录活性。活化的NF-κB又可以增加RAP1表达,进一步增强NF-κB途径的活化。
图2RAP1在氧化应激中作用
2.3TIN2影响线粒体ROS产生
线粒体生成ATP同时产生ROS,被认为是细胞产生ROS的主要途径,造成线粒体DNA更易于受到氧化应激的损伤,诱发许多疾病的发生,如心血管疾病<sup>[20]</sup>;以及衰老<sup>[21]</sup>。TIN2与TRF1, TRF2, 和 TPP1相互作用,使得单链和双链结合的shelterin成分形成一个整体<sup>[22]</sup>。研究显示TIN2可以定位于端粒外结构,特别是线粒体<sup>[23]</sup>。TIN2通过其氮端信号序列以及TPP1在线粒体定位,影响线粒体的形态和活性。TIN2敲除时,可以导致细胞内ROS的产生减少;当恢复TIN2水平时,ROS的产生得以恢复。
3端粒及shelterin-药物作用新的靶点
临床研究显示,氧化损伤会通过端粒加重一些慢性疾病的发生。端粒长度比平均值短的人,其患缺血性心肌病的几率是正常人的3倍<sup>[24]</sup>,短的白细胞端粒长度与胰岛素依赖型糖尿病(非2型)<sup>[25]</sup>以及高血压<sup>[26]</sup>发生息息相关。在急危重症中微循环的障碍导致氧化应激的产生,进而引发多起功能衰竭<sup>[27]</sup>。通过抑制氧化应激可以抑制致病因子引起的损伤,如利用依达拉奉抑制百草枯引起的氧化应激,从而减轻其造成的肺损伤<sup>[28]</sup>。因此端粒以及shelterin成分表达异常和端粒结合异常,在治疗氧化应激相关疾病时可以作为重要的作用靶点。
对于端粒作为药物靶点已做了一些前期研究如端粒酶和G四联体抑制剂,通过抑制端粒酶来损耗端粒导致细胞死亡,以治疗端粒酶阳性肿瘤<sup>[29]</sup>。此外端粒位置效应(telomere position effect,TPE)已可以作为药物作用重要靶点,如Acacetin和 Chrysin能够缓解人体细胞端粒位置效应<sup>[30]</sup>。可见端粒及shelterin作为药物作用靶点是可以实现的。
参考文献
[1]Griffith JD,Comeau L, Rosenfield S, et al. Mammalian telomeres end in a large duplex loop[J]. Cell, 1999, 97(4): 503-514.
[2]Amiard S, Doudeau M, Pinte S, et al. A topological mechanism for TRF2-enhanced strand invasion[J]. Nat Struct & Mol Biol, 2007, 14(2): 147-154.
[3]Poulet A, Buisson R, Faivre-Moskalenko C, et al. TRF2 promotes, remodels and protects telomeric Holliday junctions[J]. EMBO, 2009, 28(6): 641-651.
[4]Ye J, Lenain C, Bauwens S, et al. TRF2 and Apollo cooperate with topoisomerase 2α to protect human telomeres from replicative damage[J]. Cell, 2010, 142(2): 230-242.
[5]Martinez P, Thanasoula M, Carlos AR, et al. Mammalian Rap1 controls telomere function and gene expression through binding to telomeric and extratelomeric sites[J]. Nature cell biology, 2010, 12(8): 768-780.
[6]Gilson E, Géli V. How telomeres are replicated[J]. Na Rev Mol Cel Biol, 2007, 8(10): 825-838.
[7]田锐, 许飞, 王瑞兰, 等., 氧化应激及凋亡与重症急性胰腺炎肠屏障功能障碍[J]. 中华急诊医学杂志, 2012, 21(010): 1088-1092.
[8]徐志宏, 施小燕, 氧化应激参与脓毒症过程的研究进展及其对治疗的启发[J]. 中华急诊医学杂志, 2008. 17(2): 221-223.
[9]Meng XX, Wang RL, Gao S, et al. Effect of ulinastatin on paraquat-induced-oxidative stress in human type II alveolar epithelial cells[J]. World J Emerg Med, 2013, 4(2): 133-137.
[10]Opresko PL, Fan J, Danzy S, et al. Oxidative damage in telomeric DNA disrupts recognition by TRF1 and TRF2[J]. Nucleic acids research, 2005, 33(4): 1230-1239.
[11]Dantzer F, Giraud-Panis MJ, Jaco I , et al. Functional interaction between poly(ADP-ribose) polymerase 2 (PARP-2) and TRF2: PARP activity negatively regulates TRF2[J]. Mol & Cell Biol, 2004, 24(4): 1595-1607.
[12]Cook BD, Dynek JN, Chang W, et al. Role for the related poly (ADP-Ribose) polymerases tankyrase 1 and 2 at human telomeres[J]. Mol & Cell Biol, 2002, 22(1): 332-342.
[13]Le Page F, Schreiber V, Dherin C, et al. Poly(ADP-ribose) polymerase-1 (PARP-1) is required in murine cell lines for base excision repair of oxidative DNA damage in the absence of DNA polymerase beta[J]. J Biol Chem, 2003, 278(20): 18471-18477.
[14]Li B, de Lange T. Rap1 affects the length and heterogeneity of human telomeres[J]. Mol Biol Cell, 2003, 14(12): 5060-5068.
[15]Bae NS, Baumann P. A RAP1/TRF2 complex inhibits nonhomologous end-joining at human telomeric DNA ends[J]. Molecular cell, 2007, 26(3): 323-334.
[16]Schreck R, Albermann K, Baeuerle PA. Nuclear factor κB: an oxidative stress-responsive transcription factor of eukaryotic cells (a review)[J]. Free Radical Research, 1992, 17(4): 221-237.
[17]Hehner SP, Heinrich M, Bork PM, et al. Sesquiterpene lactones specifically inhibit activation of NF-kappa B by preventing the degradation of I kappa B-alpha and I kappa B-beta[J]. J Biol Chem, 1998, 273(3): 1288-1297.
[18]Chariot A. The NF-κB-independent functions of IKK subunits in immunity and cancer[J]. Trends in cell biology, 2009, 19(8): 404-413.
[19]Teo H, Ghosh S, Luesch H, et al. Telomere-independent Rap1 is an IKK adaptor and regulates NF-kappaB-dependent gene expression[J]. Nat Cell Biol, 2010, 12(8): 758-67.
[20]Tritschler HJ, MedoriR. Mitochondrial DNA alterations as a source of human disorders[J]. Neurology, 1993. 43(2): 280.
[21]Shigenaga MK, Hagen TM, .Ames BN. Oxidative damage and mitochondrial decay in aging[J]. Proc Nat Acad Sci, 1994, 91(23): 10771-10778.
[22]Palm W, de Lange T. How shelterin protects mammalian telomeres[J]. Annu Rev Genet, 2008, 42(3): 301-334.
[23]Chen LY, Zhang Y, Zhang Q, et al. Mitochondrial localization of telomeric protein TIN2 links telomere regulation to metabolic control[J]. Mol Cell, 2012, 47(6): 839-50.
[24]Brouilette S, Singh RK, Thompson JR, et al. White cell telomere length and risk of premature myocardial infarction[J]. Arterioscler Thromb Vasc Biol, 2003, 23(5): 842-846.
[25]Jeanclos E, Krolewski A, Skurnick J, et al. Shortened telomere length in white blood cells of patients with IDDM[J]. Diabetes, 1998, 47(3): 482-486.
[26]Benetos A, Okuda K, Lajemi M, et al. Telomere length as an indicator of biological aging the gender effect and relation with pulse pressure and pulse wave velocity[J]. Hypertension, 2001, 37(2): 381-385.
[27]庞天舒, 丁国平, 阙日升, 等, 急危重症氧化应激及微循环障碍的研究进展[J]. 中华急诊医学杂志, 2013. 22(5):553-555.
[28]Cheng ZQ, Han JY, Sun P, et al. Edaravone attenuates paraquat-induced lung injury by inhibiting oxidative stress in human type II alveolar epithelial cells[J]. World J Emerg Med, 2012, 3(1): 55-9.
[29]Neidle S, Parkinson G. Telomere maintenance as a target for anticancer drug discovery[J]. Nat Rev Drug Dis, 2002. 1(5): 383-393.
[30]Boussouar A, Barette C, Nadon R, et al. Acacetin and Chrysin, Two Polyphenolic Compounds, Alleviate Telomeric Position Effect in Human Cells[J]. Mol Ther Nucl Acids, 2013, 2(8): e116.
(收稿日期:2014-06-07)
(本文编辑:何小军)
p1415-1417
