红佳酿酵母β-葡萄糖苷酶的分离纯化及酶学性质
2014-01-18盛文军杨学山韩舜愈
祝 霞,盛文军,杨学山,王 婧,李 敏,张 波,翦 祎,韩舜愈,*
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.甘肃农业大学生命科学技术学院,甘肃 兰州 730070)
红佳酿酵母β-葡萄糖苷酶的分离纯化及酶学性质
祝 霞1,盛文军1,杨学山2,王 婧1,李 敏1,张 波1,翦 祎1,韩舜愈1,*
(1.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070;2.甘肃农业大学生命科学技术学院,甘肃 兰州 730070)
以红佳酿酿酒酵母为出发菌株,通过离子交换法分离纯化β-葡萄糖苷酶,测定酶活力和蛋白质含量,并研究温度、pH值稳定性和金属离子、葡萄糖、酒精度对酶活力的影响。结果表明:粗酶液经过离子交换层析后,纯化倍数为19.41,得率为38.67%;经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis,SDS-PAGE)电泳检测为1 条谱带,达到电泳纯,分子质量约为45 kD;β-葡萄糖苷酶热稳定性较差,在20~40 ℃较稳定,在pH 5.0~10.0较稳定;Al3+、Cu2+对酶活力有抑制作用,K+、Mg2+、Ca2+、Zn2+、Na+对酶活力的影响不明显;葡萄糖和酒精对酶活力无明显抑制作用。
红佳酿酵母;β-葡萄糖苷酶;分离纯化;酶学性质
葡萄果实中存在大量不具有挥发性、无味的糖苷键合态风味前体物质,该成分可通过酿造过程释放出来,呈现葡萄品种独特的风味,是影响葡萄酒质量的关键因素之一[1-2]。β-葡萄糖苷酶(β-glucosidase,BGL,EC3.2.1.21)可以水解葡萄糖苷键释放出相应的糖苷配基[3-4],将其转化为有香味的游离态香气物质从而改善葡萄酒香气[5]。
目前,国内外提高葡萄酒芳香潜力的研究,主要通过外加风味酶实现,不但增加了生产成本,而且也存在一些问题[6-7]。例如葡萄汁和葡萄酒具有高含糖量、高酒精含量及低pH值等特殊性质,应用植物来源的β-葡萄糖苷酶活性很低,甚至完全失活,无法使游离态香味物质充分释放[8];从真菌、霉菌中分离的商业化β-葡萄糖苷酶是一些非特异性葡聚糖酶的混合物,有报道指其只能水解3%的前体物,且由于葡聚糖酶的非特异性,可能会引发分解产生的香气不自然等不利于产品品质的反应[9-11]。Chen Mei等[12]的研究结果表明,提高葡萄酒中游离态香味物质最好的方法是利用酿酒酵母(Saccharomyces cerevisiae)产生的β-葡萄糖苷酶,此酶活力适当,是酿酒体系的一部分,能够适应酿酒条件。实际生产中,酿酒酵母在发酵过程中只表现出非常弱β-葡萄糖苷酶活性,发酵完成后大多数的键合态风味前体物仍然未被释放[13-14]。因此系统研究酿酒酵母所产β-葡萄糖苷酶性质,使其表现出良好的催化活性、有效地释放香气物质,是定向修饰葡萄酒风味品质亟待解决的关键问题之一。
本实验以甘肃河西地区莫高、紫轩、祁连等葡萄酒厂酿造干红葡萄酒使用的红佳酿活性干酵母为出发菌株,分离纯化β-葡萄糖苷酶,深入分析其酶学性质,以期通过调控发酵条件,提升发酵体系中β-糖苷酶活性,使葡萄酒中键合态香气物质释放达到最佳状态。
1 材料与方法
1.1 菌种与试剂
红佳酿酵母 意大利Enartis公司。
对-硝基苯酚-β-D-葡萄糖苷(p-nitrophenyl-β-D-glucopyranoside,p-NPG) 美国Sigma公司;DEAE-52北京拜尔迪生物科技公司;其他试剂均为国产分析纯。
1.2 仪器与设备
BS-16A自动部分收集器、HL-2B数显恒流泵、TH-300A梯度混合器 上海青浦沪西仪器厂有限公司;SHB-III循环水式多用真空泵 郑州长城科贸有限公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;SCIENTZ-ⅡD超声波细胞粉碎机 宁波新芝生物科技股份有限公司;SL-1001电子天平 上海民桥精密科学仪器有限公司;TDZ5-WS离心机 湘仪离心机仪器有限公司;HH-6数显恒温水浴锅 国华电器有限公司;PHS-3C精密pH计 上海雷磁有限公司。
1.3 培养基
产酶培养基制备[15]:1 g/100 mL酵母膏、2 g/100 mL蛋白胨,取250 mL的三角瓶按20%的装样量分装,121 ℃灭菌20 min。取出灭菌后的三角瓶,冷却到60~70 ℃后每个三角瓶加入0.1% p-NPG底物。
1.4 方法
1.4.1 红佳酿酵母β-葡萄糖苷酶分离纯化技术路线
菌株活化→扩大培养→β-葡萄糖苷酶分离提取→丙酮沉淀→DEAE-SephadexA-52柱层析→测定酶活力→合并活性组分→浓缩→纯化酶
1.4.2 操作要点
1.4.2.1 酵母菌株活化
取适量红佳酿活性干酵母,分别置于少许待接种的液体培养基中30 ℃水浴保温30 min。
1.4.2.2 扩大培养
将活化后的酵母接种至产酶培养基中,30 ℃、150 r/min培养48 h。
1.4.2.3 酵母产β-葡萄糖苷酶提取[16]
将发酵液4 000 r/min离心20 min,弃掉上清液,蒸馏水洗涤,4 000 r/min离心10 min,弃去上清;用pH 6.2的缓冲液清洗沉淀后4 000 r/min离心10 min,反复两次。洗涤后弃去上清液,加入10 mL左右缓冲液,超声波功率400 W、破碎16 min,4 000 r/min离心20 min,收集上清液。
1.4.2.4 丙酮沉淀
将提取的上清液加1.25 倍体积冷丙酮,搅拌均匀,静置20 min,离心收集沉淀物,加适量pH 6.2的NaH2PO4-Na2HPO4缓冲液,溶解沉淀,将溶解液过0.22 μm滤膜,收集滤液即为粗酶液。
1.4.2.5 DEAE-SephadexA-52柱层析
将过膜后的溶解液2 mL上样至NaH2PO4-Na2HPO4(pH 6.2)平衡好的DEAE-SephadexA-52层析柱中,用0~1 mol/L NaCl溶液线性梯度洗脱,流速1 mL/min,每管3 mL。
1.4.2.6 β-葡萄糖苷酶纯度的测定
采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecylsulfate polyacrylamide gel electrophoresis,SDS-PAGE)法[17]。5%浓缩胶,10%分离胶,浓缩电压80 V,分离电压120 V,当溴酚蓝指示剂到达距电泳槽底部0.5 cm时结束电泳。将凝胶从玻璃板上轻轻剥下,考马斯亮蓝染色30 min,脱色至蛋白质条带清晰可见。
1.4.2.7 β-葡萄糖苷酶活力测定[18]
样品试管中取0.1 mL适当稀释的酶液,加入0.9 mL pH 6.2的0.2 mol/L Na2HPO4-0.1 mol/L柠檬酸缓冲溶液,于45 ℃水浴预热10 min;加入已预热10 min的1 mL 5 mmol/L p-NPG溶液,计时;13 min后立即加入2 mL 1 mol/L Na2CO3溶液终止反应;室温放置5 min,测定吸光度(A400nm)。
空白对照试管中加入0.1 mL沸水加热失活的酶液,按同样方法处理。
酶活力单位定义:1 个酶活力单位(U)定义为每分钟水解p-NPG产生1 μmol对硝基苯酚所需的酶量。
1.4.3 β-葡萄糖苷酶酶学性质研究
1.4.3.1 β-葡萄糖苷酶热稳定性
将纯化后的β-葡萄糖苷酶分别置于20、30、40、50、60、70、80 ℃条件下保温20、40、60 min,冷却后测定酶活力。计算相对酶活力(以4 ℃保存的原酶液酶活力为100%),评价β-葡萄糖苷酶的热稳定性。
1.4.3.2 β-葡萄糖苷酶pH值稳定性
分别在0.8 mL pH值分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0的缓冲液中,加入0.2 mL酶液,4 ℃保温24 h,分别测定剩余酶活力,计算相对酶活力(以加入0.8 mL双蒸水中酶活力为100%)。
1.4.3.3 金属离子对β-葡萄糖苷酶活力的影响
取纯化后的酶液0.1 mL,分别加入0.9 mL 10 mmol/L葡萄酒中常见的金属离子K+、Mg2+、Ca2+、Na+、Al2+、Zn2+和Cu2+,25 ℃保温4 h,测定酶活力,计算相对酶活力(以未加入金属离子的酶液酶活力为100%)。
1.4.3.4 酒精度对β-葡萄糖苷酶活力的影响
取纯化后酶液0.1 mL,加入0.9 mL含5%、10%、15%、20%酒精的缓冲液中,25 ℃保温4 h,测定酶活力,计算相对酶活力(以未加入酒精的酶液酶活力为100%)。
1.4.3.5 葡萄糖对β-葡萄糖苷酶活力的影响
取纯化后酶液0.1 mL,加入0.9 mL含5、10、15、20 g/100 mL葡萄糖的缓冲液中,25 ℃保温4 h测定酶活力,计算相对酶活力(以未加葡萄糖的酶液酶活力为100%)。
2 结果与分析
2.1 β-葡萄糖苷酶的分离纯化
2.1.1 DEAE-SephadexA-52层析结果
经冷丙酮沉淀后的酶液经DEAE-SephadexA-52阴离子交换柱层析洗脱,洗脱曲线如图1所示。洗脱过程中共收集到3 个蛋白峰,对每个蛋白峰以p-NPG为底物检测酶活力,结果发现峰值最高的第2个为活性峰,说明目的酶与杂蛋白得到较好的分离。

图1 DEAE-SephadexA-52离子层析分离β-葡萄糖苷酶Fig.1 Elution profile of β-glucosidase on DEAE-SephadexA-52 column
2.1.2 β-葡萄糖苷酶纯化结果

表 11 β-葡萄糖苷酶纯化结果Table 1 Summery of the purification procedures of β-glucosiiddaassee
酶液经过冷丙酮沉淀及阴离子交换层析纯化后,对每一步分离得到的酶液进行蛋白质含量和酶活力测定,并计算β-葡萄糖苷酶比活力、纯化倍数和得率,结果见表1。在提取的各个步骤中,β-葡萄糖苷酶的比活力逐渐上升,由323.286 U/mg上升至6 276.470 U/mg,酶被纯化了19.41 倍,说明β-葡萄糖苷酶经过冷丙酮沉淀及DEAESephadexA-52柱层析,除去了大量的杂蛋白。酶的得率达38.67%,由此可见,随着提纯步骤的进行,β-葡萄糖苷酶纯度逐渐提高,比活力逐渐上升。
2.1.3 β-葡萄糖苷酶纯度鉴定
为验证纯化后的样品是否已经达到电泳纯水平,取分离纯化后的β-葡萄糖苷酶,合并浓缩后进行SDS-PAGE电泳,如图2所示。图中浓缩液只显示1 条蛋白带,说明纯化后的β-葡萄糖苷酶达到电泳纯。对照Marker得酵母菌中β-葡萄糖苷酶的分子质量约为45 kD。
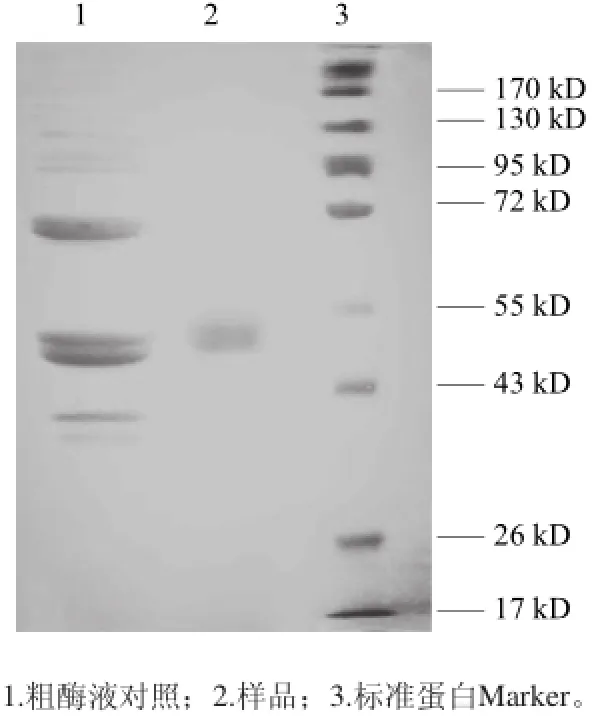
图2 2 β-葡萄糖苷酶纯化SDS-PAGE图谱AGEFig.2 SDS-PAGE of the purified β-glucosidase
2.2 β-葡萄糖苷酶酶学性质研究结果
2.2.1 温度稳定性

图3 3 β-葡萄糖苷酶的热稳定性Fig.3 Thermalstability of β-glucosisase
以p-NPG为底物测定酶活力,分析酶的温度稳定性,结果如图3所示。β-葡萄糖苷酶在温度50 ℃以下(20、30、40 ℃)保温20 min,酶活力下降不明显,保温60 min后酶活力均保留在60%以上;温度大于等于50 ℃(50、60、70、80 ℃)条件下20 min内酶活力便急剧下降,均在20%以下。由此可知,β-葡萄糖苷酶在20~40 ℃之间具有较好的热稳定性。
2.2.2 pH值稳定性
如图4所示,β-葡萄糖苷酶在pH 5.0~10.0时酶活力相对稳定,均在60%以上。在pH值较低时酶活力较低,在pH 6.0时酶活力最大,当pH值大于10.0后,酶活力急剧下降,直至基本不具有活性。

图 44 β-葡萄糖苷酶的pH值稳定性Fig.4 pH Stability of β-glucosidase
2.2.3 金属离子的影响

表2 不同金属离子(10 mmol/L)对β-葡萄糖苷酶活力的影响Table 2 Effects of various metal ions on the activity of β-glucosiiddaassee
酶是一种蛋白质,其催化效果受诸多因素的影响,其中不同金属离子对酶活力的影响不同。它们可能是酶的组成部分,也有可能是酶的激活剂或抑制剂。因而酶解环境中含有或在酶制剂贮存过程中添加不同种类的金属离子对大多数酶的降解效率及其稳定性影响很大。为了解金属离子对酵母β-葡萄糖苷酶活性的影响,以p-NPG
为底物研究了不同金属离子(10 mmol/L)对β-葡萄糖苷酶活力的影响,以不含待检离子的β-葡萄糖苷酶的活性为100%,结果如表2所示。结果表明:10 mmol/L Al3+、Cu2+对β-葡萄糖苷酶的抑制作用强烈;而K+、Mg2+、Ca2+、Zn2+、Na+的影响不明显。
2.2.4 酒精度的影响
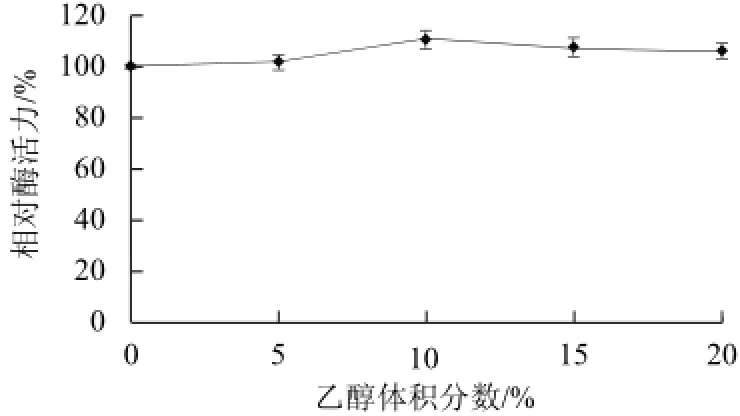
图5 乙醇对β-葡萄糖苷酶酶活性的影响Fig.5 Effect of temperature on the activity of β-glucosidase
如图5所示,总体而言该酶对酒精具有较强的耐受性。在酒精低于20%时对β-葡萄糖苷酶酶活力有一定的促进作用,甚至使酶活力增加了10%左右,这一方面可能是低体积分数的酒精可以刺激酵母细胞产酶,另一方面由于酒精刺激使β-葡萄糖苷酶活性作用位点发生了改变。
2.2.5 葡萄糖对β-葡萄糖苷酶活力的影响
由图6可知,由于β-葡萄糖苷酶作用于底物产生葡萄糖,β-葡萄糖苷酶的酶活力随葡萄糖质量浓度的增加而下降,高质量浓度葡萄糖对酶活力具有一定的抑制作用,葡萄糖20 g/100 mL时酶活力为88.39%,较未添加葡萄糖时下降11.61%。

图6 葡萄糖质量浓度对β-葡萄糖苷酶活力的影响Fig.6 Effect of glucose concentration on the activity of β-glucosidase
3 结 论
以红佳酿酿酒酵母为原料,经分离纯化得到β-葡萄糖苷酶纯品,并研究了温度、pH值稳定性和金属离子、葡萄糖、酒精度对酶活力的影响。结果表明:粗酶液经过离子交换层析后,纯化倍数为19.41 倍,得率为38.67%,分子质量约为45 kD;β-葡萄糖苷酶热稳定性较差,在20~40 ℃较稳定,在pH 5.0~10.0较稳定;10 mmol/L Al3+、Cu2+对β-葡萄糖苷酶有抑制作用,K+、Mg2+、Ca2+、Zn2+、Na+对β-葡萄糖苷酶的影响不明显;葡萄糖和酒精度对β-葡萄糖苷酶酶活力没有明显的抑制作用。
[1] 李远华. β-葡萄糖苷酶的研究进展[J]. 安徽农业大学学报, 2012, 29(4): 421-424.
[2] 彭喜春, 彭志英. β-葡萄糖苷酶的研究现状及应用前景[J]. 江苏食品与发酵, 2011, 17(8): 22-25.
[3] BAFFI M A, TOBAL T, HENRIQUE J, et al. A novel β-glucosidase from Sporidiobolus pararoseus: characterization and application in winemaking[J]. Journal of Food Science, 2011, 76(1): 997-1002.
[4] ARÉVALOVILLENA M, IRANZO J F, GUNDLLAPALLI S B, et al. Characterization of anexocellular β-glucosidase from Debaromyces pseudopolymorphus[J]. Enzyme and Microbial Technology, 2006, 39(12): 229-234.
[5] 郭慧女. β-葡萄糖苷酶生产菌的选育及其对葡萄酒中结合态香气的影响[D]. 无锡: 江南大学, 2010.
[6] CABRITA M J, FREITAS A M C, LAUREANO O, et al. Glycosidic aroma compounds of some Portuguese grape cultivars[J]. Science of Food and Agriculture, 2009, 86(6): 922-931.
[7] 李庆华. 高产β-葡萄糖苷酶酿酒酵母的筛选及其发酵特性的研究[D]. 杨凌: 西北农林科技大学, 2009.
[8] VILLENA M A, IRANZO J F, OTERO R, et al. Optimization of a rapid method for studying the cellular location of β-glucosidase activity in wine yeasts[J]. Journal of Applied Microbiology, 2005, 99(6): 558-564.
[9] 苏畅, 肖冬光, 许葵. 几种进口葡萄酒活性干酵母发酵性能比较[J].酿酒科技, 2004, 21(1): 30-32.
[10] 孟宪文, 李长彪, 刘长江, 等. 乳酸菌β-葡萄糖苷酶的分离纯化及特性研究[J]. 食品科学, 2006, 27(1): 116-119.
[11] 陈今朝, 王剑锋, 王慧超, 等. 热稳定酸性β-葡萄糖苷酶的分离纯化及其酶学性质[J]. 食品科学, 2012, 33(11): 205-209.
[12] CHEN Mei, QIN Yuqi, LIU Ziyong, et al. Isolation and characterizationof a β-glucosidase from Penicillium decumbens and improving hydrolysis of corncob residue by using it as cellulase supplementation[J]. Enzyme and Microbial Technology, 2010, 46(6): 444-449.
[13] 张玲. β-葡萄糖苷酶的液态发酵生产[D]. 无锡: 江南大学, 2007.
[14] 王剑锋, 陈今朝, 梁华正, 等. 黑曲霉水解京尼平苷β-葡萄糖苷酶的分离纯化及其酶学性质[J]. 菌物学报, 2010, 29(5): 683-690.
[15] NG I S, LI Chenwei, CHAN S P, et al. High-level production of a thermoacidophilic β-glucosidase from Penicillium citrinum YS40-5 by solid-state fermentation with rice bran[J]. Bioresource Technology, 2010, 101(4): 1310-1317.
[16] JEYA M, JOO A R, LEE K M, et al. Characterization of β-glucosidasefrom a strain of Penicillium purpurogenum KJS506[J]. Applied Microbiology and Biotechnology, 2010, 86(5): 1473-1484.
[17] 郭尧军. 蛋白质电泳实验技术[M]. 北京: 科学出版社, 2001.
[18] GAO Juan, ZHAO Xuesong, LIU Haibo, et al. A highly selective ginsenoside Rb1-hydrolyzing β-D-glucosidase from Cladosporium fulvum[J]. Process Biochemistry, 2010, 45(6): 897-903.
Purification and Enzymatic Characterization of β-Glucosidasein from Vintage Red Yeast
ZHU Xia1, SHENG Wen-jun1, YANG Xue-shan2, WANG Jing1, LI Min1, ZHANG Bo1, JIAN Yi1, HAN Shun-yu1,*
(1. College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070, China; 2. College of Life Science and Technology, Gansu Agricultural University, Lanzhou 730070, China)
An intracellular β-glucosidase from Vintage Red Yeast was purifi ed by ion exchange column chromatography. The effects of temperature, pH, metal ions, glucose and alcohol on the stability of the purifi ed β-glucosidase were studied. The results showed that the enzyme was purifi ed to 19.41 folds with a yield of 38.67%. The purity of β-glucosidase was determined by sodium dodecyl sulphate–polyacrylamide gel electrophoresis (SDS-PAGE). One band was obtained with a molecular mass of about 45 kD. Characterization of the purifi ed β-glucosidase indicated good thermostability in the range from 20 to 40℃ and good pH stability in the range from 5.0 to 10.0. The enzyme activity was strongly inhibited by Al3+, and Cu2+, whereas K+, Mg2+, Ca2+, Zn2+and Na+had no effect on the β-glucosidase activity. Glucose and alcohol did not have signifi cant inhibitory effect on the β-glucosidase activity.
vintage red yeast; β-glucosidase; purifi cation; enzymatic characterization
Q939.97
A
1002-6630(2014)13-0147-04
10.7506/spkx1002-6630-201413028
2014-01-15
国家自然科学基金地区科学基金项目(31160310);甘肃省青年科学基金项目(1208RJYA082)
祝霞(1977—),女,讲师,硕士,研究方向为农产品加工及风味化学。E-mail:zhux@gsau.edu.cn
*通信作者:韩舜愈(1963—),男,教授,博士,研究方向为农产品加工及风味化学。E-mail:lzhansy@126.com
