电子鼻结合GC-MS分析草鱼脱腥前后风味变化
2014-01-18崔方超李婷婷励建荣李洪军李敏镇
崔方超,李婷婷,杨 兵,刘 滢,励建荣,*,李洪军,李敏镇
(1.渤海大学化学化工与食品安全学院,辽宁省食品安全重点实验室,辽宁 锦州 121013;2.大连民族学院生命科学学院,辽宁 大连 116600;3.西南大学食品科学学院,重庆 400715;4.鞍山嘉鲜农业发展有限公司,辽宁 鞍山 114100)
电子鼻结合GC-MS分析草鱼脱腥前后风味变化
崔方超1,李婷婷2,杨 兵1,刘 滢1,励建荣1,*,李洪军3,李敏镇4
(1.渤海大学化学化工与食品安全学院,辽宁省食品安全重点实验室,辽宁 锦州 121013;2.大连民族学院生命科学学院,辽宁 大连 116600;3.西南大学食品科学学院,重庆 400715;4.鞍山嘉鲜农业发展有限公司,辽宁 鞍山 114100)
采用柠檬酸、碳酸氢钠、酵母3 种脱腥剂对草鱼鱼肉进行脱腥处理,通过电子鼻和顶空固相微萃取-气相色谱-质谱联用技术对未经处理的鱼肉与不同脱腥剂处理的鱼肉的挥发性成分进行分析和鉴定。结果表明,电子鼻能够较好区分未经脱腥处理及不同脱腥剂处理的鱼肉样品的风味。主成分分析显示各个样品间差异明显,电子鼻区分度良好。采用气相色谱-质谱法在脱腥前、柠檬酸处理、碳酸氢钠处理和酵母处理的鱼肉样品中分别检测出35、20、21 种和29 种挥发性物质。经3 种脱腥剂处理的鱼肉样品的挥发性成分均呈现减少趋势,其中柠檬酸处理鱼肉中挥发性成分的数量和峰面积减少最为显著,其次为碳酸氢钠及酵母。这一结果与电子鼻分析结果相一致。
电子鼻;气相色谱-质谱法;顶空固相微萃取;草鱼;脱腥
我国淡水资源丰富,淡水鱼产量居世界首位。但长期以来,我国的淡水鱼加工技术滞后于其他产业的发展,主要原因有加工技术落后,深加工比例低等;此外淡水鱼特殊的土腥味也是制约其发展的一个重要原因[1]。青、草、鲢、鳙“四大家鱼”在我国水产养殖业中占有非常重要的地位。草鱼鱼肉中有丰富的蛋白质,含水量高,自身带有较多的微生物和酶,容易腐败变质,而且鱼肉的腥味较重[2]。腥味物质的形成受很多因素的影响,主要是由于生存水体中含有大量的鱼腥藻、颤藻等蓝绿藻或放射菌,这些藻菌等微生物生长产生的各种次生代谢产物通过鳃、皮肤和肠上皮细胞渗透进入鱼体,在鱼体内蓄积导致其产生特有的腥味和臭味[3]。此外鱼体自身内源酶的降解及脂肪酸的氧化裂解产生的一些短链醛、酮类物质也会导致鱼体产生腥味[4]。水产品中主要用酸碱盐法、掩蔽法、吸附法、微胶囊法、微生物发酵法、酶法脱腥、复合脱腥等脱腥方法。顶空固相微萃取-气相色谱-质谱(headspace-solid phase micro-extraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)联用技术[5-7]和电子鼻[8]是目前研究食品中挥发性成分的主要方法。施文正等[1]用固相微萃取-气相色谱-质谱联用技术研究不同漂洗过程中草鱼鱼糜挥发性成分的变化,发现草鱼鱼糜中主要的挥发性成分以醛酮类和醇类为主,经过1 次漂洗和2 次漂洗后鱼糜的主要挥发性成分有显著改变,而2 次和3 次之间没有显著变化。付湘晋等[9]用电子鼻检测白鲢鱼的腥味,发现电子鼻检测结果与感官评价结果高度一致,电子鼻可以用来快速检测白鲢鱼的腥味。本实验采用柠檬酸、碳酸氢钠和酵母对草鱼鱼肉进行脱腥,并结合电子鼻和GC-MS法检测经不同脱腥剂处理前后草鱼的挥发性风味物质变化情况,旨在为草鱼深加工及品质管理等方面提供理论参考。
1 材料与方法
1.1 材料与试剂
新鲜活草鱼(体质量1.5~2 kg) 市购;柠檬酸、碳酸氢钠、酵母(均为食品级) 天津市致远化学试剂有限公司。
1.2 仪器与设备
PEN3便携式电子鼻系统 德国Airsense公司;固相微萃取装置、50/30 μm DVB/CAR/PDMS萃取头、20 mL顶空钳口样品瓶 美国Supelco公司;7890N/5975GCMS联用仪 美国Agilent公司;DF-101S集热式恒温加热磁力搅拌器 郑州长城科工贸有限公司。
1.3 方法
1.3.1 样品准备
1.3.1.1 草鱼肉块的采取
鲜活草鱼→碎冰猝死→三去(去头、皮、内脏)→取背部鱼肉→去掉红肉→切成2 cm×2 cm的方块
1.3.1.2 脱腥
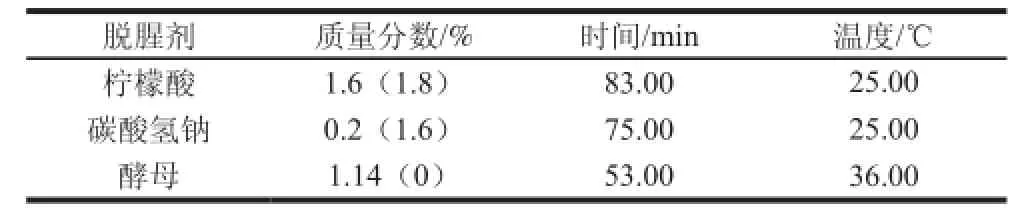
表1 3种脱腥剂的最佳条件Table1 Optimum conditions for three deodorization agents
采用响应面方法优化确定3 种脱腥剂的最佳条件(表1)。脱腥方式以料液比1∶3进行脱腥。
1.3.2 检测样品的准备
电子鼻样品:准确称取脱腥前后的各组绞碎的鱼肉2 份,每份2.0 g于25 mL的烧杯中,迅速用保鲜膜封口(5 层)后置于4 ℃冰箱中静置30 min,用于电子鼻检测。每个样品重复测定2 次。
GC-MS样品:称取3.0 g经绞碎后的脱腥前后的鱼肉迅速放入20 mL顶空瓶中,迅速加盖,用于GC-MS检测,每组样品平行测定2 次。
1.3.3 检测分析条件
HS-SPME:取1.3.2节GC-MS样品,加入6 mL饱和氯化钠溶液及磁转子,用聚四氟乙烯隔垫密封,于45 ℃磁力搅拌器中加热平衡15 min。用已活化好的DVB/CAR/ PDMS 50/30 μm萃取头(270 ℃活化60 min)顶空吸附40 min后,将萃取头插入GC进样口,解吸5 min。每个样品重复实验2 次。
电子鼻检测:电子鼻测定时间100 s;顶空温度25 ℃;内部流量300 mL/min;进样流量300 mL/min。每个样品重复测定2 次。电子鼻传感器性能描述见表2。
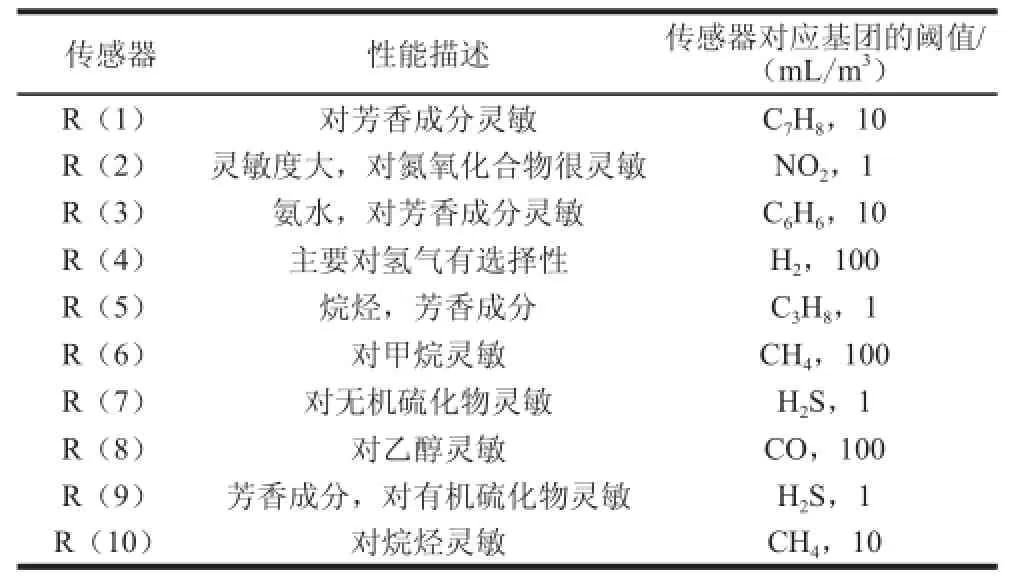
表2 电子鼻传感器性能描述Table2 Sensor properties of PEN3 electronic nose
色谱分析:HP-5MS毛细管柱(30 m×0.25 mm,0.25 μm);进样口温度250 ℃;不分流模式进样;载气为He;流速1.0 mL/min;程序升温:柱初温40 ℃,保持2 min,以4 ℃/min 升至160 ℃,保持1 min再以10 ℃/min升至250 ℃,保持5 min。
质谱分析:GC-MS接口温度280 ℃;离子源温度230 ℃;四极杆温度150 ℃;电离方式:电子电离;电子能量70 eV;质量扫描范围m/z 30~550。
1.3.4 数据处理
电子鼻数据分析:取稳定后第81~85秒间的数据信息进行主成分分析(principal component analysis,PCA)。
GC-MS数据分析:样品中挥发性成分的定性分析采用计算机谱库(NIST 11/Wiley 7.0)进行检索,并利用C8~C20正构烷烃的保留时间计算各个色谱峰的保留指数,确认挥发性物质的化学组成。挥发性成分的定量分析采用面积归一化法。
2 结果与分析
2.1 电子鼻检测
电子鼻是一个新颖的分析、识别和检测复杂嗅味和挥发性成分的传感器阵列形式的电化学传感系统[10]。不同脱腥剂处理草鱼鱼肉对传感器的响应值雷达图如图1所示,经过柠檬酸、碳酸氢钠脱腥处理的鱼肉和脱腥前的鱼肉样品风味轮廓之间存在显著差异,响应值变化较为明显的传感器由大到小分别是R(6)、R(7)、R(8)和R(9),这说明经过这2 种脱腥剂处理以后,鱼肉中的烷烃类R(6)、无机硫化物R(7)、乙醇类R(8)、芳香成分和有机硫化物R(9)均有所减少,说明柠檬酸、碳酸氢钠对鱼肉腥味的脱除有一定的作用,其中柠檬酸的效果更明显。使用酵母发酵脱腥时,可能是酵母的独特气味能够掩盖鱼肉的气味,也可能酵母在脱腥过程中发酵产物的影响,因此酵母处理的鱼肉样品对传感器的响应值最大。由电子鼻结果可以初步确定相比酵母和碳酸氢钠而言,柠檬酸脱腥处理后挥发性成分的减少显著。
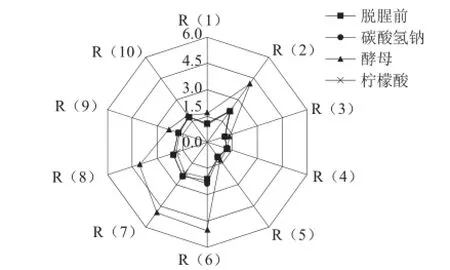
图1 脱腥前后鱼肉样品的气味感应强度雷达图Fig.1 Radar chart of odor in fresh and deodorized samples
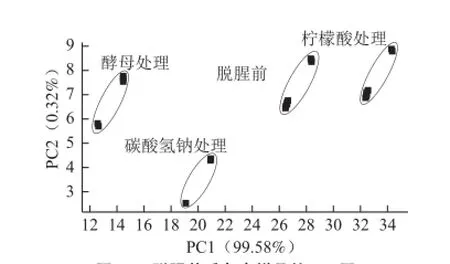
图2 脱腥前后鱼肉样品的PCCAA图Fig.2 PCA plot of fresh and deodorized grass samples
PCA是一种设法将原来指标重新组合成一组新的互相无关的几个综合指标来代替原来指标,同时根据实际需要从中可去除几个较少的综合指标,以尽可能多地反映原来指标,通过改变坐标轴来达到区分样品的分析方法[11]。为进一步分析3 种不同脱腥剂对鱼肉的脱腥效果,采用PCA法对这些气味指纹数据进行数理统计。由图2可知,第1主成分PC1贡献率达到99.58%,PC1和PC2贡献率之和达到99.9%,能较好地反映原始高维矩阵数据的信息,说明电子鼻能有效区分不同鱼肉样品的气味变化。从不同脱腥剂处理的鱼肉样品与未处理的鱼肉原样之间的距离上来看,酵母处理的鱼肉与脱腥前的鱼肉距离最大,柠檬酸与脱腥前距离最小,说明酵母脱腥以后鱼肉的气味成分差异显著,而柠檬酸和碳酸氢钠处理的鱼肉气味成分的差异不显著。经过酵母处理后,由于自身或发酵产物的影响,使得酵母处理后样品与脱腥前鱼肉挥发性成分差异显著。为明确脱腥前后风味成分的变化,采用GC-MS对挥发性风味物质进行进一步分析和鉴定。
2.2 GC-MS分析结果
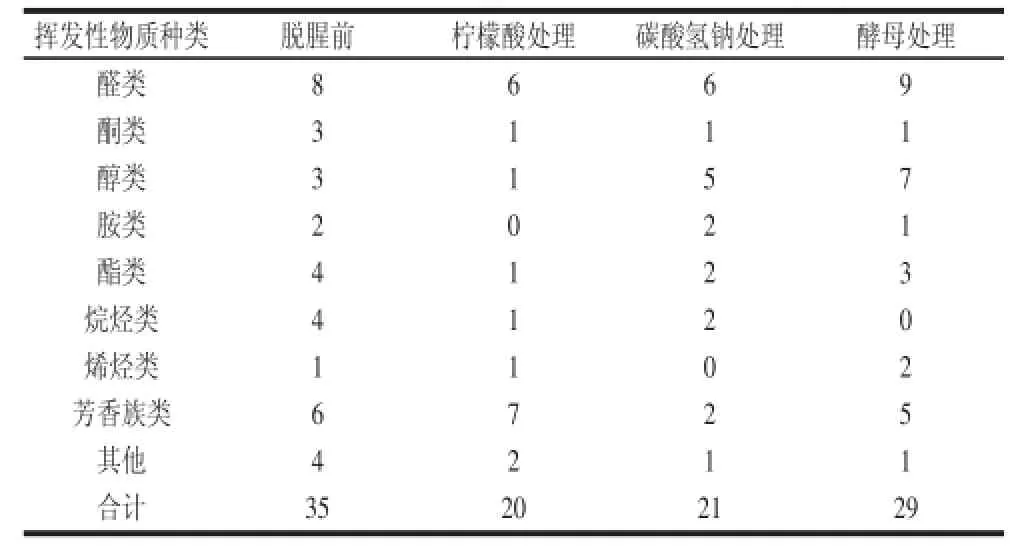
表3 不同处理草鱼样品中挥发性物质种类及个数Table3 Chemical classes and number of volatile compounds in fish muscle samples with different treatments
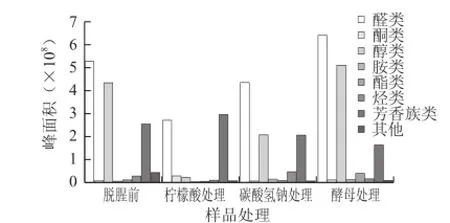
图3 不同处理样品中各类挥发性成分总峰面积比较Fig.3 Comparison of peak areas of volatile compounds in fresh and deodorized fish muscle samples
通过HS-SPME-GC-MS技术共检测出63 种挥发性物质,在脱腥前、柠檬酸处理、碳酸氢钠处理、酵母处理的鱼肉样品中分别检测出35、20、21 种和29 种挥发性物质(表3)。采用脱腥剂处理后,挥发性成分的峰面积和个数都显著减少,其中柠檬酸的脱腥效果最好。图3为脱腥前和3 种脱腥剂处理后鱼肉挥发性物质的峰面积。由图3可知,醛类、醇类、酯类和芳香族类在脱腥前的鱼肉中含量较高,经柠檬酸和碳酸氢钠处理后的鱼肉中所含的醛类、醇类的峰面积都减少,其中柠檬酸脱腥效果更加显著。经酵母处理的鱼肉,其醛类、醇类的峰面积有所增加,可能是微生物的发酵作用对挥发性物质含量的增加有协同作用[12],这与电子鼻的检测结果相一致。
2.2.1 羰基化合物
羰基化合物包括醛类和酮类,在水产品气味特征中起重要作用。表4为脱腥前和经3 种脱腥剂处理的鱼肉样品中挥发性物质的峰面积比较。脱腥前的草鱼鱼肉中挥发性成分醛类含量最高,占总挥发性成分的41.05%。脱腥前和柠檬酸、碳酸氢钠、酵母处理后鱼肉样品中醛类的个数分别为8、6、6、9 种。己醛、庚醛、壬醛、(Z)-2-庚烯醛、(E)-2-辛烯醛在各样品中均检出,其中己醛的含量最高。据报道,一些相对分子质量低的醛类物质的阈值很低[13],对鱼的特征香味有贡献[14-15],通常会产生一些刺激性的辛辣气味,其可能来源于不饱和脂肪酸氧化后形成的过氧化物的裂解。己醛具有青草味、腥味,是导致鱼体产生腥味的主要物质之一,常与C8、C9的挥发性化合物对鱼肉的香味起协同作用[16];庚醛、壬醛具有鱼腥味,(Z)-2-庚烯醛、(E)-2-辛烯醛也被证实是多种鱼类的典型腥味物质,这些醛类的阈值极低,对鱼肉的腥味具有加和作用[17]。经脱腥剂处理后,3-甲基丁醛、(Z)-2-庚烯醛、癸醛、2,4-癸二烯醛全部脱除,己醛、庚醛、壬醛的含量均减少,柠檬酸处理的样品脱腥效果最好,其总峰面积约减少50%;酵母脱腥过程中因微生物发酵作用,醛类总峰面积增加,可能是酵母发酵产生的风味掩盖了鱼腥味,或是酵母特有的香味阈值较低,使腥味不明显。苯乙酮、2-庚酮、1,2,4,5-四甲基-3-吡唑烷酮经脱腥剂处理后被完全脱除。酮类物质具有特殊的香气,阈值较高,对鱼肉气味的贡献相对较小[18],但酮类对腥味具有增强作用。
2.2.2 醇类化合物
未处理的草鱼鱼肉挥发性成分中醇类含量为33.56%,经柠檬酸、碳酸氢钠、酵母处理后的鱼肉样品中醇类的含量为2.81%、22.63%和36.75%。醇类物质主要是由脂肪酸氧化酶作用于多不饱和脂肪酸衍生而来的。C4~C11的醇类物质会产生类似金属或泥土的气味,一般认为是由脂肪酸衍生或羰基化合物还原产生[19]。不饱和醇类的香气阈值较低,对鱼肉风味贡献较大。鱼肉中的1-己醇、1-辛烯-3-醇、2-癸烯-1-醇等醇类物质经脱腥后均有明显的减少,其中1-己醇和2-癸烯-1-醇经柠檬酸处理后被完全脱除;经柠檬酸处理的样品中1-辛烯-3-醇的峰面积减少90%。有报道指出,1-己醇呈现青草味[20],1-辛烯-3-醇具有泥土或蘑菇的气味[21],这2 种物质是多种鱼类的挥发性香味物质。
2.2.3 烃类、芳香族类及胺类化合物

表4 草鱼脱腥前后挥发性成分峰面积比较Table4 Comparison of peak areas of volatile compounds in fish muscle samples with and without deodorization
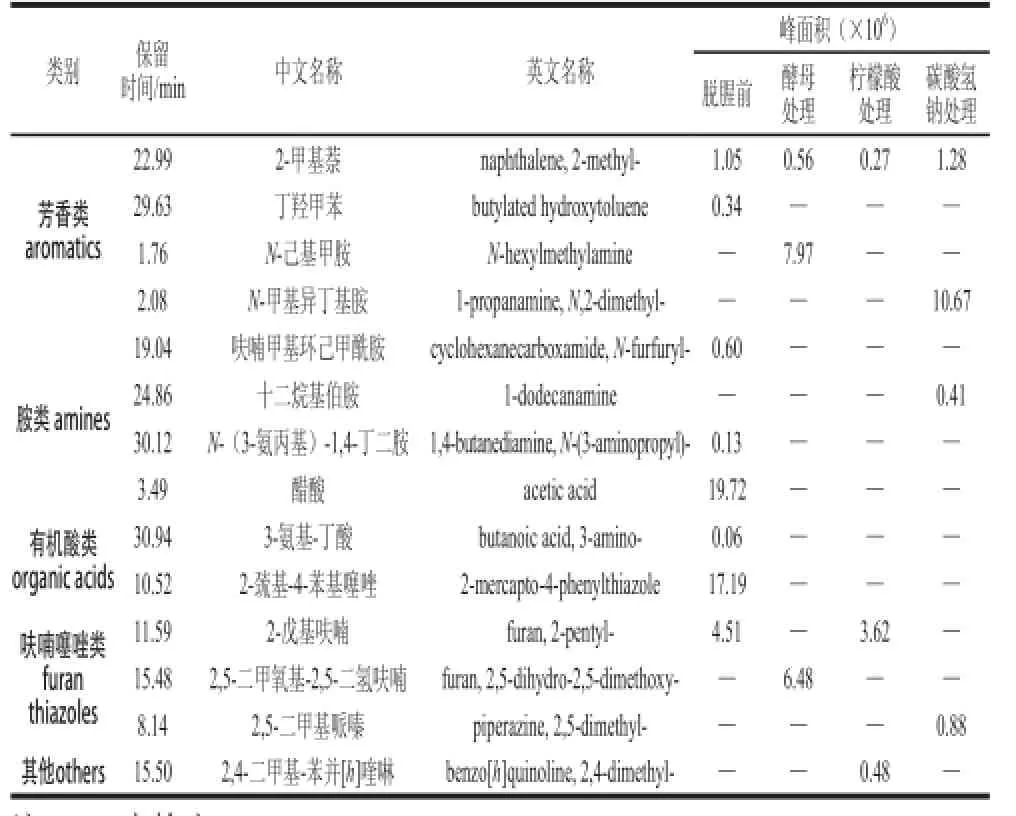
续表4
烷烃类物质(C6~C19)曾在甲壳类水产品中被检出,由于它们的阈值较高,因而对其整体的风味贡献不大。烯烃类化合物在一定条件下可形成醛和酮,对风味有增强作用,也是产生鱼腥味的潜在因素[22]。脱腥前后的样品中均检出D-柠檬烯,柠檬烯类物质可能来自周围的环境中[23]。此外,本实验检出的甲苯、对二甲苯、邻伞花烃、萘、二甲基萘、丁羟甲苯可能来自鱼体的生长环境,这些物质会使鱼肉呈现出令人不愉快的气味。胺类对鱼肉的腥味有增强效应,鱼体腐败产生的三甲胺等具有腥臭味,由于实验采用的是鲜活草鱼,因此所含的胺类化合物较少,对腥味的影响较小。
3 结 论
通过电子鼻检测发现,经过柠檬酸和碳酸氢钠处理的草鱼鱼肉的腥味有明显的减弱,其中柠檬酸脱腥后的鱼肉气味最小,响应值减少幅度最大;酵母因微生物发酵和自身气味使得电子鼻检测的响应值大于脱腥前鱼肉样品。采用GC-MS法在脱腥前、柠檬酸处理、碳酸氢钠处理和酵母处理的鱼肉样品中分别检测出35、20、21 种和29 种挥发性物质,主要包括醛类、酮类、醇类、酯类、烯烃类及胺类等物质。其中己醛、1-己醇、1-辛烯-3-醇、壬醛、庚醛等是主要的挥发性成分,呈现出腥味或青草味,经过脱腥剂处理后的鱼肉样品中,这些物质含量明显减少。从使用不同脱腥剂处理的鱼肉样品中挥发性物质的数量和总峰面积的减少趋势来看,柠檬酸的脱腥效果最好,其次是碳酸氢钠及酵母,这一结果与电子鼻检测结果相一致。
[1] 施文正, 汪之和, 朱耀周, 等. 漂洗过程中草鱼鱼糜挥发性成分变化的研究[J]. 食品工业科技, 2009, 30(12): 376-379.
[2] 王磊, 刘学军. 草鱼肉发酵香肠的发酵工艺研究[J]. 食品工业科技, 2011, 32(2): 172-177.
[3] GUTTMAN L, van RIJN J. 2-Methylisoborneol and geosmin uptake by organic sludge derived from a recirculating aquaculture system[J]. Water Research, 2009, 43(2): 474-480.
[4] SELLI S, PROST C, SEROT T. Odour-active and off-odour components in rainbow trout (Oncorhynchus mykiss) extracts obtained by microwave assisted distillation-solvent extraction[J]. Food Chemistry, 2009, 114(1): 317-322.
[5] BIANCHI F, CARERI M, MUSCI M, et al. Fish and food safety: determination of formaldehyde in 12 fi sh species by SPME extraction and GC-MS analysis[J]. Food Chemistry, 2007, 100(3): 1049-1053.
[6] GIRI A, OSAKO K, OHSHIMA T. Identifi cation and characterisation of headspace volatiles of fish miso, a Japanese fish meat based fermented paste, with special emphasis on effect of fi sh species and meat washing[J]. Food Chemistry, 2010, 120(2): 621-631.
[7] IGLESIAS J, MEDINA I. Solid-phase microextraction method for the determination of volatile compounds associated to oxidation of fish muscle[J]. Journal of Chromatography A, 2008, 1192(1): 9-16.
[8] BARANAUSKIENĖ R, VENSKUTONIS P R, GALDIKAS A, et al. Testing of microencapsulated fl avours by electronic nose and SPMEGC[J]. Food Chemistry, 2005, 92(1): 45-54.
[9] 付湘晋, 许时婴, 王璋, 等. 电子鼻检测白鲢鱼腥味[J]. 浙江大学学报: 农业与生命科学版, 2010, 36(3): 316-321.
[10] 毕丽君, 高宏岩. 电子鼻(EN)及其在多领域中的应用[J]. 医学信息, 2006, 19(7): 1283-1286.
[11] 黄海涛, 陈章玉, 施红林, 等. 茶叶香味扫描和挥发性化学成分分析[J].分析化学, 2005, 33(8): 1185-1188.
[12] 刘丽娜, 付湘晋, 许时婴. 斑点叉尾(鱼回)鱼皮明胶的风味成分及其脱腥的研究[J]. 食品与发酵工业, 2007, 33(12): 94-98.
[13] 杨倩倩, 邱杨, 余以刚, 等. 养殖大黄鱼脱脂脱腥处理前后挥发性成分的变化[J]. 食品科学, 2012, 33(14): 206-210.
[14] JOSEPHSON D B, LINDSAy R C, STUIBER D A. Volatile compounds characterizing the aroma of fresh Atlantic and Pacific oysters[J]. Journal of Food Science, 1985, 50(1): 5-9.
[15] JOSEPHSON D B, LINDSAy R C, STUIBER D A. Enzymic hydroperoxide initiated effects in fresh fish[J]. Journal of Food Science, 1987, 52(3): 596-600.
[16] ZHOU yiqi, WANG Zijian. Extraction and analysis on fishy odorcausing compounds in the different part of carp[J]. Chinese Journal of Analytical Chemistry, 2006, 34: 165-167.
[17] 施文正, 王锡昌, 陶宁萍, 等. 致死方式对养殖草鱼肉挥发性成分的影响[J]. 水产学报, 2011, 35(3): 456-465.
[18] 王霞, 黄健, 侯云丹, 等. 电子鼻结合气相色谱-质谱联用技术分析黄鳍金枪鱼肉的挥发性成分[J]. 食品科学, 2012, 33(12): 268-272.
[19] 刘玉平, 陈海涛, 孙宝国. 鱼肉中挥发性成分提取与分析的研究进展[J]. 食品科学, 2009, 30(23): 447-451.
[20] JOSEPHSON D B, LINDSAy R C, STUIBER D A. Variations in the occurrences of enzymically derived volatile aroma compounds in saltand freshwater fish[J]. Journal of Agricultural and Food Chemistry, 1984, 32(6): 1344-1347.
[21] JOSEPHSON D B, LINDSAy R C, STUIBER D A. Identifi cation of compounds characterizing the aroma of fresh whitefish (Coregonus clupeaformis)[J]. Journal of Agricultural and Food Chemistry, 1983, 31(2): 326-330.
[22] 刘安军, 褚兰玲, 郑婕, 等. 鲤鱼土腥味成分的检测与去除[J]. 现代食品科技, 2011, 27(2): 219-223.
[23] ZHANG J Y, LIU S L, WANG Y, et al. Chemical, microbiological and sensory changes of dried acetes chinensis during accelerated storage[J]. Food Chemistry, 2011, 127(1): 159-168.
Flavor Compounds of Fresh and Deodorized Grass Carps as Determined by Electronic Nose Combined with GC-MS
CUI Fang-chao1, LI Ting-ting2, YANG Bing1, LIU Ying1, LI Jian-rong1,*, LI Hong-jun3, LI Min-zhen4
(1. Food Safety Key Laboratory of Liaoning Province, College of Chemistry, Chemical Engineering and Food Safety, Bohai University, Jinzhou 121013, China; 2. College of Life Science, Dalian Nationalities University, Dalian 116600, China; 3. College of Food Science, Southwest University, Chongqing 400715, China; 4. Anshan Jiaxian Agricultural Development Co. Ltd., Anshan 114100, China)
Grass carp muscles were deodorized by using citric acid, yeast or NaHCO3. The volatile compounds in undeodorized and deodorized fish meats were identified by electronic nose and head-space solid-phase microextraction coupled with gas chromatography and mass spectrometry (HS-SPME-GC-MS). The results revealed that electronic nose could discriminate among undeodorized and deodorized fi sh meats by fl avor characteristics. Principal component analysis (PCA) showed that the apparent difference among undeodorized and deodorized samples could be well discriminated by electronic nose. Meanwhile, GC-MS analysis showed that 35, 20, 21, and 29 volatile compounds were identifi ed in fresh meat and samples deodorized with citric acid, NaHCO3and yeast, respectively. Moreover, the deodorized samples were less rich in volatile compounds, and citric acid resulted in the most signifi cant reduction in the number of volatile compounds and peak area, followed in decreasing order by NaHCO3and yeast. The GC-MS results were consistent with those from electronic nose.
electronic nose; gas chromatography-mass spectrometry (GC-MS); headspace solid phase micro-extraction (HS-SPME); grass carp; deodorization
TS254.9
A
1002-6630(2014)20-0126-05
10.7506/spkx1002-6630-201420025
2014-02-26
国家自然科学基金青年科学基金项目(31301572);“十二五”国家科技支撑计划项目(2012BAD29B06);辽宁省食品安全重点实验室开放课题项目(LNSAKF2011008)
崔方超(1989—),男,硕士研究生,主要从事水产品贮藏加工与质量安全控制研究。E-mail:cfc1031@163.com
*通信作者:励建荣(1964—),男,教授,博士,主要从事水产品和果蔬贮藏加工及质量安全研究。E-mail:lijr6491@163.com
