金枪鱼暗色肉酶解工艺及其水解物营养价值评价
2014-01-18刘建华蔡燕萍丁玉庭
刘建华,王 斌,郐 鹏,蔡燕萍,丁玉庭,*
(1.浙江工业大学海洋学院,浙江 杭州 310014;2.威海市产品质量监督检验所,山东 威海 264209)
金枪鱼暗色肉酶解工艺及其水解物营养价值评价
刘建华1,王 斌1,郐 鹏2,蔡燕萍1,丁玉庭1,*
(1.浙江工业大学海洋学院,浙江 杭州 310014;2.威海市产品质量监督检验所,山东 威海 264209)
利用胰蛋白酶,以金枪鱼暗色肉为原料、水解度和氮回收率为指标,制备蛋白水解液。通过正交试验得到最佳酶解条件为:加酶量2 400 U/g原料、初始pH 8.0、酶解温度55 ℃、酶解时间6 h,在此条件下制得酶解液水解度(19.89±0.10)%、氮回收率(64.88±0.72)%。通过高效液相色谱分析酶解液分子质量分布,结果表明酶解对大分子蛋白质有明显的降解作用,酶解液主要由寡肽组成,降解生成的物质分子质量以3 kD以下为主,1 kD以下占大部分(质量分数79.23%)。通过对酶解液氨基酸组成的分析表明,产物酶解液各种氨基酸种类齐全,必需氨基酸含量丰富(质量分数42.38%),可用作食品的营养补充剂。
胰蛋白酶;金枪鱼暗色肉;正交试验;分子质量分布;营养评价
金枪鱼是一种深海鱼类,具有高蛋白、低脂肪等特点,备受青睐。金枪鱼产品以生鱼片和鱼罐头为主,会产生很多副产物,例如鱼皮、内脏、鱼骨等。传统上鱼下脚料都是直接被加工为鱼饵或动物饲料,商业价值较低[1]。随着世界鱼类产量的增加和消费形式的多样化,如何利用加工副产物逐渐成为研究热点。近年来,酶解一度成为众学者研究的课题之一,酶解对象涉及各种动植物蛋白资源[2-4],研究的主要方向集中在4 个方面,分别为蛋白酶的选择及其条件的优化、蛋白水解物(肽)的加工功能特性、蛋白水解物(肽)的氨基酸组成和相对分子质量分布以及营养价值研究、蛋白水解物(肽)的生理活性研究及其应用。并且相关研究证明了酶解过程的可操作性、稳定性和产物的功能特性[5]。
国内外也有部分学者研究金枪鱼的酶解[6-7],但较少有暗色肉的酶解研究[8]。本实验以金枪鱼副产物暗色肉为原料,利用胰蛋白酶,旨在研究加酶量等因素对酶解效果的影响,利用正交试验优化酶解工艺同时对酶解产物的分子质量分布和氨基酸组成情况进行评价,为后续研究奠定基础,为工业生产提供理论依据。
1 材料与方法
1.1 材料与试剂
黄鳍金枪鱼暗色肉 浙江大洋世家股份有限公司;胰蛋白酶(2.5×105U/g) 北京鼎国昌盛生物技术有限责任公司;氢氧化钠、浓盐酸、浓硫酸、苯酚、硝酸银、甲醛等均为国产分析纯。
1.2 仪器与设备
BS-223S型精密电子天平 北京赛多利斯仪器系统有限公司;pHS-3C型pH计 上海精密科学仪器有限公司;DHG-9070型电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;TGL-16M高速台式冷冻离心机 长沙湘仪离心机仪器有限公司;DF-101S集热式恒温加热磁力搅拌器河南省予华仪器有限公司;UV-759紫外-可见分光光度计上海奥谱勒仪器有限公司;SyKAM433D氨基酸自动分析仪 德国塞卡姆公司;e2695高效液相色谱仪(紫外检测器) 美国Waters公司。
1.3 方法
1.3.1 工艺流程
将金枪鱼暗色肉用打浆机绞碎,用保鲜袋分装,并放入冰箱中冻存。酶解时,将原料取出,流水解冻,以一定的液固比调节pH值和温度,加酶水解。水解完成后升温至80 ℃保温20 min灭酶,8 000 r/min转速离心10 min,取上清液即得酶解液。流程见图1。

图1 金枪鱼暗色肉酶解流程图Fig.1 Flow chart for the preparation of tuna dark muscle hydrolysates
1.3.2 指标检测
1.3.2.1 理化指标测定[9]
水分含量:直接干燥法;灰分含量:高温灼烧法;脂肪含量:索式抽提法;总糖含量:苯酚-浓硫酸比色法;氨基态氮含量的测定:甲醛滴定法;总氮、粗蛋白含量:凯氏定氮法。
1.3.2.2 水解度(degree of hydrolysis,DH)的计算[10-11]

1.3.2.3 氮回收率(nitrogen recovery,NR)的计算[11-12]

1.3.3 酶解工艺条件参数的确定
分别考察加酶量、酶解时间、初始pH值、酶解温度以及液固比5 个因素对DH和NR的影响。并在单因素试验的基础上,选定加酶量、酶解时间、初始pH值以及酶解温度4 个影响因素,每个因素相应取3 个试验水平,进行正交试验分析,优化胰蛋白酶水解金枪鱼暗色肉的工艺参数。胰蛋白酶水解四因素三水平正交试验因素水平表L9(34)如表1所示。

表1 酶解正交试验因素水平表Table1 Factors and levels used in orthogonal array design for enzymatic hydrolysis of tuna dark muscle
1.3.4 酶解液分子质量分布分析
分析最优条件下得到的酶解液,使用Waters高效液相色谱仪,配有紫外检测器;分析柱为TSKGEL G2000PWXL;流速0.5 mL/min;流动相为0.05 mol/L磷酸盐缓冲液,pH 7.2;检测波长220 nm。
1.3.5 酶解液氨基酸组成成分分析
酶解液用6 mol/L HCl溶液水解并稀释后,用氨基酸自动分析仪进行定量分析。色氨酸经过碱水解后,用相同方法进行分析。酶解蛋白营养价值评价采用联合国粮食及农业组织/世界卫生组织(FAO/WHO)推荐的蛋白质模式。

2 结果与分析
2.1 原料基本成分分析

表2 金枪鱼暗色肉副产物主要成分测定Table2 Major components of tuna dark muscle
如表2所示,金枪鱼暗色肉水分质量分数为67.67%。金枪鱼暗色肉含有丰富的蛋白质,其粗蛋白质量分数高达25.66%,这与洪鹏志等[13]报道黄鳍金枪鱼背部肌肉粗蛋白的26.2%基本一致。但各种报道在金枪鱼肌肉粗脂肪含量上差异较大,质量分数波动范围在0.2%~2%[7,13-14],这可能是由于金枪鱼品种不同所造成的,但都远低于王凤祥[15]报道的罗非鱼的粗脂肪含量。充分体现了金枪鱼高蛋白低脂肪的特点。
2.2 酶解时间对酶解效果的影响
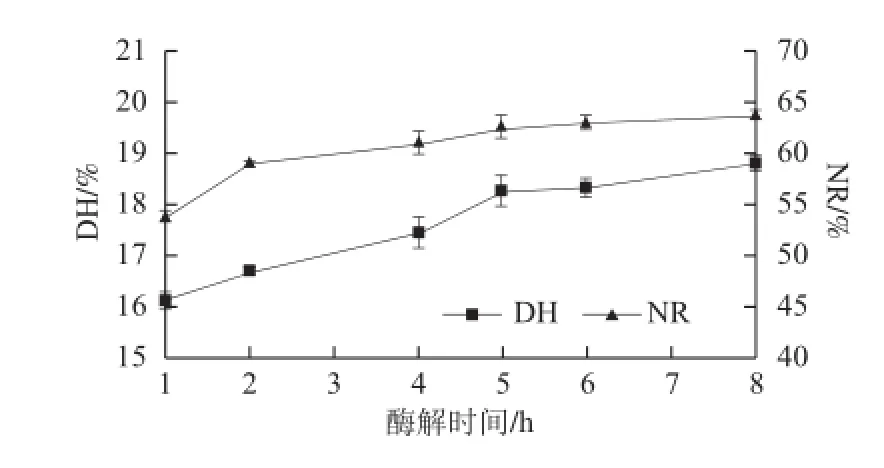
图2 酶解时间对酶解效果的影响Fig.2 Effect of hydrolysis time on DH and NR
酶解条件为液固比3∶1(mL/g)、加酶量2 500 U/g原料、初始pH 8.0、酶解温度50 ℃。由图2可知,随着酶解时间的延长,在1~5 h,肽类的含量呈显著上升趋势,而在5 h之后,肽类蛋白质的含量增加较缓慢。而氨基酸态氮的含量随着酶解时间延长呈不断升高趋势,但由于内切酶在酶切过程中氨基酸态氮占酶解液中总氮的比例较小,所以DH和NR先显著增加而后缓慢增加[16]。根据赵梅[17]的研究结果,随着时间的延长,胰蛋白酶的水解度在4 h之后增加较缓慢,这与本研究的结果相一致。所以综合DH和NR两个指标,最后将最佳酶解时间确定为4~6 h,并选择4、5、6 h为正交试验的水平条件。
2.3 加酶量对酶解效果的影响

图3 加酶量对酶解效果的影响Fig.3 Effect of enzyme dosage on DH and NR
酶解条件为液固比3∶1、初始pH 8.0、酶解时间5 h、酶解温度50 ℃。如图3所示,随着加酶量的增加DH先增大,在加酶量为2 500 U/g原料时达到最大值,随后下降。原因为随着加酶量的增加,酶解液中氨基酸态氮含量显著增加,当加酶量达到2 500 U/g原料之后,氨基酸态氮含量增加趋势缓慢,这与郝记明等[18]利用中性蛋白酶水解吉尾鱼所得的趋势一致,黄龙鸟等[19]在酶解乌鸡血的过程中也发现的类似的现象;同时酶解液中的非氨基酸态氮的含量不断增大。NR一直呈增大趋势,这可能是由于胰蛋白酶属内切酶,酶量的增大导致更多的酶作用于蛋白质[15],从而使原料中的蛋白更多的被酶解,回收率增大。考虑到酶量加大的同时会增加生产成本,所以选择加酶量为1 000~2 500 U/g原料,并选取1 200、1 800、2 400 U/g为正交试验的水平条件。
2.4 初始pH值对酶解效果的影响

图4 初始pH值对酶解效果的影响Fig.4 Effect of initial pH on DH and NR
酶解条件为液固比3∶1、加酶量2 500 U/g原料、酶解时间5 h、酶解温度50 ℃。由图4可知,在不调节pH值情况下进行酶解(pH 6.0),氮回收率很低;随着pH值的升高,NR显著增大,pH 8~9时达到最大值;pH值继续增大,过碱的环境不利于酶的作用,NR下降。DH的变化趋势与NR基本一致,随着pH值的升高而升高,在pH 8.0时最大,而后明显降低。由此可以得出所用酶的最适pH值在8左右,并选择7.5、8.0、8.5为正交试验的水平条件。
2.5 酶解温度对酶解效果的影响

图5 酶解温度对酶解效果的影响Fig.5 Effect of hydrolysis temperature on DH and NR
胰蛋白酶由动物肝脏提取而来,选取体温(37 ℃)、50、60 ℃为试验温度。其他酶解条件为:液固比3∶1、加酶量2 500 U/g原料、酶解时间5 h、初始pH 8.0。结果如图5所示,在试验选取的温度范围内,DH和NR均呈现先升高后下降的趋势。50 ℃时的DH和NR呈现出明显优势;而60 ℃条件下,可能由于温度过高,DH和NR均有显著下降。所以最适温度在50 ℃附近,选取45、50、55 ℃为正交试验水平件。
2.6 液固比对酶解效果的影响
酶解条件为酶解温度50 ℃、加酶量2 500 U/g原料、酶解时间5 h、初始pH 8.0。如图6所示,酶解液的NR随着液固比的增大先显著增大,到4∶1后增加缓慢;DH则先增大后降低,在4∶1时最大。所以4∶1是较适合的液固比。但液固比较高,也增加了用水的成本和之后浓缩工艺的负担,所以生产上可以考虑在液固比上有所调整。

图6 液固比对酶解效果的影响Fig.6 Effect of liquid-to-solid ratio on DH and NR
2.7 酶解条件正交试验

表3 正交试验方案及结果Table3 Arrangement and results of orthogonal array design

图7 正交试验的因素水平与DH趋势图Fig.7 Tendency chart of factors and levels
通过单因素试验分析可知,加酶量、初始pH值、酶解时间、酶解温度对酶解效果有重要影响。所以本实验以DH为指标,进行正交试验,结果见表3。4 个因素对DH的影响从大到小依次为酶解时间(C)>加酶量(A)>初始pH值(B)>酶解温度(D),酶解时间对DH的影响最为显著,这与已有研究[17,20]结果相一致,可以通过控制酶解时间来控制水解度的大小。由图7可知,最佳方案为A3B2C3D3,即加酶量2 400 U/g原料、初始pH 8.0、酶解时间6 h、酶解温度55 ℃。为进一步验证最佳方案,在最佳条件下对金枪鱼暗色肉进行酶解,测得水解度为(19.89±0.10)%,高于试验组的水解度;氮回收率为(64.88±0.72)%。
2.8 酶解液分子质量分布的变化
蛋白质的分子质量分布是酶解产物的重要指标。研究表明,蛋白酶解产物的多样性由多肽的相对分子质量和氨基酸序列组成决定,因此研究酶解过程中蛋白分子质量分布的变化对了解酶解作用规律有重要意义[21]。

表4 酶解前后多肽分子质量分布Table4 Molecular weight distribution of the hydrolysate
由表4可知,金枪鱼暗色肉中蛋白质以大分子为主。酶解产物以分子质量3 kD的成分为主,这与Ren Jiaoyan等[22]的结论相同。酶解产物分子质量大于3 kD的组分仅占3.77%,百分含量比未酶解时下降了56.25%;小于3 kD的组分百分含量显著增加,尤其是0.5~1 kD范围内小肽含量明显增加。说明酶解对大分子蛋白质有明显的降解作用,而且产物酶解液主要成分为寡肽。但是值得一提的是,蛋白质的酶解是一个动态变化过程,酶解产物的分布比例仅反映体系中宏观整体的分子质量情况[23],所以酶解液中寡肽的具体组成需进一步分离鉴定。已有研究显示,寡肽(<3 kD)组分会表现出更好的抗氧化性[22,24]等功能活性,本实验后续将对酶解产物的活性进行进一步探讨。
2.9 酶解产物酶解液的氨基酸组成及营养评价
酶解产物中氨基酸总量为5 689.80 mg/100 mL,必需氨基酸含量占总氨基酸的42.38%。同时,含丰富的呈味氨基酸,例如呈鲜味氨基酸(Glu和Asp)占15.01%,呈甜味氨基酸(Gly、Ala、Ser、Thr)占14.32%,具体氨基酸组成见表5。
与FAO/WHO推荐的必需氨基酸模式相比较,结果见表6。表明金枪鱼暗色肉酶解液的必需氨基酸种类齐全,含量丰富,与成人模式相比,第一限制氨基酸为色氨酸(Trp),氨基酸评分为193.20,这与任明[25]研究的梅鱼水解液结果相似;相对于学龄儿童模式的第一限制氨基酸为亮氨酸(Leu),评分为88.00。日常所食用的谷类食物的第一限制性氨基酸一般是Lys[26],而相对来讲,金枪鱼酶解液中Lys含量较丰富。因此该酶解液可作为成人、儿童的营养补充剂添加于食品中,通过氨基酸的互补作用,提高食品中蛋白质的营养价值。同时根据童彦等[26]的研究,Arg、Lys和Tyr是参与鳙鱼肉蛋白水解液美拉德反应的主要氨基酸,金枪鱼暗色肉酶解液中这几种氨基酸都较丰富,因此该酶解液可能也较适合作为美拉德风味反应的反应基液。

表5 酶解液氨基酸组成分析Table5 Amino acid composition of the hydrolysate

表6 金枪鱼暗色肉酶解液必需氨基酸与FAO/WHO推荐模式比较Table6 Comparison of essential amino acid pattern of tuna dark muscle hydrolysate and the FAO/WHO recommended pattern
3 结 论
本研究考察了加酶量、酶解时间、初始pH值、温度以及液固比对金枪鱼暗色肉DH和NR的影响,并选取出加酶量、酶解时间、初始pH值、温度为影响酶解效果的主要因素。利用正交试验,确定出胰蛋白酶酶解金枪鱼暗色肉的最佳工艺为:加酶量2 400 U/g原料、初始pH 8.0、酶解时间6 h、酶解温度55 ℃。在最佳条件下酶解金枪鱼暗色肉得到的酶解液DH为19.89%,NR为64.88%。酶解液的成分以寡肽为主,主要生成的物质分子质量在3 kD以下,尤以1 kD以下为主要成分,且氨基酸组成比例合理,必需氨基酸含量丰富。正交试验得出酶解时间对水解度的影响最大,将以时间为变量,对金枪鱼暗色肉酶解过程的蛋白质动态特性及多肽释放规律、以及酶解过程产物的功能特性进行进一步研究。
[1] GUERARD F, DUFOSSE L, de la BROISE D, et al. Enzymatic hydrolysis of proteins from yellowfi n tuna (Thunnus albacares) wastes using Alcalase[J]. Journal of Molecular Catalysis B: Enzymatic, 2001, 11(4/6): 1051-1059.
[2] KLOMPONG V, BENJAKUL S, KANTACHOTE D, et al. Antioxidative activity and functional properties of protein hydrolysate of yellow stripe trevally (Selaroides leptolepis) as infl uenced by the degree of hydrolysis and enzyme type[J]. Food Chemistry, 2007, 102(4): 1317-1327.
[3] 康玮丽, 唐军虎, 敬思群. 酶解核桃蛋白制备抗氧化肽工艺条件优化[J]. 食品与发酵工业, 2010, 36(12): 94-99.
[4] REN Jiaoyan, WANG Haiyan, ZHAO Mouming, et al. Enzymatic hydrolysis of grass carp myofi brillar protein and antioxidant properties of hydrolysates[J]. Czech Journal of Food Sciences, 2010, 28(6): 475-484.
[5] HERPANDI N H, ROSMA A, NADIAH W A W. The tuna fishing industry: a new outlook on fi sh protein hydrolysates[J]. Comprehensive Reviews in Food Science and Food Safety, 2011, 10(4): 195-207.
[6] 辛建美. 酶解金枪鱼碎肉制备活性肽及其分离的研究[D]. 舟山: 浙江海洋学院, 2011: 16-40.
[7] 王佳莉. 蛋白酶水解金枪鱼副产物的工艺研究[D]. 广州: 华南理工大学, 2011: 16-47.
[8] HSU K C. Purification of antioxidative peptides prepared from enzymatic hydrolysates of tuna dark muscle by-product[J]. Food Chemistry, 2010, 122(1): 42-48.
[9] 黄伟坤. 食品检验与分析[M]. 北京: 中国轻工业出版社, 1997: 13-80.
[10] 段振华, 张慜, 郝建, 等. 酶法水解鳙鱼下脚料及其降苦机理研究[J].食品工业科技, 2003, 24(5): 19-22.
[11] 徐慧诠, 郑为完, 周小娟. 酶法制备米渣可溶性蛋白粉[J]. 福建师大福清分校学报, 2010(5): 24-28.
[12] 杨萍, 夏永军, 范伟群. 木瓜蛋白酶对罗非鱼下脚料的水解作用[J].水产科学, 2008, 27(6): 290-292.
[13] 洪鹏志, 杨萍, 曾少葵, 等. 黄鳍金枪鱼背部肌肉的营养成分及评价[J].福建水产, 2006(2): 44-47.
[14] 杨金生. 金枪鱼肌肉冷藏工艺的研究[D]. 舟山: 浙江海洋学院, 2012: 13-17.
[15] 王凤祥. 罗非鱼酶解热反应制备鱼味香精的研究[D]. 广州: 华南理工大学, 2011: 20-21.
[16] yOU Lijun, REGENSTEIN J M, LIU Ruihai. Optimization of hydrolysis conditions for the production of antioxidant peptides from fi sh gelatin using response surface methodology[J]. Journal of Food Science, 2010, 75(6): 582-587.
[17] 赵梅. 罗非鱼下脚料酶解工艺的研究[D]. 福州: 福建农林大学, 2007: 11-41.
[18] 郝记明, 张静, 吉宏武, 等. 酶解制备吉尾鱼水解蛋白粉的工艺研究[J].现代食品科技, 2007, 23(3): 47-49.
[19] 黄龙鸟, 董文宾. 乌鸡血酶解工艺条件的研究[J]. 食品工业科技, 2013, 34(3): 197-200.
[20] 韩道财. 罗非鱼肌肉酶解物的制备及抗氧化活性研究[D]. 湛江: 广东海洋大学, 2012: 15-21.
[21] KIM S K, MENDIS E. Bioactive compounds from marine processing byproducts: a review[J]. Food Research International, 2006, 39(4): 383-393.
[22] REN Jiaoyan, ZHAO Mouming, SHI J, et al, Optimization of antioxidant peptide production from grass carp sarcoplasmic protein using response surface methodology[J]. LWT-Food Science and Technology, 2008, 41(9): 1624-1632.
[23] QI M, HETTIARACHCHy N S, KALAPATHy U. Solubility and emulsifying properties of soy protein isolates modified by pancreatin[J]. Journal of Food Science, 1997, 62(6): 1110-1115.
[24] NAQASH S y, NAZEER R A. Optimization of enzymatic hydrolysis conditions for the production of antioxidant peptides from muscles of Nemipterus japonicus and Exocoetus volitans using response surface methodology[J]. Amino Acids, 2012, 43(1): 337-345.
[25] 任明. 梅鱼酶解多肽的分析及功能性研究[D]. 杭州: 浙江工商大学, 2008: 14-17.
[26] 杨文鸽, 张芝芬, 薛长湖, 等. 蚌肉酶解蛋白的肽相对分子质量分布及其营养评价[J]. 中国食品学报, 2005, 5(3): 104-108.
[27] 童彦, 雒莎莎, 应铁进. 鱼蛋白水解液美拉德反应条件优化及反应前后氨基酸组成变化[J]. 中国食品学报, 2011, 11(8): 101-106.
Enzymatic Hydrolysis of Dark Muscle from Yellowfin Tuna (Thunnus albacares) and Nutritional Evaluation of Hydrolysates
LIU Jian-hua1, WANG Bin1, KUAI Peng2, CAI yan-ping1, DING yu-ting1,*
(1. College of Ocean, Zhejiang University of Technology, Hangzhou 310014, China; 2. Weihai Supervision and Inspection Institute of Product Quality, Weihai 264209, China)
This study investigated the preparation of protein hydrolysates from dark muscle from yellowfi n tuna as an edible fi sh by-product with trypsin. By using orthogonal array design, the optimal enzymatic hydrolysis conditions were determined as 2 400 U/g, 8.0, 55 ℃, and 6 h for enzyme dosage, initial pH, temperature, and hydrolysis time, respectively, resulting in a degree of hydrolysis (DH) of (19.89±0.10)% and a nitrogen recovery of (64.88±0.72)%. The molecular weight distribution of the hydrolysate as determined by high performance liquid chromatography (HPLC) suggested that signifi cant degradation of macromolecular proteins produced the hydrolysate mostly consisting of oligopeptides below 3 kD with molecules less than 1 kD accounting for the majority (79.23%) of the total oligopeptides. The hydrolysate contained all the common amino acids and was rich in eight essential amino acids (accounting for 42.38% of the total amino acids), and thus could be used as a nutritional supplement.
trypsin; yellowfi n tuna dark muscle; orthogonal array design; molecular weight distribution; nutritional evaluation
TS254.9
A
1002-6630(2014)20-0001-05
10.7506/spkx1002-6630-201420001
2014-02-20
国家自然科学基金青年科学基金项目(31301437);浙江省自然科学基金青年科学基金项目(LQ13C200003)
刘建华(1982—),男,副教授,博士,研究方向为功能性食品研究和水产品加工。E-mail:jhliu@zjut.edu.cn
*通信作者:丁玉庭(1963—),男,教授,博士,研究方向为水产品加工、贮藏和保鲜。E-mail:dingyt@mail.hz.zj.cn
