RS4型抗性淀粉对齐口裂腹鱼脂肪代谢相关酶及相关基因表达的影响
2014-01-18向世琼邬应龙
向世琼,邬应龙*,冯 娇
(四川农业大学食品学院,四川 雅安 625014)
RS4型抗性淀粉对齐口裂腹鱼脂肪代谢相关酶及相关基因表达的影响
向世琼,邬应龙*,冯 娇
(四川农业大学食品学院,四川 雅安 625014)
目的:研究RS4型抗性淀粉对齐口裂腹鱼脂肪代谢相关酶及相关基因表 达的影响。方法:将体质量75g左右的齐口裂腹鱼随机按RS4型抗性淀粉添加量分为5组:0%(对照组)、3.5%、7%、14%、28%。饲喂60d,采用铜试剂法测定脂蛋白脂酶(lipoprotein lipase,LPL)、肝脂酶(hep atic lipase,HL)活性及游离脂肪酸(free fatty acids,FFA)含量,并采用实时荧光定量聚合酶链式反应(real-time-polymerase chain reaction,RT-PCR)技术检测各组肌肉及肝脏中过氧化物酶增殖体激活受体γ(peroxisome proliferators activated receptor γ,PPARγ)、过氧化物酶体增殖物激活受体γ辅助活 化因子(peroxisome proliferators activated receptor γ coactivator-1α,PGC-1α)mRNA表达水平。结果:RS4型抗性淀粉添加剂量在7%以上时能够显著的提高齐口裂腹鱼肝脏中脂蛋白脂酶和肝脂酶活性(P<0.05),使血清及肝脏中游离脂肪酸含量增加(P<0.05);添加量为3.5%对LPL、HL活性及FFA含量均无显著影响(P>0.05)。添加量为7%和14%时能显著提高肌肉和肝脏中PPARγ和PGC-1α mRNA表达量(P<0.05)。结论:适当的添加RS4型抗性淀粉能提高齐口裂腹鱼肌肉和肝脏中脂肪代谢相关基因mRNA表达水平,同时也能够增加齐口裂腹鱼肝脏中脂肪代谢相关酶的活性,促进甘油三酯的分解。
抗性淀粉;齐口裂腹鱼;实时荧光定量PCR;过氧化物酶增殖体激活受体γ;过氧化物酶体增殖物激活受体γ辅助活化因子
欧洲抗性淀粉研究协会1993年将抗性淀粉(resistant starch)定义为:不被健康人体小肠所吸收的淀粉及其降解产物的总称。根据抗性淀粉产生抗性的原理不同一般将其分为4种,化学改性淀粉是RS4型抗性淀粉,相比原淀粉,其更不易消化,有更高的黏度,更耐酸和高温[1]。近年来,抗性淀粉和含有抗性的食物因其生理功能与膳食纤维相似,能有效预防心血管疾病、高脂血症、糖尿病的发生以及增加肠道菌群的多样性等优点,使其备受关注。
齐口裂腹鱼(Schizothorax prenanti Tchang)为主要分布于大渡河、青衣江水系上游的一种冷水性鱼类,属鲤科中的裂腹鱼亚科裂腹鱼属,其肉质细嫩、味道鲜美,具有较高的营养价值和经济价值[2]。
国内外大量研究表明抗性淀粉对小鼠的脂质代谢有一定的调节作用,能够改善其肠道菌群,并且对肥胖相关炎症因子TNF-α、IL-6和MCP-1有一定的调节作用[3-8]。Takanori等[9]研究表明抗性淀粉能下调肝脏中固醇调节元件结合蛋白1(sterol regulatory element binding protein,SREBP1-C) mRNA表达水平,进而可能调节其成熟形式的释放导致脂肪酸合成酶(fatty acid synthase,FAS)mRNA水平的下降。Hara等[10]报道称饲喂膳食纤维血清胆固醇降低,可能是由于盲肠内容物产生的有机酸对其肝脏中胆固醇合成抑制造成的。但RS4型抗性淀粉在鱼类上的运用和作用机理还未见报道。本实验采用在齐口裂腹鱼饵料中添加不同剂量的RS4型抗性淀粉的方法,探讨其对齐口裂腹鱼脂肪代谢相关酶的影响,并通过实时荧光定量聚合酶链式反应(real time-polymerase chain reaction,RT-PCR)技术检测齐口裂腹鱼脂质代谢相关基因氧化物酶体增殖物激活受体γ(peroxisome proliferators activated receptor γ,PPARγ)、过氧化物酶体增殖物激活受体γ辅助活化因子(peroxisome proliferators activated receptor γ coactivator-1α,PGC-1α)mRNA表达水平,以期为RS4型抗性淀粉调节鱼类脂肪代谢提供相应的理论依据。
1 材料与方法
1.1 材料与试剂
RS4型抗性淀粉为实验室自制[11]。
脂蛋白脂酶(lipoprotein lipase,LPL)、肝脂酶(hepatic lipase,HL)、总脂酶(total lipozyme,TL)、游离脂肪酸(free fatty acid,FFA)组织蛋白试剂盒南京建成生物工程研究所;TRNzol Tiangen公司;反转录试剂盒、SYBR®Premix Ex TaqTM日本TaKaRa公司;荧光定量八连板 美国Bio-Rad公司。
1.2 仪器与设备
PCR仪器、荧光定量PCR仪器、凝胶成像系统、水平电泳槽、电泳仪 美国Bio-Rad公司;微量移液器、Centrifuge 5810R高速低温离心机 德国Eppendorf公司。
1.3 动物及处理
1.3.1 实验用鱼
齐口裂腹鱼(Schizothorax prenanti Tchang)为雅安天全县齐口裂腹鱼场2012年孵化的同一批鱼种。体质量(75.47±5.12)g/尾,体长(16.09±0.73)cm。选择体质健壮的鱼种240尾,用20 mg/L的KMnO4消毒15 min。
1.3.2 饲料及分组
饲料配方参照 NRC(1993)[12]鱼类营养需要和段彪等[13]的齐口裂腹鱼饲料配方设计基础饲料配方,见表1。
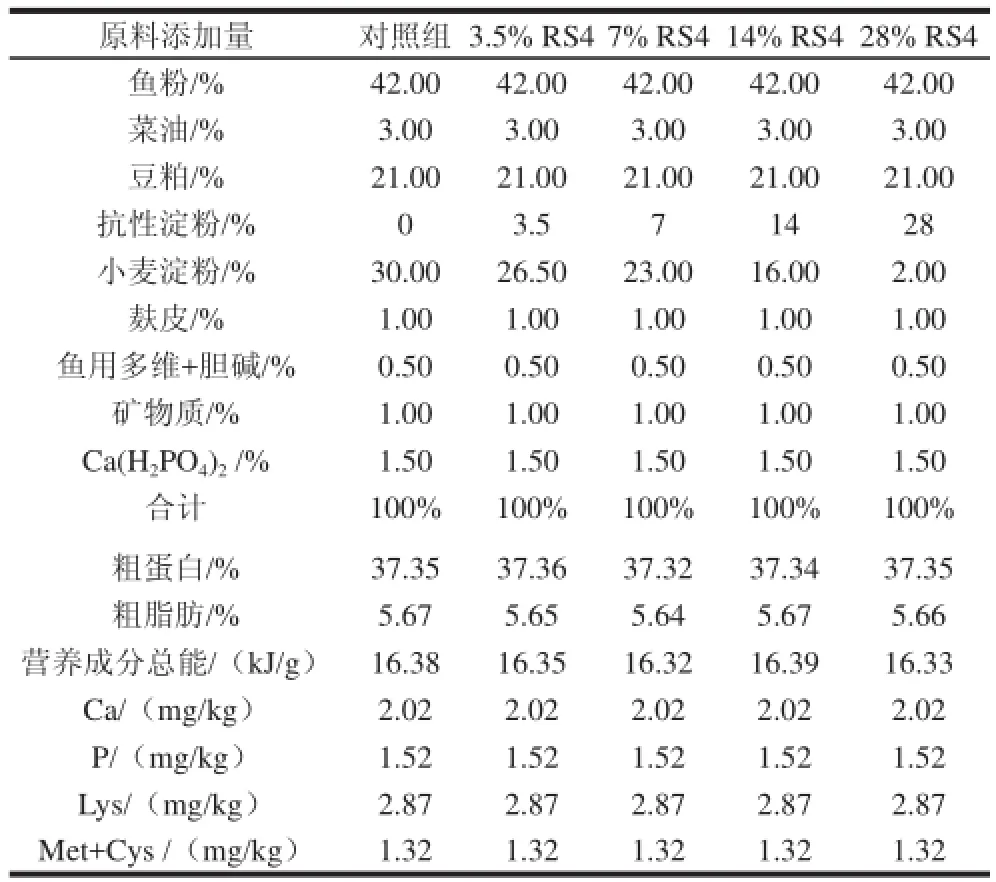
表1 实验饲料的组成及营养水平Table1 Ingredients and nutrient levels of the experimental diets
在基础饲料中分别添加0%(对照组)、3.5%、7%、14%、28% RS4型抗性淀粉(等量减少小麦淀粉用量),共5 个剂量组,每个剂量组4 个重复,每个重复12尾鱼。各种饲料原料均过40 目筛,充分混合后加工成1mm的硬颗粒饲料,烘干并保存于冰箱中,破碎后投喂。
1.3.3 饲养管理
实验鱼饲养于20 个玻璃缸中(2.0 m×1.5 m× 1.2 m),水深0.6 m。用基础饲料驯化14d,待鱼摄食正常后开始实验,日投喂3 次,投饵率为体质量2%~2.5%,并根据水温、摄食情况进行调整,各组保持一致的投饲量。养殖实验期间水温16~20 ℃,溶解氧>5.0 mg/L、NH3-N<0.3 mg/L,昼夜充气。
1.4 方法
1.4.1 样品采集
实验结束时,对实验鱼饥饿24 h,尾静脉采血,每尾鱼的血样分别放置在4 ℃静置12 h后,4 ℃、3 000 r/min离心15 min,取其上清液(即血清),-80 ℃保存备用。解剖后迅速取出肝脏及肌肉,放入液氮中,-80 ℃保存备用。
取齐口裂腹鱼肝脏100 mg置于冰浴中,加入9 倍体积预冷的生理盐水进行组织匀浆。匀浆液在冰冻离心机于4 ℃、2 500 r/min离心10 min,取上清置于1.5 mL的离心管,-20 ℃存用于游离脂肪酸、肝脂酶和脂蛋白脂酶的测定。
1.4.2 指标测定
LPL和HL活性测定采用铜试剂法。组织酶活性定 义:每毫克组织蛋白每小时在反应系统中所产生的1 μmol FFA为1 个酶活性单位。酶活力单位用U/mg pro表示。
FFA含量采用铜试剂法测定,记录440 nm波长处的吸光度(A),与标准品相比计算FFA的含量,血清中单位用μmol/L表示,肝脏中单位用μmol/g pro表示。
组织蛋白浓度采用考马斯亮蓝法,单位用g pro/L表示。
1.4.3 引物设计与合成
用Primer Premier 5.0 软件根据GenBank中齐口裂腹鱼β-actin基因序列(JQ013000)、草鱼PPARγ基因序列(Eu847421.1)、草鱼PGC-1α基因序列(JN195739)设计特异性引物,引物序列见表2。

表2 引物序列及退火温度Table2 Primer sequences and anneal temperatures
1.4.4 总RNA提取和cDNA制备
参照TRNzol总RNA提取试剂盒说明书方法提取RNA,用10 g/L的琼脂糖凝胶电泳鉴定提取RNA的完整性,通过OD260nm/OD280nm检测样本纯度。
cDNA由逆转录试剂盒法制备,放置于-20℃备用。
1.4.5 实时荧光定 量PCR基因检测
使用荧光定量PCR仪器,采用SYBRGreen I荧光染料法,10 μL反应体系,含5 μL SYBR®Premix Ex TaqTM(2×)、上下游引物各0.25 μL、1 μL cDNA、3.5 μL DEPC水。荧光定量PCR步骤:95 ℃、3 min;95 ℃、10 s,55.8 ℃(β-actin)、30 s,39 个循环;95℃、10 s;扩增完毕后,迅速降温到65 ℃进行溶解曲线分析,然后以0.5 ℃/s的速率从65 ℃递增到95 ℃,连续测定样品荧光强度以获取溶解曲线。
1.4.6 相对表达量的分析
以β-actin基因作为内参基因,选择一校 准样本,比较待测样本相对校准样本的表达差异,利用2-△△Ct法进行相对定量分析,其中Ct值也称循环阈值,是指样品管的荧光信号达到某一固定阈值的PCR反应循环数。

结果是通过参照基因表达水平校正的待测样本中的目标基因相对于校准样本的相对表达量,用参照基因校准目标基因表达来弥补样本组织量的差异。
1.5 统计学分析
采用 SPSS16.0进行分析,本实验图表中所有数据均以±s表示,经方差分析之后,采用Duncan’s多重比较法分析实验结果的差异显著性,差异显著水平为0.05。
2 结果与分析
2.1 RS4型抗性淀粉对齐口裂腹鱼肝脏中脂酶活性的影响

图1 RS4型抗性淀粉对齐口裂腹鱼肝脏中脂酶活性的影响±s,n=12)Fig.1 Effect of RS4 type resistant starch on the activities of LPL and HL in liver (x±s,n=12)
由图1可知,饵料中添加RS4型抗性淀粉量为7%以上时能显著提高齐口裂腹鱼肝脏中脂蛋白脂酶和肝脂酶活性(P<0.05),添加量为3.5%对肝脏中脂酶活性没有显著影响(P>0.05)。
2.2 RS4型抗性淀粉对齐口裂腹鱼肝脏及血清中游离脂肪酸含量的影响
由图2可知,饵料中添加RS4型抗性淀粉剂量为3.5%时对齐口裂腹鱼肝脏和血清中游离脂肪酸含量没有显著影响(P>0.05);添加剂量7%以上时与基础对照组相比能够显著提高血清中游离脂肪酸含量(P<0.05);7% RS4、28% RS4组能够显著提高肝脏中游离脂肪酸含量(P<0.05),但是14% RS4组对肝脏中游离脂肪酸没有显著影响(P>0.05),有可能是实验时操作误差造成的。
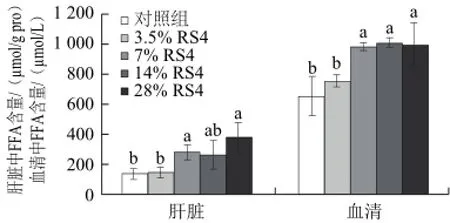
图2 RS4型抗性淀粉对齐口裂腹鱼肝脏及血清中游离脂肪酸含量的影响?,n=12)Fig.2 Effect of RS4 type resistant starch on free fatty acid content (?,n=12)
2.3 RNA质量检测及引物检测
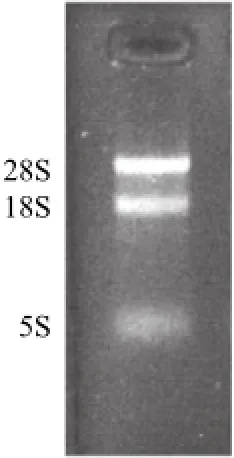
图3 齐口裂腹鱼肝脏RNA的电泳图谱Fig.3 Electrophoresis profile of total RNA from liver of Schizothorax prenanti Tchang
由图3可知,RNAVzol提取齐口裂腹鱼RNA并进行质量检测,迁移率从大到小依次是5S rRNA、18S rRNA、28S rRNA,其中28S条带亮度大约为18S条带的两倍,5S条带亮度较低、边缘模糊,说明总RNA样品完整、降解较少、质量良好。反转录后PCR方法对目的基因进行扩增,获得一条单一且明亮的特异的扩增条带,与预期片段大小一致(图4~6)。
图4 齐口裂腹鱼肝脏和肌肉β-aaccttiinn基因扩增条带图谱Fig.4 RT-PCR results of β-actin gene from liver and muscle of Schizothorax prenanti Tchang
图5 齐口裂腹鱼肝脏和肌肉PPPPAARRγ基因扩增条带图谱Fig.5 RT-PCR results of PPARγ gene from liver and muscle of Schizothorax prenanti Tchang

图6 齐口裂腹鱼肝脏和肌肉PGGCC--11α基因扩增条带图谱Fig.6 RT-PCR results of PGC-1α gene from liver and muscle of Schizothorax prenanti Tchang
2.4 RS4型抗性淀粉对齐口裂腹鱼肌肉和肝脏中PPARγ及PGC-1α mRNA表达水平的影响
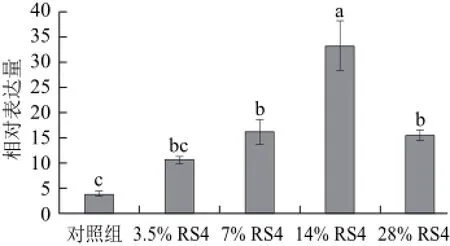
图7 肌肉中PPARγ mRNA 表达水平比较(x±s,n=12)Fig.7 PPARγ gene expression level in muscle (x±s,n=12)
由图7可知,饵料中抗性淀粉添加量7%以上与对照组相比能显著提高肌肉中PPARγ mRNA表达水平(P<0.05);添加量3.5%与对照组相比没有显著性差异(P>0.05);添加量为14%与其他组相比均有显著性差异(P<0.05)。

图8 肝脏中PPARγ mRNA 表达水平比较(x±s,n=12)Fig.8 PPARγ gene expression level in liver (x ±s,n=12)
由图8可知,7% RS4、14% RS4与其他组相比能够显著提高肝脏中PPARγ mRNA表达水平(P<0.05);3.5% RS4、28% RS4组与对照组相比没有显著差异(P>0.05)。

图9 肌肉中PGC-1α mRNA 表达水平比较(x±s,n=12)Fig.9 PGC-1α gene expression level in muscle (x±s,n=12)
由图9可知,7% RS4、14% RS4与基础对照组相比能显著提高肌肉中PGC-1α mRNA的表达量(P<0.05);3.5% RS4、28% RS4组与对照组相比没有显著差异(P>0.05);14% RS4与其他组比有显著差异(P<0.05)。

图10 肝脏中PG C-1α mRNA 表达水平比较(x±s,n=12)Fig.10 PGC-1α gene expression level in liver (x±s,n=12)
由图10可知,7% RS4、14% RS4组齐口裂腹鱼肝脏中PGC-1α mRNA表达水平与对照组相比没有显著性差异(P>0.05),但是数值上是升高的;3.5% RS4、28% RS4与对照组相比表达水平也没有显著差异(P>0.05),但数值是降低的。
3 讨 论
HL和LPL是鱼类肝胰脏中参与脂肪降解的2种关键酶,合称为TL。HL在肝细胞中合成,可作为配体促进低密度脂蛋白和乳糜微粒残粒进入肝细胞,并直接参与高密度脂蛋白胆固醇的逆转运和高密度脂蛋白残粒的分解[15]。LPL是一种糖蛋白,存在于多种细胞和组织中,能够水解富含甘油三酯的脂蛋白,产生游离脂肪酸[16]。本研究结果表明齐口裂腹鱼饵料中添加RS4型抗性淀粉剂量在7%以上时能够显著的增加鱼肝脏的肝脂酶和脂蛋白脂酶活性,加速了甘油三酯的水解,因而血液中TG含量减少而血清和肝脏中游离脂肪酸含量增加。
过氧化物酶体增殖物激活受体(peroxisome proliferators activated receptors,PPARs)有α、β、γ 3种类型,PPARγ是PPARs 3种异构体之一,具有多种生物效应,对脂肪细胞分化、能量代谢、糖代谢、脂代谢、动脉粥样硬化形成、炎性反应等起重要作用。PPARγ调控多种基因及脂代谢相关因子的表达,如脂酰辅酶A脱氢酶、过氧化物酶体双功能酶、LPL、微粒体CYP4A、细胞色素P450、脂肪酸羟化酶、UCP家族等基因的表达及瘦素、脂联素、肿瘤坏死因子A的分泌。RS4型抗性淀粉添加剂量为7%和14%时能够显著增加肝脏和肌肉中PPARγ mRNA的表达量。PPARγ能够诱导肝细胞表达载脂蛋白、脂肪酸氧化酶系与脂蛋白脂酶等,从而促进脂质的氧化代谢,降低血脂浓度,与Liu Xiong[17]、Kim[18]等研究结果一致。
PGC-1最初由Puigserver[19]于1998年作为核激素受体过氧化物酶体增殖物激活受体γ(PPARγ)的转录辅激活因子在小鼠体内发现。PGC-1一方面在能量代谢和适应生热作用中有重要的调节作用,另一方面作为转录协同刺激因子发挥了更多重要的作用。PGC-1被认为在适应性产热、线粒体生成、脂肪酸的β氧化及肝糖异生等过程中有着重要作用[20],RS4型抗性淀粉添加剂量为7%和14%时能够显著增加齐口裂腹鱼肌肉和肝脏的PGC-1α mRNA表达量。PGC-1作为转录协同刺激因子,其通过与PPARγ、雌激素受体、糖皮质激素受体、核呼吸因子(nuclear respiratory factor,NRF-1)等各种转录因子相结合,调节各种转录而发挥生理功能。PPARγ和PGC-1α mRNA表达量增加,能够调节脂类代谢靶基因的表达,正向调节脂肪细胞的分化。
RS4型抗性淀粉作为一种可溶性膳食纤维,在饵料中添加为7%和14%时能提高肝脏和肌肉中PPARγ和PGC-1α mRNA表达量,从而诱导脂肪代谢相关酶的表达,提高了脂肪代谢相关酶活性,血清和肝脏中游离脂肪酸增加。
[1] AKIRA S, JUNKO S, DAISUKE F, et al. RS4-type resistant starch prevents high-fat diet-induced obesity via increased hepatic fatty acid oxidation and decreased postprandial GIP in C57BL/6J mice[J]. Endocrinology and Metabolism, 2010, 298(3): 652-662.
[2] 李瑞文, 林亚秋, 郑玉才, 等. 齐口裂腹鱼PGC-1α基因编码区的克隆及其在肌肉组织中的表达[J]. 生物技术通讯, 2013, 24(1): 72-75.
[3] 王宏伟, 邬应龙. RS4 型抗性淀粉对高脂诱导肥胖小鼠脂质代谢相关基因表达的影响[J]. 食品科学, 2013, 34(24): 128-146.
[4] 王文婷, 邬应龙. RS4 型抗性淀粉对高脂饮食C57BL/6J小鼠肠绒毛形态及肠道菌群的影响[J]. 食品科学, 2013, 34(22): 143-162.
[5] 王欣, 邬应龙. RS4型抗性淀粉对高脂饮食C57BL/6J小鼠炎症因子的影响[J]. 食品科学, 2013, 34(17): 134-156.
[6] GODA T, URAKAWA T, WATANABE M, et al. Effect of highamylose starch on carbohydrate digestive capability and lipogenesis in epididymal adipose tissue and liver of rats[J]. The Journal of Nutritional Biochemistry, 1994, 8(5): 256-260.
[7] HARUHIDE U, CHIKA K, TATSUAKI S, et al. Increase of serum cholesterol levels by heat-moisture-treated high-amylose cornstarch in rats fed a high-cholesterol diet[J]. Lipids, 2008, 43(2): 695-702.
[8] HARUHIDE U, CHIKA K, TATSUAKI S, et al. Serum cholesteroldecreasing effect of heat-moisture-treated high-amylose cornstarch in cholesterol-loaded rats[J]. Bioscience Biotechnology Biochemmistry, 2008, 72(3): 880-884.
[9] TAKANORI T, FUMIHIKO H, KOJI U. Dietary cyaniding 3-O-β-D-glucoside-rich purple corn color prevents obesity and ameliorates hyperglycemia in mice[J]. American Society for Nutritional Sciences, 2003, 25(7): 2125-2130.
[10] HARA H, HAGA S. Short-chain fatty acids suppress cholesterol synthesis in rat liver and intestine[J]. Journal of Nutrition, 1999, 129(7): 942-948.
[11] 王步枢, 邬应龙. 柠檬酸甘薯淀粉酯制备工艺优化及性质研究[J].食品科学, 2012, 33(24): 86-91.
[12] NRC (National Research Council), Nutrient Requirement of Fish[S]. Washington, DC: National Academy Press, 1993: 128.
[13] 段彪, 向枭, 周兴华, 等. 齐口裂腹鱼饲料中适宜脂肪需要量的研究[J].动物营养学报, 2007, 23(3): 232-236.
[14] PFAFFL M W. A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Research, 2001, 29(9): 41-45.
[15] CHOI S Y, GOLDBERG I J, CURTISS L K, et al. Interaction between ApoB and hepatic lipase mediates the uptake of ApoB-containing lipoproteins[J]. Blological Chemistry, 1998, 273(32): 20456-20462.
[16] AUWERX J, LEROY P, SCHOONJANS K. Lipoprotein lipase: recent contributions from molecular biology[J]. Critical Reviews in Clinlical Laboratory Sciences, 1992, 29(12): 243-268.
[17] LIU Xiong, HIROSHI O, TARO K, et al. Hypolipidaemic effect of maize starch with different amylose content in ovariectomized rats depends on intake amount of resistant starch[J]. British Journal of Nutrition, 2009, 101(5): 328-339.
[18] KIM W K, CHUNG M K, KANG N E, et al. Effect of resistant starch from corn or rice on glucose control, colonic events and blood lipid concentrations in streptozotocin-induced diabetic rats[J]. Journal of Nutritional Biochemistry, 2003, 9(14): 166-172.
[19] PUIGSERVER P, SPIEGELMAN B M. Peroxisome proliferatoractivated receptor-gamma coactivator-alpha(PGC-1alpha): transcriptional coactivator and metabolic regulator[J]. Endocrine Reviews, 2003, 24(1): 78-90.
[20] 李伟文, 陆松敏. 过氧化物酶体增殖物激活受体C共激活因子-1的研究进展[J]. 国外医学: 临床生物化学与检验学分册, 2005, 26(1): 21-22.
Effect of RS4-Type Resistant Starch on Lipid Metabolism-Related Enzymes and Gene Expression in Schizothorax prenanti Tchang
XIANG Shi-qiong, WU Ying-long*, FENG Jiao
(College of Food Science, Sichuan Agricultural University, Ya’an 625014, China)
Objective: To explore the effect of RS4-type resistant starch on the lipid metabolism-related enzymes and mRNA expression in Schizothorax prenanti Tchang. Methods: Schizothorax prenanti Tchang of approximately 75 g body weight were randomly divided into five groups. After 60 days of feeding, the activities of lipoprotei n lipase (LPL) and hepatic lipase (HL) and free fatty acid (FFA) content were determined by copper reagent method. The mRNA expression levels of PPARγ and PGC-1α in muscle and liver were determined by RT-PCR. Results: RS4-type resistant starch at a dos age of 7% or more could significantly improve the activities of liver LPL and HL in Schizothorax prenanti Tchang, increase free fatty acid content in the serum and liver (P < 0.05); while, RS4-type resistant starch at a dosage of 3.5% had no effect on the activities of LPL and HL or free fatty acid content (P > 0.05). In addition, the mRNA expression levels of muscle and liver PPARγ and PGC-1α in the groups administered with RS4-typ e resistant starch at dosages of 7% and 14% were significantly higher than those in the control group (P < 0.05). Conclusion: Dietary supplementation of RS4-type resistant starch at an appropriate amount could increase the expression of lipid metabolism-related genes in muscle and liver, improve the activities of lipid metabolismrelated enzymes, and promote the breakdown of triglycerides in Schizothorax prenanti Tchang.
RS4-type resistant starch; Schizothorax prenanti Tchang; real-time PCR (RT-PCR); peroxisome proliferators activated receptors-γ (PPARγ); peroxisome proliferators activated receptor γ coactivator-1α (PGC-1α)
TS254.2
A
1002-6630(2014)11-0229-06
10.7506/spkx1002-6630-201411046
2013-09-22
四川省科技支撑计划项目(2009NZ0077-007);四川农业大学“211”工程双支计划项目(2010)
向世琼(1989—),女,硕士研究生,研究方向为功能性食品。E-mail:xiangshiqiong@163.com
*通信作者:邬应龙(1963—),男,教授,博士,研究方向为功能性食品。E-mail:wuyinglong99@163.com
