天冬氨酸激酶突变体G277K中AK基因的克隆表达及酶学性质表征
2014-01-18闵伟红詹冬玲李慧颖朱运明
任 军,闵伟红*,詹冬玲,方 丽,李慧颖,朱运明
(吉林农业大学食品科学与工程学院,小麦和玉米深加工国家工程实验室,吉林 长春 130118)
天冬氨酸激酶突变体G277K中AK基因的克隆表达及酶学性质表征
任 军,闵伟红*,詹冬玲,方 丽,李慧颖,朱运明
(吉林农业大学食品科学与工程学院,小麦和玉米深加工国家工程实验室,吉林 长春 130118)
通过序列比对和晶体结构分析发现,天冬氨酸激酶(aspartokinase,AK)的G277位点高度保守,并与抑制剂Thr通过氢键相连,对其进行定点突变和酶学性质表征。结果表明:突变体G277K的AK最适反应条件是30 ℃、pH 8.5;动力学实验结果显示突变体AK的正协同效应降低,趋向于米氏酶,参数S0.5、nH、酶比活力、Vmax分别是7.05 mmol/L,1.24、964.3 U/mg、32.143U/(mg·min);热稳定性实验显示,其30 ℃半衰期为2.3 h,3 h后酶活力丧失80%左右;Ni2+在低浓度时表现出显著的激活效应;有机溶剂丙三醇、异丙醇和二甲基亚砜的体积分数为1%时,对AK的酶活力有很好的激活作用,表明突变体AK对一些有机溶剂有一定的抗性;低浓度的赖氨酸和蛋氨酸对AK有激活作用。
天冬氨酸激酶;克隆表达;定点突变;酶学性质
天冬氨酸激酶(aspartokinase,AK)广泛存在于细菌、植物和真菌中,例如Corynebacterium glutamicum[1]、Brevibacterium crenatum[2]和Corynebacterium f avum。AK是合成苏氨酸、赖氨酸、蛋氨酸、异亮氨酸途径中的关键酶,并且是第一个关键酶,催化合成这4种必需氨基酸的第一步反应[3]。AK仅存在于微生物和植物中,而在动物和人体内不存在,所以动物和人类必须从食物中获取天冬氨酸合成途径的必需氨基酸。在生物合成过程中,该酶受到支路产物的反馈调节,尤其是苏氨酸和赖氨酸反馈抑制以及协同反馈抑制[4]。大肠杆菌(E. coli)中存在3种AK异构酶形式,AK1、AK2和AK3。AK1和AK3是两种别构酶,主要影响苏氨酸和赖氨酸的生产,两者的别构抑制剂分别是苏氨酸[5]和赖氨酸[6-7]。如果对AK基因进行深入研究,改变天冬氨酸合成途径中氨基酸的代谢调控,会对这些氨基酸的合成具有很大的实用价值和理论意义。因此,天冬氨酸途径中关键酶AK引起了人们的广泛关注[8-9]。
AK是四聚体结构,由两个α亚基和两个β亚基构成,形成α2β2四聚体结构。α亚基包含两个结构域,即N末端催化结构域和C末端调控结构域。β亚基与α亚基调控结构域相同[10],由两个ACT结构域基序组成,以βαββαβ折叠结构存在。ACT结构域是许多别构酶的别构剂结合位点[11],目前已知ACT结构域含有两个苏氨酸结合位点,一个赖氨酸结合位点。Moir 等[11]已经总结出了α亚基与AK的催化活性和调控功能有关,而β亚基对AK稳定性起重要作用。本实验的研究目标是北京棒杆菌E31中的AK。目前结构已知并与其同源性最高的是来自谷氨酸棒杆菌的AK(PDB ID:3aaw),其结构也是由两个α亚基和两个β亚基组成α2β2四聚体。为了提高AK蛋白的酶活性,利用生物信息学确定影响天冬氨酸激酶活性中心和抑制剂的7个作用位点。根据谷氨酸棒杆菌的三维晶体结构图3aaw找到了与这7个位点通过氢键相连的氨基酸,将不同菌株中AK的氨基酸序列进行同源性比对,如图1所示,G277位点具有高度的保守性。由3aaw晶体结构解析(图2)可知,C链抑制剂位点Thr501通过氢键与几个氨基酸位点相连,其中包括高度保守的氨基酸突变位点Gly(G) 277。
本实验采用定点突变技术,对G277位点进行突变,得到突变株G277K,然后对其AK进行酶动力学及酶学性质表征[12-13],试图阐明AK的调节机制,解除末端产物对AK的反馈抑制,为天冬氨酸族氨基酸基因工程菌的构建提供参考。

图1 AK的多重序列比对Fig.1 Multiple sequence alignment of AK
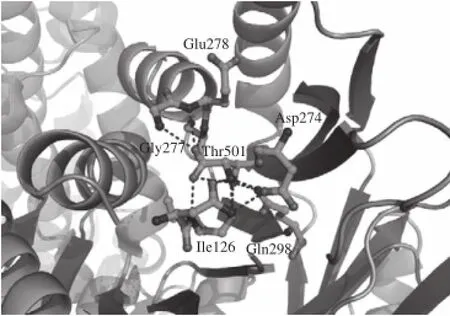
图2 AK抑制剂Thr的结合位点Fig.2 Inhibitor Thr binding site of AK
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 菌种与质粒
北京棒杆菌E31由本课题组保存,其天冬氨酸激酶基因连接在pET-28a质粒上,保存于克隆宿主E. coli DH5α和表达宿主E. coli BL21(DE3)中。
1.1.2 试剂与培养基
核酸和蛋白电泳Marker、Taq聚合酶及定点突变试剂盒 日本TaKaRa公司;DpnⅠ酶 生工生物工程(上海)有限公司;异丙基硫代-β-D-半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)、卡那霉素 北京鼎国生物公司;质粒抽提试剂盒 北京天泽恩公司;丙烯酰胺、甲叉双丙烯酰胺、Tris、过硫酸钠、硫酸卡那霉素、β-巯基乙醇 美国Genview公司;PVDF膜 美国Bio-Rad公司。
LB培养基参照文献[14]配制;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)蛋白电泳试剂的配制参照文献[15]配制。
1.1.3 仪器与设备
UV1700紫外-可见分光光度计 日本岛津公司;高速冷冻离心机 德国HermLe公司;蛋白质电泳装置美国GE公司;PCR仪 Eppendorff中国有限公司;高压蒸汽灭菌器 日本ALP公司。
1.2 方法
1.2.1 突变体的克隆表达
将北京棒杆菌E31中AK基因在大肠杆菌BL21中表达。提取重组质粒,以其为模板进行定点突变PCR扩增。引物由生工生物工程(上海)有限公司合成,上下游引物分别是5’-GGAAAACCTTCGCAGCCTCTTTTGGC TTATCGG-3’和5’-CTGGGTATTTCCGATAAGCCAAAAG AGGCTGCG-3’。其中下划线为引入的突变位点,将277号氨基酸位点的不带电荷的中性氨基酸G突变成带正电荷的碱性氨基酸K。将PCR产物进行消化,转化到BL21(DE3)感受态细胞中,平板培养。将平板中的单克隆接种于试管中,37 ℃、180 r/min摇床过夜培养。将过夜培养的菌液送生工生物工程(上海)有限公司测序。 取测序成功后的突变菌株在37 ℃、200 r/min,摇床培养1.5~2 h,待菌液OD540nm值到达0.6~0.8时加入IPTG进行诱导表达。对诱导剂浓度、诱导温度、诱导转速、诱导时间进行优化,对不同的诱导剂浓度(0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8 mmol/L)、不同的诱导温度(26、28、30、32、34、36、38、40、42 ℃)、不同的诱导转速(110、120、130、140、150、160、170、180、190 r/min)、不同的诱导时间(3、4、5、6、7、8、9、10、11 h)分别进行单因素试验,筛选出最佳诱导条件。
1.2.2 突变体AK的分离纯化及鉴定
将诱导后的发酵液于4 ℃、8 000 r/min离心10 min,弃去上清液。加入预冷的pH 7.4磷酸盐缓冲液冲洗、重悬。充分混匀后,于4 ℃中进行超声波破碎,将上清液过0.45 μm膜,滤液为含AK蛋白的粗酶液。将所得AK蛋白粗酶液通过非变性镍柱进行分离纯化,先后用20mmol/L咪唑20 mL、40 mmol/L咪唑15 mL、70 mmol/L咪唑10 mL、100 mmol/L咪唑5 mL以及200 mmol/L咪唑3 mL洗脱除去杂质蛋白质,用500 mmol/L咪唑10 mL洗脱得到纯化后AK蛋白。将500 mmol/L咪唑洗脱下的酶液透析,聚乙二醇浓缩,进一步纯化,SDS-PAGE和蛋白印迹(Western blotting)进行验证。
1.2.3 SDS-PAGE和Western blotting
纯化后AK蛋白采用SDS-PAGE验证;将含有目的蛋白AK的SDS-PAGE切下,15V稳压电转1h至PVDF膜上,2%~5%脱脂奶粉封闭,经HRP Mouse Anti-6xHis(用TBS按1∶2500稀释)孵化2h,DAB显色7~10min。
1.2.4 AK酶活力测定
利用分光光度计检测天冬氨酸异羟肟酸在540 nm波长处的吸光度来测定AK的活性[16-18]。1 mL反应体系:10 mmol/L底物L-天冬氨酸,10.4 mmol/L ATP,10 mmol/L β-巯基乙醇,100 mmol/L Tris-HCl缓冲液 (pH 8.5),1.6 mmol/L MgSO4,800 mmol/L NH4OH和800 mmol/L KCl。反应体系中加入纯化后的AK蛋白至总体积1 mL,于30 ℃下反应30 min,加入1 mL FeCl3终止试剂,离心5 min除去蛋白质杂质,取上清液测其OD540nm值。以不加底物天冬氨酸作为对照,所测得OD540nm即为天冬氨酸异羟肟酸离子的光密度,酶活力表示为1 000×OD540nm值。反应速率V定义为单位时间(1 min)内单位质量酶的催化能力,单位表示为U/(mg·min)。酶液中AK蛋白质含量的测定采用考马斯亮蓝法。
1.2.5 AK动力学检测
AK动力学检测以L-天冬氨酸为底物,Tris-HCl(pH 8.5)为缓冲液,在30 ℃测定0.5~16.0 mmol/L底物浓度范围内的酶活力,每次3 个平行实验。以Hill方程V=Vmax[S]n/(K+[S]n)进行非线性拟合。
1.2.6 最适反应温度与pH值
大多数微生物中的AK都是一种偏碱性酶,因此AK最适pH值的测定是以天冬氨酸为底物,在pH值6.5~10.0范围内的100 mmol/L Tris-HCl缓冲液中进行酶活力检测。AK最适反应温度的测定是以天冬氨酸为底物,在不同反应温度下(15、20、25、28、30、35、40、45、50 ℃ )反应30 min,然后测定OD540nm值。酶活力测定方法同1.2.4节,每次都做3 个平行实验。
1.2.7 热稳定性
在最适温度条件下,将纯化后的AK蛋白溶液装入离心管中,以石蜡油封顶置于水浴锅中,每隔1 h取样测定其AK酶活力,测定方法同1.2.4节,每次都做3 个平行实验。在最适反应温度下,将AK蛋白水浴0 h测得的数据定义为100%。
1.2.8 金属离子与有机溶剂对酶活力的影响
金属离子对AK酶活力的影响是通过在反应体系中添加不同浓度(0.2、1.0、5.0、10.0mmol/L),不同种类金属离子[19](Na+、K+、Ca2+、Mg2+、Zn2+、Mn2+、Cu2+、Fe3+、Ni2+),其他条件均与酶活力测定方法一致,观察对AK酶活力的影响,每次都做3个平行实验。将没有添加任何金属离子的酶活力定义为100%。
有机溶剂对AK酶活力的影响是通过在反应体系中添加不同体积分数(1%、5%、10%、20%),不同种类的有机溶剂(甲醇、乙醇、丙三醇、异丙醇、乙腈、正丁醇、二甲基亚砜),其他条件均与酶活力测定方法一致,观察其对AK酶活力的影响,每次都做3个平行实验。将没有添加任何有机溶剂的酶活力定义为100%。
1.2.9 底物抑制剂对酶活力的影响
抑制剂对AK酶活力的影响是通过在反应体系中添加不同浓度(0.2、1.0、5.0、10.0mmol/L),不同种类的底物抑制剂(蛋氨酸(Methionine,Met),赖氨酸(Lysine,Lys),苏氨酸(Threonine,Thr),Thr+Met、Lys+Met、Lys+Thr、Lys+Thr+Met),其他条件均与酶活力测定方法一致,观察其对AK酶活力的影响,每次都做3个平行实验。将没有添加抑制剂的酶活力定义为100%。
2 结果与分析
2.1 突变体AK基因的克隆与表达
将突变后的PCR产物进行电泳检验结果如图3所示,突变体和野生型AK的核酸序列大小均在1.3kb左右,与汪一名等[20]所报道的结果相符。核酸序列经生工生物工程(上海)有限公司测序,筛选定点突变成功的菌株,得到突变体G277K。
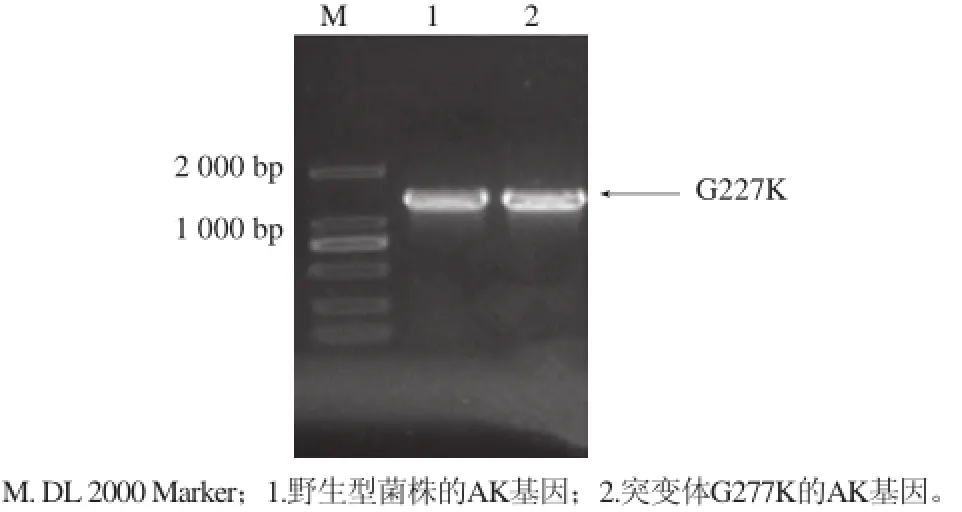
图3 野生型和突变体的1%琼脂糖凝胶电泳Fig.3 1% agarose gel electrophoresis of wild-type and mutant G277K
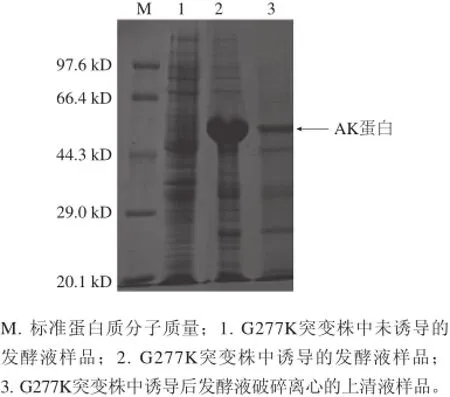
图4 10%SDS-PAGE蛋白电泳图Fig.4 10% SDS-PAGE of AK protein from G277K
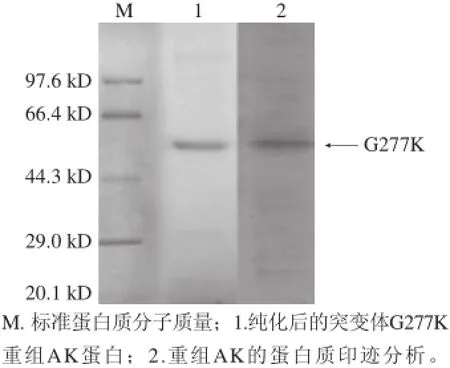
图5 突变体G277K分离纯化后AK的蛋白电泳及蛋白印迹图Fig.5 10% SDS-PAGE and western blotting of purified AK protein from mutant G277K
对诱导剂浓度、诱导温度、诱导转速、诱导时间进行优化,筛选出最佳的诱导条件,分别为:1mmol/L IPTG、30℃、130r/min、8h。对诱导前后发酵液的菌液及破碎后的上清液分别做10% SDS-PAGE蛋白电泳,如图4所示,其发酵液经过诱导后比未诱导的多了一条很明显的粗带。经过细胞破碎离心过滤后,得到了破碎离心上清液样品,在相应位置也得到了比较亮的条带,但上清液中也明显的显示了杂蛋白的条带。通过对上清液进行非变性镍柱分离纯化,将纯化后AK蛋白溶液进行SDSPAGE变性蛋白电泳和Western blotting。如图5所示,在同样的分子大小位置出现了单一的目标蛋白,其分子质量大约为48kD。这与Follettie等[18]所报道的结果一致。Western blotting结果显示,在48kD同样出现了一条单带,这说明突变后的AK蛋白表达成功。200mL的野生型发酵液分离纯化出AK蛋白3.37mg,纯度在90%以上,测得的酶比活力为91.99U/mg,总的纯化效率是纯化前11.09倍。突变株G277K的酶比活力较野生型有所提高,提高了9.48倍,为964.3U/mg。
2.2 突变体的动力学
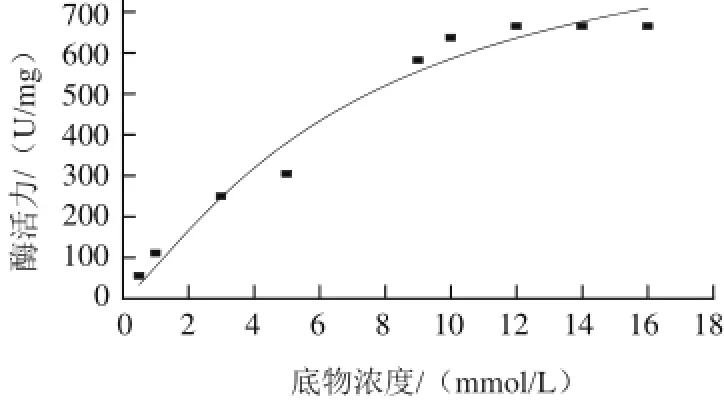
图6 突变体G277K的酶动力学曲线Fig.6 Steady-state kinetic curve of mutant G277K
通过Origin75软件,将得出的突变体G277K动力学数据进行动力学曲线拟合,结果如图6所示。野生型AK动力学曲线拟合符合Hill方程,天冬氨酸激酶含有四聚体结构,是典型的别构酶[5-7]。对野生型AK而言,nH为3.49、Km为4.42mmol/L、Vmax为3.066U/(mg·min),具有明显的正协同效应;结合lg(V/(Vm-V))对lgS可知,突变体G277K的Vmax是32.143U/(mg·min),比Maximillian等[18]报道的最大值24.4U/(mg·min)要高。酶比活力为964.3U/mg,nH为1.24,Km为7.05mmol/L。突变体G277K的正协同效应降低,趋向于米氏酶,而活力提高了9.48倍。这可能是277位点的G由不带电荷的中性氨基酸突变成带正电荷的碱性氨基酸K后,使其在一定程度上破坏了与抑制剂Lys间的非共价键作用,导致AK亚基间聚合度降低,结构松散,抑制剂结合位点变得松散不稳定,从而不利于抑制剂的结合。
2.3 突变体的酶学性质表征
2.3.1 突变体AK的最适反应pH值和最适反应温度

图7 突变体G277K中AK的最适pH值曲线Fig.7 Optimum pH curve of AK from G277K
由图7可知,突变体G277K中AK是偏碱性酶,其最适pH值为8.5。在pH值6.0~8.5范围内,突变体AK酶活力随pH值的升高而增强,当高于pH8.5后,酶活性随着pH值的升高反而下降。野生型的最适pH值为8.0,可能是因为G277位点对AK活性中心亲核残基催化进攻的质子传递有影响。
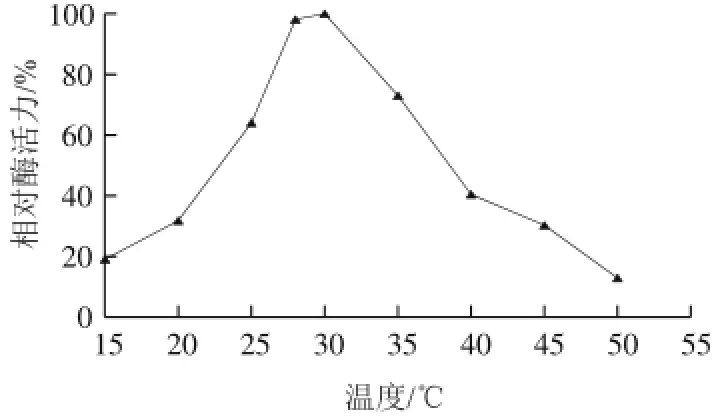
图8 突变体G277K中AK的最适反应温度曲线Fig.8 Optimum temperature curve of AK from G277K
由图8可知,G277K中AK的最适反应温度为30 ℃。在15~30 ℃范围内,突变体酶的催化活性随着温度的升高而增高,当高于30 ℃后,随着温度的升高酶活力下降。野生型中AK的最适温度为26 ℃,突变体最适反应温度提高,可能是因为此位点影响酶的空间构象,因而最适反应温度提高。
2.3.2 野生型及突变体中AK的热稳定性
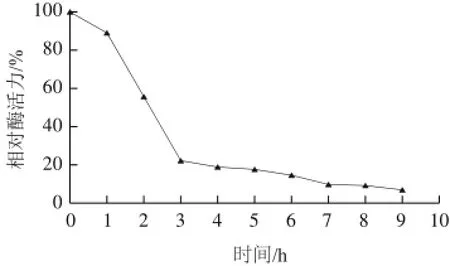
图9 突变体G277K中AK的热稳定性曲线Fig.9 Thermal stability curve of mutant G277K
由图9可知,突变体G277K中AK的热稳定良好,其半衰期为2.3h,比野生型的4h要低。这可能是因为突变体酶亚基间的聚合度减弱,因而热稳定性降低。3h后突变体G277K的AK酶活力已经丧失了80%左右。
2.3.3 金属离子对AK酶活力的影响
多数金属离子都会影响酶活性[21]。在使用与测酶活力相同的Cl-和SO42-作为阴离子的条件下,通过添加不同浓度、不同种类的金属离子来检测金属离子对突变体中AK酶活力的影响,结果如表1所示。

表1 金属离子对突变体G277K中AK酶活力的影响Table1 Effect of metal ions on the enzymatic activity of AK from mutant G227777KK
由表1可知,对突变体G277K而言,一价金属离子Na+对酶活力无激活作用,而是显示出了抑制作用。K+在0.2mmol/L时对酶有激活效应,而浓度增加显示出抑制效应;二价金属离子Ni2+在低浓度时表现出显著的激活效应,当浓度增大时呈现出明显的抑制作用。低浓度的Mg2+和Cu2+对酶活力起到了一定的抑制作用,但是高浓度时酶活力得到了增强,表现出了激活作用,当Mg2+和Cu2+的浓度为10mmol/L时,其相对酶活力分别为131.63%和138.86%。而Ca2+、Zn2+、Mn2+、Fe3+对酶活力都起到了抑制作用。这些低浓度的金属离子对突变体AK酶产生的激活作用可能是由于277号位点氨基酸的电荷和极性的改变而引起了活性中心位点与金属离子结合的难易程度,从而对催化活性中心位点产生不同的激活或者抑制效应。
2.3.4 有机溶剂对AK酶活力的影响
到目前为止,有机溶剂对很多酶活力的影响机理尚未清楚[22]。为了研究突变后AK对有机溶剂的抗性,分别选取了不同体积分数的一元醇、二元醇以及三元醇对突变体AK酶活力的影响,尤其以检测二甲基亚砜来判断酶对有机溶剂的抗性影响是很多研究有机溶剂对酶活力的影响中用到的实验[22]。有机溶剂对突变体AK酶活力的影响结果如表2所示。大部分有机溶剂对G277K突变体酶活力有抑制作用。对突变体G277K而言,当丙三醇、异丙醇和二甲基亚砜的体积分数为1%时,对AK的酶活力有很好的激活作用,但是随着体积分数的增高都表现出了明显的抑制作用,且抑制程度随着体积含量的增高而加强。其相对酶活力分别由体积分数为1%时192.53%、114.30%和149.02%的激活效应转变成为体积分数为20%时17.22%、ND和36.12%的抑制效应。其余的有机溶剂对突变体G277K酶活力都有不同程度的抑制作用,其中甲醇和乙腈对AK的抑制作用随着有机溶剂体积分数的增大而增强,当甲醇和乙腈的体积分数为20%时,其相对酶活力分别为13.33%和21.12%。乙醇对G277K酶活力仍有很强的抑制作用。正丁醇对G277K酶活力也有一定的抑制作用,当其体积分数为10%时,酶活力反而增强,其相对酶活力达到了133.36%。结果显示突变体AK对不同体积分数的有机溶剂表现出不同的抗性。相比于野生型而言,对有机溶剂具有更高的抗性,从而减少了AK在有机溶剂中的失活率,在一定程度上,提高了其应用范围和存储环境。
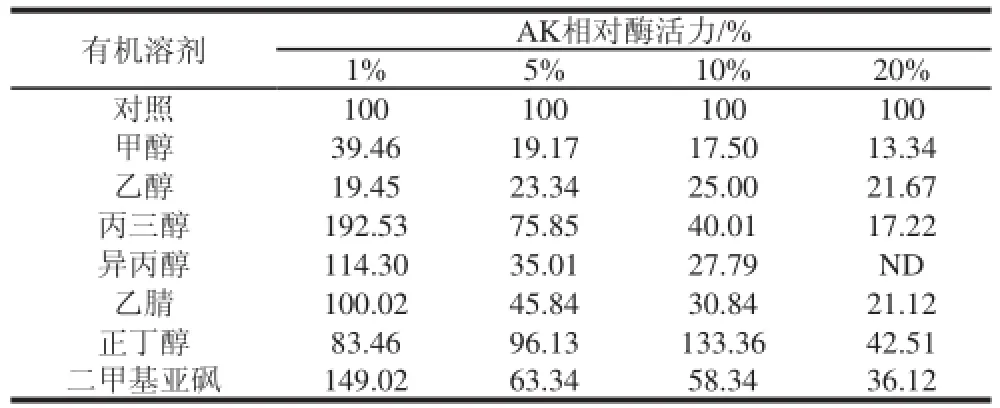
表2 有机溶剂对突变体G277K中AK酶活力的影响Table2 Effect of organic solvents on the enzymatic activity of AK from mutant G277K
2.3.5 底物抑制剂对AK酶活力的影响
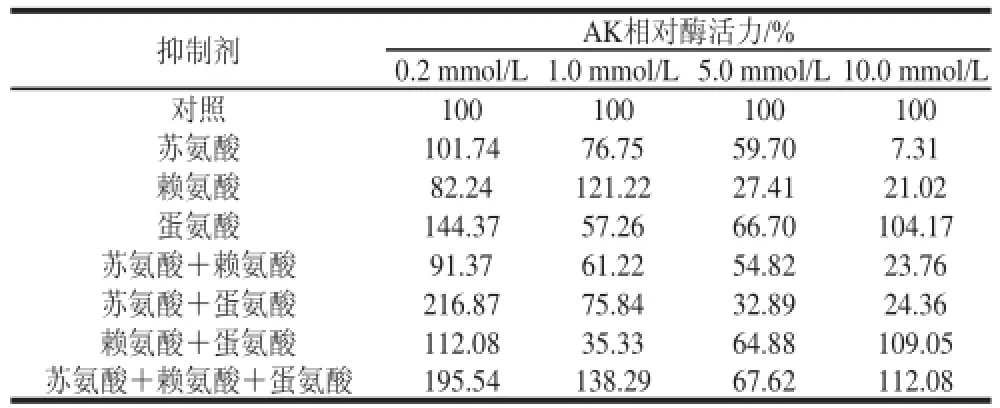
表3 底物抑制剂对突变体G277K中AK酶活力的影响Table3 Effect of inhibitors on the enzymatic activity of AK from mutant G227777KK
由表3可知,对突变体G277K而言,苏氨酸、赖氨酸和蛋氨酸对于AK的催化活性依然有很大的抑制作用。但是低浓度的赖氨酸和蛋氨酸对AK反而有激活作用。当赖氨酸的浓度为1mmol/L时,其相对酶活力为121.22%。当蛋氨酸的浓度为0.2mmol/L时,其相对酶活力为144.37%。并且在这些氨基酸的组合中,当浓度为0.2mmol/L时,含有蛋氨酸的组合都不同程度地促进了AK的酶活力,其中最大的是苏氨酸和蛋氨酸的组合,其相对酶活力达到了216.87%。
3 结 论
本实验对突变体G277K中天冬氨酸激酶进行基因克隆表达和酶学性质表征,结果显示:突变体G277K中AK趋向于米氏酶,动力学参数S0.5、nH和Vmax分别是7.05mmol/L、1.24和32.143U/(mg·min);突变体G277K的酶比活力是964.3U/mg,比野生型菌株提高了9.48倍。突变体酶的最适反应温度为30℃、最适pH值为8.5、半衰期为2.3h。对有机溶剂有一定的抗性,并且1%丙三醇、异丙醇和二甲基亚砜对G277K有很好的激活作用。低浓度的赖氨酸和蛋氨酸对G277K中AK的抑制作用消除,呈现出激活作用。这为更进一步构建高产苏氨酸、赖氨酸或蛋氨酸的工程菌提供理论基础。
[1] CREMER J, EGGELING L, SAHM H. Cloning the dapA dapB cluster of the lysine-secreting bacterium Corynebacterium glutamicum[J]. Molecular and General Genetics MGG, 1990, 220(3): 478-480.
[2] 刘阳剑, 张英姿, 王绛, 等. 钝齿棒杆菌天冬氨酸激酶基因的克隆和序列分析[J]. 微生物学报, 2002, 42(4): 395-399.
[3] BLACK S, WRIGHT N G. Intermediate steps in the biosynthesis of threonine[C]//A symposium on amino acid metabolism. Baltimore: Johns Hopkins Press, 1955: 591-599.
[4] KALINOWSHI J, BACHMANN B, THIERBACH G, et al. Aspartokinase genes lysCα and lysCβ overlap and are adjacent to the aspartate β-semialdehyde dehydrogenase gene asd Corynebacterium glutamicum[J]. Molecular and General Genetics MGG, 1990, 224(3): 317-324.
[5] BEARER C F, NEET K E. Threonine inhibition of the aspartokinasehomoserine dehydrogenase I of Escherichia coli. A slow transient and cooperativity of inhibition of the aspartokinase activity[J]. Biochemistry, 1978, 17(17): 3523-3530.
[6] KOTAKA M, REN J, LOCKYER M, et al. Structures of R- and T-state Escherichia coli Aspartokinase III mechanisms of the allosteric transition and inhibition by lysine[J]. Biological Chemistry, 2006, 281(42): 31544-31552.
[7] ZHANG W W, JIANG W H, ZHAO G P, et al. Expression in Escherichia coli, purification and kinetic analysis of the aspartokinase and aspartate semialdehyde dehydrogenase from the rifamycin SV-producing Amycolatopsis mediterranei U32[J]. Applied Microbiology and Biotechnology, 2000, 54(1): 52-58.
[8] 谭圣君, 邵友元, 李卫. 蛋氨酸的研究现状及其应用前景[J]. 湖北工业大学学报, 2006, 21(6): 66-71.
[9] DUMAS R, COBESSI D, ROBIN A Y, et al. The many faces of aspartate kina ses[J]. Archives of Biochemistry and Biophysics, 2012, 519(2): 186-193.
[10] YOSHIDA A, TOMITA T, KURIHARA T, et al. Structural insight into concerted inhibition of α2β2-type aspartate kinase from Corynebacterium glutamicum[J]. Journal of Molecular Biology, 2007, 368(2): 521-536.
[11] MOIR D, PAULUS H. Properties and subunit structure of aspartokinase ii from Bacillus subtilis VB217[J]. The Journal of Biological Chemistry,1977, 252(13): 4648-4651.
[12] 詹冬玲, 韩葳葳, 刘景圣. 角鲨烯合成酶抑制剂的高通量虚拟筛选[J].吉林大学学报: 理学版, 2012, 50(2): 361-364.
[13] 詹冬玲, 白挨玺, 白鹤. 嗜热菌Pyrococcus horikoshii OT3蛋白酶基因的原核表达、纯化和性质表征[J]. 吉林大学学报: 理学版, 2010, 48(6): 1035-1069.
[14] 萨姆布鲁克 J, 弗里奇 E F, 曼尼阿蒂斯 T. 分子克隆实验指南[M].金冬雁, 黎孟枫, 侯云德, 译. 北京: 科学出版社, 1998.
[15] 汪家政, 范明. 蛋白质技术手册[M]. 北京: 科学出版社, 2000.
[16] 车东升, 刘飞飞, 穆成龙. 大豆凝集素的分离纯化及活性鉴定[J]. 吉林大学学报: 理学版, 2012, 50(5): 1041-1044.
[17] BLACK S, WRIGHT N G. β-aspartokinase and β-aspartyl phosphate[J]. The Journal of Biological Chemistry,1955, 213(1): 27-38.
[18] FOLLETTIE M T, PEOPLES O P, AGOROPOULOU C, et al. Gene structure and expression of the Corynebacterium f avum N13 ask-asd operon[J]. Journal of Bacteriology, 1993, 175(13): 4096-4103.
[19] YE Wei,LIU Jingwen,WANG Haiying, et al. Cloning, expression, purification and characterization of a glutamate-specific endopeptidase from Bacillus licheniformis[J]. Protein Expression and Purification, 2012, 82(1): 138-143.
[20] 汪一名. 北京棒杆菌突变株 E31 天冬氨酸激酶基因的克隆与表达分析[D]. 长春: 吉林农业大学, 2011.
[21] YAMADA M, KATO K, SHINDO K, et al. UV-irradiation-induced DNA immobilization and functional utilization of DNA on nonwoven cellulose fabric[J]. Biomaterials, 2001, 22(23): 3121-3126.
[22] WIGGERS H J, CHELESKI J, ZOTTIS A, et al. Effects of organic solvents on the enzyme activity of Trypanosoma cruzi glyceraldehyde-3-phosphate dehydrogenase in calorimetric assays[J]. Analytical Biochemistry, 2007, 370(1): 107-114.
Gene Cloning, Expression and Enzymatic Characterization of Aspartokinase Mutant G277K
REN Jun, MIN Wei-hong*, ZHAN Dong-ling, FANG Li, LI Hui-ying, ZHU Yun-ming
(National Engineering Laboratory on Wheat and Corn Further Processing, College of Food Science and Engineering, Jilin Agricultural University, Changchun 130118, China)
Aspartokinase (AK), a crucial enzyme used in the industrial production of amino acids, is a rate-limiting enzyme in the biosynthesis of amino acids of the aspartate family, in which AK is strictly regulated by the feedback of these amino acids. This study aimed to relieve the metabolic regulation and to create genetically engineered strains that have a high production of those amino acids. By using the substrate docking and virtual screening, we found the highly conserved mutation sites of Gly (G) 277 which were bound with Thr501 inhibitory site by hydrogen bonds. The results showed that the optimal pH, temperature and half-life of the mutant enzyme were 8.5, 30℃ and 2.3 h, respectively. Steady-state kinetic study showed that the positive synergistic effect was reduced, and tended to become a Michaelis enzyme. The parameters S0.5, nH, specific activity and Vmaxwere 7.05 mmol/L, 1.24, 964.3 U/mg and 32.143 U/(mg·min), respectively. Ni2+showed significant activation effect at low concentrations. The AK enzyme activity was activated when glycerol, isopropanol or dimethyl sulfoxide was present at a level of 1% by volume, suggesting the resistance of the mutant enzyme to these organic solvents. Lysine and methionine at low concentrations were also able to activate the enzyme activity.
aspartokinase (AK); cloning and expression; site-directed mutation; enzymatic properties
Q814.9
A
1002-6630(2014)11-0149-06
10.7506/spkx1002-6630-201411030
2013-05-28
吉林省自然科学基金项目(20130101139JC)
任军(1988—),男,硕士研究生,研究方向为发酵微生物的选育与代谢调控。E-mail:renjun881022@163.com
*通信作者:闵伟红(1971—),女,教授,博士,研究方向为发酵工程、粮食科学与深加工技术。E-mail:minwh2000@163.com
