甘油半乳糖苷的分离纯化及鉴定
2014-01-18齐丹萍吕凤霞别小妹陆兆新赵海珍
魏 微,齐丹萍,马 荣,张 充,吕凤霞,别小妹,陆兆新,赵海珍*
(南京农业大学食品科技学院,江苏 南京 210095)
甘油半乳糖苷的分离纯化及鉴定
魏 微,齐丹萍,马 荣,张 充,吕凤霞,别小妹,陆兆新,赵海珍*
(南京农业大学食品科技学院,江苏 南京 210095)
以半乳糖和甘油为原料,β-半乳糖苷酶为催化剂,制备甘油半乳糖苷。采用活性炭吸附法对其分离纯化,采用L9(34)正交试验对分离纯化的工艺条件进行优化筛选,进一步用G-15色谱柱纯化,以获得高纯度的甘油半乳糖苷。结果表明:活性炭吸附法分离纯化甘油半乳糖苷的最佳工艺条件为反应液稀释倍数20、活性炭用量2 g/mL、洗脱剂乙醇体积分数30%,甘油半乳糖苷的回收率和纯度分别为62.53%和48.84%,分别比单因素试验结果高4.52%和4.76%;经G-15柱色谱进一步纯化,甘油半乳糖苷的纯度达到97.80%;经质谱鉴定合成产物为甘油单半乳糖苷。
甘油半乳糖苷;分离纯化;正交试验;活性炭吸附
甘油半乳糖苷是一种天然的糖苷,具有良好的保湿效果,可以提高细胞抗冻或耐热作用,有研究报道其还具有抗肿瘤活性[1]。以甘油半乳 糖苷为中间体可以合成可生物降解的功能性物质甘油糖酯[2]。甘油半乳糖苷及其酯在食品、化妆品、保健品甚至抗肿瘤药物 中都有令人关注的用途[3-7],一些研究还表明甘油糖酯具有抗菌活性[8-9]。最近几年,有关半乳糖甘油糖酯的研究报道很多,但其分离提取获得的样品非常有限,纯度也无法满足研究需求,因此,人工合成甘油糖酯是必需的。然而,合成甘油糖酯需要以甘油糖苷作为中间体。我们在前期通过半乳糖苷酶催化的甘油与半乳糖的逆向水解合成了甘油半乳糖苷[10],但在最终的合成反应体系中存在大量的甘油等副产物,如何有效除去这些副产物是获得高纯度甘油糖苷的关键。多元醇糖苷的提纯主要有溶剂萃取法、分子蒸馏法、柱层析法和活性炭吸附法[11-13]。溶剂萃取法虽然可以去除其中的甘油,但去除效果比较差,且要用大量的有机溶剂。活性炭吸附法也可以去除产物中的甘油等,但不能实现完全分离。本实验尝试以活性炭法纯化甘油半乳糖苷,采用正交试验对其纯化工艺进行优化,并进一步通过柱层析分离纯化,以获得高纯度的甘油半乳糖苷,为甘油半乳糖苷的制备及其酯类物质的合成提供参考。
1 材料与方法
1.1 材料与试剂
β-半乳糖苷酶(来自Kluyveromyces lactis,20 U/μL酶液)美国Sigma-Aldrich公司;D-半乳糖(纯度>99%)阿拉丁试剂公司;甘油(纯度>99%)、活性炭、乙醇、正丁醇 国药集团化学试剂有限公司。
1.2 仪器与设备
恒温水浴振荡摇床 太仓市实验设备厂;Heidolph旋转蒸发器 上海沪西分析仪器厂有限公司;收集器上海沪西公司;Ultimate-3000高效液相色谱 美国戴安公司;Shodex KS-801(8.0 mm ×300 mm)色谱柱和Shodex RI-101检测器 日本Shodex公司。
1.3 方法
1.3.1 甘油半乳糖苷的合成
在50 mL锥形瓶中加入1.8 g半乳糖和4.5 g甘油(二者浓度比为1∶10),加入4 mL含有0.01 mol/L MgCl2的磷酸盐缓冲液(pH 6.5),密封。将三角瓶放入恒温摇床中预热30 min(40 ℃),加入150 μL(3 000 U)半乳糖苷酶,在40 ℃、180 r/min的水浴中反应40 h。反应结束后,沸水浴3 min使酶失活,反应液过0.22 μm滤膜,滤液进行高效液相色谱(high performance liquid chromatography,HPLC)检测,外标法计算甘油半乳糖苷的含量。
1.3.2 甘油半乳糖苷的分离纯化
1.3.2.1 有机溶剂萃取法[14]
取甘油半乳糖苷反应液10 g,加入15 mL去离子水进行稀释,然后用饱和NaOH溶液中和至pH值在7~8之间,在甘油半乳糖苷反应液中加入一定比例的正丁醇和环己烷,混合均匀,静置分层,取下层液体,旋蒸浓缩,再用1 mL去离子水复溶,经过0.22 μm滤膜过滤,进行液相检测,计算甘油半乳糖苷回收率。
考察不同配比正丁醇、环己烷、水体混合液(体积比3∶1∶1、2∶2∶1、1∶3∶1)对甘油半乳糖苷回收率的影响。
1.3.2.2 活性炭吸附法
取甘油半乳糖苷反应液于锥形瓶中,加入一定量的去离子水进行稀释,按一定的比例加入活性炭,密封振荡30 min后进行真空抽滤,弃去上清液,将吸附样品的活性炭用一定浓度的乙醇洗脱剂进行洗脱,密封振荡30 min,再进行真空抽滤,取上清液旋蒸浓缩,后用1 mL去离子水进行复溶,经过0.22 μm的滤膜过滤,进行液相检测,计算甘油半乳糖苷回收率。

活性炭用量为1 g/mL、洗脱剂乙醇体积分数为50%的条件下,考察不同反应液稀释倍数(10、15、20、25、30)对甘油半乳糖苷回收率的影响;洗脱剂乙醇体积分数为50%、反应液稀释倍数为20的条件下,考察活性炭用量(按反应液体积的比例添加,0.5、1.0、1.5、2.0、 2.5 g/mL)对甘油半乳糖苷回收率的影响;反应液稀释倍数为20、活性炭用量为1.5 g/mL的条件下,考察洗脱剂乙醇体积分数(30%、40%、50%、60%、70%)对甘油半乳糖苷回收率的影响。
根据单因素试验结果,确定L9(34)正交试验表,以反应液稀释倍(A)、活性炭用量(B)和洗脱剂乙醇体积分数(C)作为3 个考察因素,选取3个水平进行试验。
1.3.3 葡聚糖G-15柱层析分离
将经过活性炭吸附法分离纯化后的甘油半乳糖苷,采用葡聚糖G-15层析柱(100 cm×1.6 cm)进一步纯化,以去离子水作为流动相,流速为0.6 mL/min,每管收集2 mL,上样量为2 mL,弃去前60 mL后开始收集,共收集60 管。将收集到的样品合并后用高效液相色谱检测,并进一步进行质谱分析。
1.3.4 液相检测
HPLC系统(美国Dionex公司)配备RI检测器,色谱柱为Shodex SUGAR系列KS-801色谱柱(8 mm×300 mm),RI检测器槽温保持在35 ℃,以去离子水作为流动相,流速保持在0.75 mL/min,洗脱过程约15 min。
1.3.5 质谱分析
质谱条件:质谱仪器TSQ Quantum Discovery MAX(美国Thermo Finnigan公司)。离子方式为ESI-和ESI+,毛细管电压为4.4 kV,锥孔电压40 V,离子源温度 100 ℃,脱溶剂气温度250 ℃,光电倍增器电压700 V,气流量为400 L/h,扫描范围为100~1 500 m/z。
2 结果与分析
2.1 有机溶剂萃取法与活性炭吸附法比较
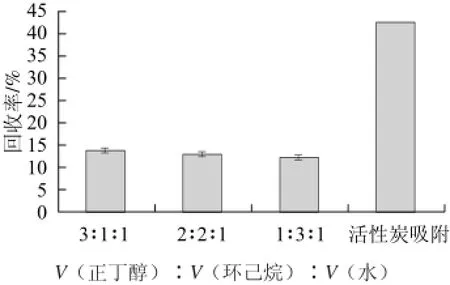
图1 溶剂萃取法和活性炭吸附法对甘油半乳糖苷分离纯化的影响Fig.1 Effects of solvent extraction and activated carbon absorption on the purification of glycerol galactoside
由图1可知,随着环己烷体积比例的减少,正丁醇体积比例的增加,甘油半乳糖苷的回收率逐渐增加,但增加的幅度不显著,整体的回收率很低,不到15%,萃取效果低可能是因为正丁醇、环己烷在萃取水中甘油的同时,将部分甘油半乳糖苷也萃取了,所以甘油半乳糖苷的回收率很低。将实验结果与卢炳环[14]的实验结果(乙二醇残留量17.4%)进行对比,发现其甘油半乳糖苷的纯度也不高,其原因可能是甘油的极性比乙二醇强,正丁醇、环己烷不能将水中的甘油完全萃取出来。
由于活性炭具有成本低、分离效果好、样品处理量大等特性,也常用于单糖、二糖及多糖的分离纯化[15-21]。实验表明,在活性炭吸附法中,当反应液稀释倍数为10,活性炭用量1 g/mL,洗脱剂乙醇体积分数为50%时,甘油半乳糖苷的回收率为42.58%。而有机溶剂萃取法得到甘油半乳糖苷回收率最高为13.87%,可见活性炭吸附法分离纯化甘油半乳糖苷的效果更好,故后续实验采用活性炭吸附法分离纯化甘油半乳糖苷,并对其工艺进一步优化。
2.2 活性炭吸附法优化单因素试验
2.2.1 反应液稀释倍数的影响
活性炭吸附是指目标物质在活性炭表面吸附或浓缩的过程。依靠分子间和分子内键与键之间作用的范德华力吸附过程称为物理吸附,吸附质在活性炭表面的极化率决定了物理吸附差异性。而样品浓度会一定程度上影响目标产物与活性炭接触之间的物理吸附作用[16]。

图2 反应液稀释倍数对甘油半乳糖苷纯化的影响Fig.2 Effect of dilution ratio of the reaction product on the purification of glycerol galactoside
由图2可知,随着反应液稀释倍数的增加,甘油半乳糖苷的回收率先增大后减少,说明稀释倍数过高或过低时,甘油半乳糖苷的回收率都会降低,原因是当稀释倍数过低时,反应液过于浓稠,活性炭不能充分的吸附甘油半乳糖苷,而且当活性炭吸附达到平衡后,受到活性炭孔径限制以及目标产物之间的静电排斥也会造成吸附量降低,造成部分甘油半乳糖苷随滤液流失;当稀释倍数过高时,即体系中存在过多的水,而活性炭为非极性吸附剂,其在水溶液中吸附性最强,因此对甘油半乳糖苷的吸附性强,这使得后续的乙醇洗脱过程活性炭上的残留量加大,反而造成产物回收率的降低[17]。当反应液稀释倍数为20 时,回收率最高。
2.2.2 活性炭用量的影响
由图3可知,随着活性炭用量的增大,甘油半乳糖苷的回收率先升高后降低,说明当活性炭的量过少或过多时,甘油半乳糖苷的回收率都会降低。因为当活性炭的用量过少时,不能将甘油半乳糖苷完全吸附,使得部分甘油半乳糖苷存在于抽滤后的滤液中随着滤液流失,从而降低了甘油半乳糖苷的回收率;当活性炭的量过多时,活性炭总的表面积增大,而溶液中目标产物的浓度是一定的,达到吸附平衡后,虽然甘油半乳糖苷能够被完全吸附,但在洗脱时并不是所有的甘油糖苷都能洗脱下来,故而残留在活性炭中的甘油半乳糖苷量增加,使得甘油半乳糖苷的回收率降低[19]。活性炭用量为1.5 g/mL时,回收率达到最大值。

图3 活性炭用量对甘油半乳糖苷回收率的影响Fig.3 Effect of activated carbon dosage on the purification of glycerol galactoside
2.2.3 洗脱剂乙醇体积分数对甘油半乳糖苷纯化的影响
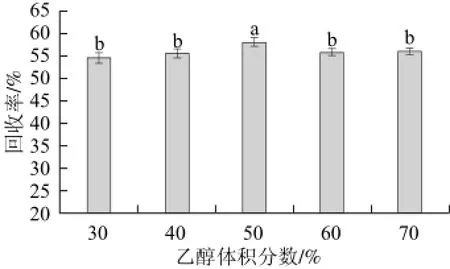
图4 洗脱剂乙醇体积分数对甘油半乳糖苷回收率的影响Fig.4 Effect of ethanol concentration on the purification of glycerol galactoside
由图4可知,随着洗脱剂中乙醇体积分数的增大,甘油半乳糖苷的回收率先升高后降低,说明当洗脱剂中乙醇体积分数过大或过小时,甘油半乳糖苷的回收率都会降低,其原因可能是活性炭为非极性吸附剂,其在水溶液中的吸附性最强,故水的洗脱效果最弱,而有机溶剂的洗脱效果较好,同时其对大分子甘油半乳糖苷的吸附力大于半乳糖、甘油等小分子。因此,随着乙醇体积分数的增加,洗脱效果也提高,但乙醇体积分数提高的同时,合成过程中产生的少量半乳糖基甘油二糖、甘油三糖以及低聚糖等杂质被洗脱下来的量也增加,导致目标产物的洗脱效果(纯度)降低[15]。当乙醇体积分数为50%时,甘油半乳糖苷的回收率达到最大值。
2.3 活性炭吸附法分离纯化甘油半乳糖苷工艺条件的优化
在单因素试验的基础上,采用L9(34)正交表进行正交优化试验,试验设计及结果分析见表1。

表1 L9(334)正交试验设计和结果Table1 Design and results of L9((334) orthogonal arrraayy

表2 正交试验结果方差分析Table2 ANOVA analysis
因素极差越大,说明因素的水平改变对试验结果影响也越大,该试验中影响因素主次顺序为:A>B>C。由表2可知,在95%置信水平下,反应液稀释倍数和活性炭用量具有显著性,与直观分析的结果具有一致性。根据极差分析结果,理论上的最佳工艺组合为A2B3C3,即反应液稀释倍数为20、活性炭用量2 g/mL、洗脱剂乙醇体积分数70%。
根据正交试验结果,最佳工艺组合为A2B3C1,即反应液稀释倍数为20、活性炭用量2 g/mL、洗脱剂乙醇体积分数30%。根据单因素试验结果,推测出甘油半乳糖苷最佳分离纯化工艺条件是:A2B2C2,即反应液稀释倍数为20、活性炭用量为1.5 g/mL、洗脱剂乙醇体积分数为50%。

表3 最佳工艺组合验证结果Table3 Verification of three optimal conditions for the purification of glycerol galactoside
对上述3 个工艺组合进行验证,结果见表3。A2B3C3工艺组合中甘油半乳糖苷的回收率最高(64.79%),而A2B3C1工艺组合中甘油半乳糖苷的纯度最高(48.84%),综合考虑甘油半乳糖苷的回收率和纯度,选择A2B3C1为最佳工艺条件,即稀释倍数为20、活性炭用量为2 g/mL、洗脱剂乙醇体积分数为30%。在此条件下,甘油半乳糖苷回收率和纯度分别为62.53%和48.84%,比单因素试验结果分别高4.52%和4.76%。
2.4 甘油半乳糖苷葡聚糖凝胶G-15柱层析纯化

图5 甘油半乳糖苷葡聚糖凝胶G-15层析图Fig.5 G-15 chromatogram of glycerol galactoside
由图5可知,甘油半乳糖苷主要集中在第10~40管,即洗脱体积为19~80 mL,第40管以后无甘油半乳糖苷,主要为甘油和半乳糖,合并10~40 管的收集物,经HPLC检测(图6),产物的纯度为97.80%。

图6 纯化甘油半乳糖苷HPLC图谱Fig.6 HPLC chromatogram of purified glycerol galactoside
2.5 质谱确认纯化后的产物
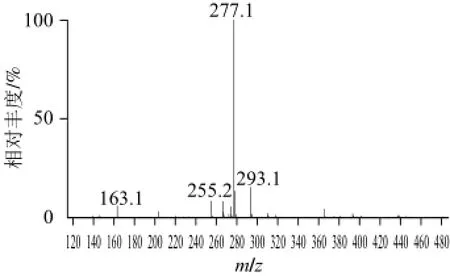
图7 甘油半乳糖苷质谱图Fig.7 Mass spectrum of glycerol galactoside
将G-15柱分离后的产物用质谱仪进行鉴定,分析结果如图7所示。255:[M+H]+;277: [M+Na]+;293:[M+K]+;163:[半乳糖基碎片+H]+。由此可以推断出甘油半乳糖苷的相对分子质量是254,表明产物为甘油单半乳糖苷[22]。
3 结 论
活性炭吸附法分离纯化甘油半乳糖苷的效果优于溶剂萃取法。正交试验结果表明,各因素对甘油半乳糖苷回收率影响的作用大小顺序为:反应液稀释倍数>活性炭用量>洗脱剂乙醇体积分数。分离纯化的最佳工艺参数为:反应液稀释倍数20、活性炭用量2 g/mL、洗脱剂乙醇体积分数为30%,在此工艺条件下,甘油半乳糖苷回收率和纯度分别为62.53%和48.84%,比单因素结果分别高4.52%和4.76%。经活性炭纯化的甘油半乳糖苷经葡聚糖凝胶G-15柱层析进一步纯化,其纯度可达97.80%。产物经质谱鉴定为甘油单半乳糖苷。
[1] SCHWARZ A, THOMSEN M S, NIDETZKY B. Enzymatic synthesis of β-glucosylglycerol using a continuous-flow microreactor containing thermostable β-glycoside hydrolase CelB immobilized on coated microchannel walls[J]. Biotechnology and Bioengineering, 2009, 103(5): 866-872.
[2] ISHIDA N, IRIKURA D, MATSUDA K, et al. Enzymatic synthesis of Mycoplasma fermentans specific glycoglycerophospholipid from 1,2-dipalmitoylglycerol[J]. Journal of Bioscience and Bioengineering, 2010, 109(4): 341-345.
[3] COLOMBO D, COMPOSTELLA F, RONCHE TTI F, et al. Chemoenzymatic synthesis and antitumor promoting activity of 6’-and 3-esters of 2-O-β-D-glucosylglycerol[J]. Bioorganic and Medicinal Chemistry Letters, 1999, 7(9): 1867-1871.
[4] COLOMBO D, SCALA A, TAINO I M, et al. 1-O-, 2-O- and 3-O-βglycosyl- sn-glycerols: structure-anti-tumor- promoting activity relationship[J]. Bioorganic and Medicinal Chemistry Letters, 1996, 6(10): 1187-1190.
[5] KISSELL L T, MECHAM D K, MEHLTRETTER C L. Fatty-acid esters of alkoxylated polyol glycosides as emulsifiers in white layer cake[J]. Cereal Chemistry, 1974, 51(5): 616-622.
[6] FEUGE R O, BROWN M, WHITE J L. Surface activity of glycerol glycoside palmitates[J]. Journal of the American Oil Chemistry Society, 1972, 49(11): 672-673.
[7] de SOUZA L M, SASSAKI G L, ROMANOS M T V, et al. Structural characterization and anti-HSV-1 and HSV-2 activity of glycolipids from the marine algae Osmundaria obtusiloba isolated from southeastern brazilian coast[J]. Marine Drugs, 2012, 10(4): 918-931.
[8] CATENI F, BONIVENTO P, PROCIDA G, et al. Chemoenzymatic synthesis and antimicrobial activity evaluation of monoglucosyl diglycerides[J]. Bioorganic and Medicinal Chemistry, 2007, 15(2): 815-826.
[9] CATENI F, BONIVENTO P, PROCIDA G, et al. Chemoenzymatic synthesis and antimicrobial activity evaluation of monogalactosyl diglycerides[J]. European Journal of Medicinal Chemistry, 2008, 43(1): 210-221.
[10] WEI Wei, QI Danping, ZHAO Haizhen, et al. Synthesis and characterisation of galactosyl glycerol by β-galactosidase catalysed reverse hydrolysis of galactose and glycerol[J]. Food Chemistry, 2013, 141(3): 3085-3092.
[11] 卢炳环, 刘学民, 金征宇. 乙二醇葡萄糖苷的制备与分离提纯[J]. 食品科技, 2006, 31(9): 161-163.
[12] MORALES V, SANZ M L, OLANO A. Rapid separation on activated charcoal of high oligosaccharides in honey[J]. Chromatographia, 2006, 64(3/4): 233-238.
[13] 林君智. 乙二醇葡萄糖苷及其己酸酯的制备与纯化[D]. 无锡: 江南大学, 2007.
[14] 卢炳环. 多羟基化合物的制备与性能研究[D]. 无锡: 江南大学, 2008.
[15] 隋明, 邓林. 活性炭吸附木二糖的参数研究[J]. 包装与食品机械, 2012, 30(6): 19-21.
[16] 丁堃. 活性炭吸附水中邻苯二甲酸二丁酯及介质阻挡放电再生活性炭的实验研究[D]. 南昌: 南昌大学, 2012.
[17] 罗来盛, 周美华. 微波活化制备加拿大一枝黄花活性炭及对Cd(Ⅱ)的吸附[J]. 环境工程学报, 2012, 6(5): 1543-1547.
[18] 李道义, 江正强, 韦赟, 等. 低聚甘露糖的酶法制备、分离与结晶[J].食品科学, 2005, 26(增刊1): 58-60.
[19] 张志清, 姚艳艳, 杨雪飞, 等. 应用粉末活性炭纯化阿魏酸粗提液的研究[J]. 食品工业科技, 2011, 32(12): 310-313.
[20] 冯昕, 陶静, 王吉中, 等. 麦麸低聚木糖产品的分离纯化及定性分析[J].食品工业, 2012, 33(8): 80-83.
[21] 侯丽芬, 孙向阳, 丁长河, 等. 树脂和活性炭法分离纯化低聚木糖的研究[J]. 农产品加工: 学刊, 2009(11): 27-29.
[22] 金欣, 赵淑芳. 电喷雾质谱剖析多元醇葡糖苷的组成与结构[J]. 青岛科技大学学报: 自然科学版, 2011, 32(6): 635-640.
Separation, Purification and Characterization of Synthetic Glycerol Galactoside
WEI Wei, QI Dan-ping, MA Rong, ZHANG Chong, LÜ Feng-xia, BIE Xiao-mei, LU Zhao-xin, ZHAO Hai-zhen*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Glycerol galactoside was synthesized from glycerol and galactose under the catalysis of β-galactosidase. Activated carbon adsorption method was used to separate and purify the product. An L9(34) orthogonal design based on singlefactor experiments were employed to optimize the purification process. The obtained pr oduct was further purified by G-15 chromatography column. The optimized purification conditions were established as follows: 20-fold dilution of the reaction product, activate carbon addition at a ratio of 2 g/mL and desorption with 30% ethanol. Under these conditions, the recovery rate and purity of glycerol galactoside were 62.53% and 48.84%, respectively, which showed an increase of 4.52% and 4.76%, respectively, over those obtained from single-factor experiments. The glycerol galactoside obtained from activated carbon adsorption was further purified through Sephadex G-15 chromatography column, and its purity was increased to 97.80%. The product was identified as glycerol monogalactoside by mass spectrometry (MS).
glycerol galactoside; separation and purification; orthogonal array experiments; activated carbon absorption
TS202
A
1002-6630(2014)11-0001-05
10.7506/spkx1002-6630-201411001
2013-07-22
国家自然科学基金青年科学基金项目(31301558);中央高校基本科研业务费专项资金项目(KJQN201427);江苏省自然科学基金项目(BK2010456)
魏微(1989—),女,硕士研究生,研究方向为食品生物技术。E-mail:2011108055@njau.edu.cn
*通信作者:赵海珍(1975—),女,副教授,博士,研究方向为食品生物技术。E-mail:zhaohz@njau.edu.cn
